1 . 常温下,PdCO3和Pd(OH)2的沉淀溶解平衡曲线如图所示。下列说法正确的是
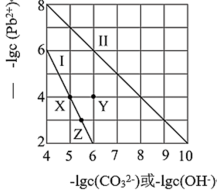
| A.向Z点对应溶液中加入适量的NaOH溶液,有可能得到X点对应溶液 |
| B.Y点对应的PdCO3分散系中,v(溶解)>v(沉淀),固体仍在溶解 |
C.PbCO3(s)+2OH-(aq) Pb(OH)2(s)+ Pb(OH)2(s)+ K=0.01 K=0.01 |
| D.由两者的Ksp可知,Pd(OH)2的溶解度更小 |
您最近半年使用:0次
名校
解题方法
2 . 下列液体均处于25 ℃,有关叙述正确的是
| A.向Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)不变 |
| B.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| C.AgCl在等物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.AgBr溶液中的c(Ag+)·c(Br−)是一个常数 |
您最近半年使用:0次
2023-03-28更新
|
259次组卷
|
3卷引用:四川省雅安中学2022-2023学年高二下学期期中考试化学试题
3 . 已知如下物质的溶度积常数: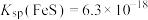 ,
, 。下列说法正确的是
。下列说法正确的是
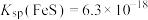 ,
, 。下列说法正确的是
。下列说法正确的是| A.同温度下,CuS的溶解度大于FeS的溶解度 |
B.同温度下,向饱和FeS溶液中加入少量 固体后, 固体后,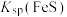 变小 变小 |
C.向含有等物质的量的 和 和 的混合溶液中逐滴加入 的混合溶液中逐滴加入 溶液,最先出现的沉淀是FeS 溶液,最先出现的沉淀是FeS |
D.除去工业废水中的 ,可以选用FeS作沉淀剂 ,可以选用FeS作沉淀剂 |
您最近半年使用:0次
2023-02-14更新
|
444次组卷
|
24卷引用:四川省雅安中学2022-2023学年高二下学期期中考试化学试题
四川省雅安中学2022-2023学年高二下学期期中考试化学试题(已下线)2010年广东省东莞市高二第二学期期末考试化学A卷(已下线)2011-2012学年福建师大附中高二上学期期末考试化学试卷2014-2015甘肃省高台县一中高二上学期期末考试化学试卷2015-2016学年山东省平度市高二上学期直升班抽考化学试卷2015-2016学年山东省青岛市平度市高二上学期教学质检化学试卷2015-2016学年湖南省衡阳八中高二上学期期末化学试卷黑龙江省大庆十中2018-2019学年高二上学期期末考试化学试题陕西省榆林市第二中学2019-2020学年高二上学期第二次月考化学试题甘肃省张掖市2019—2020学年高二上学期期末学业水平质量检测化学试题黑龙江省牡丹江市穆棱市第一中学2019-2020学年高二上学期期末考试化学试题(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题陕西省安康市2020-2021学年高二上学期期末化学试题甘肃省天水市一中2020-2021学年高二上学期第二学段(期末)考试化学试题安徽省六安市新安中学2020-2021学年高二下学期入学考试(重点班)化学试题广西梧州市蒙山中学2020-2021学年高二下学期4月月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期期中考试化学试题贵州省贵阳市普通中学2021-2022学年高三上学期期末考试化学试题第四节 沉淀溶解平衡 第1课时 难溶电解质的沉淀溶解平衡辽宁省锦州市渤海大学附属高级中学2022-2023学年高二上学期期末考试化学试题第2课时 沉淀溶解平衡的应用(已下线)专题08 沉淀溶解平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)北京市育才学校2023-2024学年高一上学期化学期中试题北京市育才学校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . 陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为 ,还含有少量的铝箔,
,还含有少量的铝箔, 等杂质)制备碳酸钴的工艺流程如图:
等杂质)制备碳酸钴的工艺流程如图:
 ,还含有少量的铝箔,
,还含有少量的铝箔, 等杂质)制备碳酸钴的工艺流程如图:
等杂质)制备碳酸钴的工艺流程如图: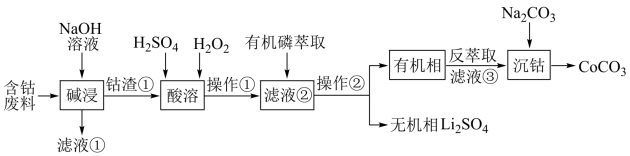
A.“滤液①”主要成分是 |
| B.“操作①”、“操作②”的分离方法不相同 |
C.“酸溶”中 的作用是作氧化剂 的作用是作氧化剂 |
D.“沉钴”时 的滴速过快或浓度太大将导致产品不纯,其原因是溶液碱性增强会产生 的滴速过快或浓度太大将导致产品不纯,其原因是溶液碱性增强会产生 |
您最近半年使用:0次
2021-10-27更新
|
51次组卷
|
2卷引用:四川省雅安市天立学校2022-2023学年高二下学期第三次月考化学试题
5 . 下列方程式与所给事实不相符的是
A.NH4Cl溶液呈酸性:NH +H2O +H2O NH3·H2O+H+ NH3·H2O+H+ |
B.用KI溶液将AgCl转化为AgI:I-(aq)+AgCl(s)  AgI(s)+Cl-(aq) AgI(s)+Cl-(aq) |
C.加热氯化铜溶液,溶液变为黄绿色:Cu2++2H2O Cu(OH)2+2H+ Cu(OH)2+2H+ |
| D.用氯化铁溶液腐蚀覆铜板上的铜:2Fe3++Cu=Cu2++2Fe2+ |
您最近半年使用:0次
解题方法
6 . 三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3,工艺流程如下:
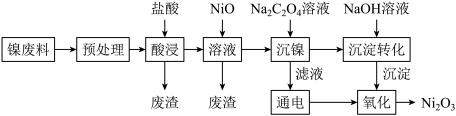
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
(1)“预处理”操作选择用酒精清洗的目的是_______ 。
(2)“酸浸”时,①温度不宜过高,原因_______ 。
②常温下,盐酸的浓度为2.5mol·L-1,“液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为_______ ,主要的原因是_______ 。

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH调到2时,c(Fe3+)=_______ 。加NiO调节pH的范围为_______ 。(已知:Ksp[Fe(OH)3]=4.0×10-38)
(4)加入Na2C2O4溶液“沉镍”得到的沉淀为_______ 。
(5)电解过程中产生的氯气在碱性条件下生成ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式_______ 。

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 |
| 开始沉淀时pH | 1.8 | 3.0 | 7.1 | 5.8 |
| 完全沉淀时pH | 3.2 | 5.0 | 9.2 | 8.0 |
(2)“酸浸”时,①温度不宜过高,原因
②常温下,盐酸的浓度为2.5mol·L-1,“液固比”与镍的浸出率的关系如图所示,实际生产采取的“液固比”为

(3)室温下,“浸出”所得溶液中Fe3+的浓度为0.2mol·L-1,当溶液的pH调到2时,c(Fe3+)=
(4)加入Na2C2O4溶液“沉镍”得到的沉淀为
(5)电解过程中产生的氯气在碱性条件下生成ClO-,再把二价镍氧化为三价镍,写出“氧化”反应的离子反应方程式
您最近半年使用:0次
2021-06-10更新
|
938次组卷
|
3卷引用:四川省雅安市2021届高三下学期5月第三次诊断考试理综化学试题
7 . 下列有关说法中正确的是
A. 难溶于水,溶液中没有 难溶于水,溶液中没有 和 和 |
B.废水中的 、 、 等可用 等可用 做沉淀剂 做沉淀剂 |
C.锅炉除水垢是将 转化为 转化为 |
D.25℃时 溶液中,若离子积 溶液中,若离子积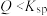 ,溶液中有沉淀析出 ,溶液中有沉淀析出 |
您最近半年使用:0次
2021-01-14更新
|
233次组卷
|
2卷引用:四川省雅安市2020-2021学年高二下学期期末检测化学试题
11-12高二下·浙江温州·期末
名校
解题方法
8 . 为了除去氯化镁酸性溶液中的铁离子,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
| A.一水合氨 | B.烧碱 | C.碳酸镁 | D.碳酸钠 |
您最近半年使用:0次
2020-07-03更新
|
253次组卷
|
13卷引用:2012-2013学年四川省雅安市高二下学期期末检测化学试卷
(已下线)2012-2013学年四川省雅安市高二下学期期末检测化学试卷(已下线)2011-2012学年浙江省温州市十校联合体高二下学期期末考试化学试卷(已下线)2012-2013学年江苏省宿迁市泗洪县洪翔中学高二下学期期中考化学卷(已下线)2014届福建省福州市高三上学期期末质量检测化学试卷2015届福建省三明市一中高三上学期第二次月考化学试卷黑龙江省大庆第一中学2017-2018学年高二上学期期末(第四次月考)考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期10月考试化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(能力卷)试题2020届高三化学二轮冲刺新题专练——过滤(抽滤)、蒸发、结晶等除杂分离法北京市中国人民大学附属中学 2019-2020 学年度高二下学期期末练习化学试题(已下线)3.3.2 影响盐类水解的因素(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)山西省稷山中学2021-2022学年高二上学期第二次月考化学试题云南省昆明师范专科学校附属中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
9 . 常温下,Ksp(ZnS)=l.6×10-24,Ksp(FeS)=6.4×10-18,其中FeS为黑色晶体,ZnS是一种白色颜料的组成成分。下列说法正确的是
| A.向物质的量浓度相等的FeSO4和ZnSO4混合液中滴加Na2S溶液,先产生黑色沉淀 |
| B.常温下,反应FeS(s)+Zn2+(aq)⇌ZnS(s)+Fe2+(aq)的平衡常数K=4.0×l06 |
| C.在ZnS的饱和溶液中,加入FeSO4溶液,一定不会产生FeS沉淀 |
| D.向FeS悬浊液中通入少许HCl,c(Fe2+)与Ksp(FeS)均增大 |
您最近半年使用:0次
2020-05-25更新
|
696次组卷
|
9卷引用:四川省雅安中学2019-2020学年高二6月月考(期中)理综化学试题
四川省雅安中学2019-2020学年高二6月月考(期中)理综化学试题贵州省铜仁市2020年高三适应性考试(一)理综化学试题(已下线)3.4.2 沉淀溶解平衡的应用(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)第10练 沉淀溶解平衡-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)江苏省扬州中学2021-2022学年高三下学期3月月考化学试题(已下线)押新高考卷13题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(新高考通版)山东省济南大学城实验高中2021-2022学年高三3月阶段性调研化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)黑龙江省哈尔滨市第一中学校2022-2023学年高三上学期12月月考化学试题
名校
10 . CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:
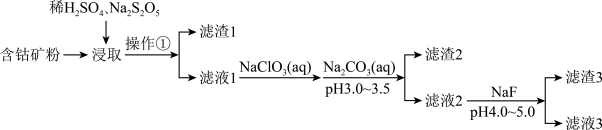
已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
回答下列问题:
(1)操作①的名称为_________ ,NaClO3具有氧化性,其名称为__________________ 。
(2)浸取中加入Na2S2O5的作用是___________________________ 。
(3)滤液1中加入NaClO3的作用是_______________________________________ ,相关的离子方程式为__________________________________________ 。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________ 。
(5)滤渣3主要成分为________________________ (写化学式)。
滤液3经过多次萃取与反萃取制备CoCl2晶体
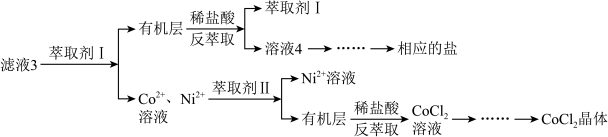
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是_______________________ 。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是_________________________________ 。

已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
| Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
| 开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
| 完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
回答下列问题:
(1)操作①的名称为
(2)浸取中加入Na2S2O5的作用是
(3)滤液1中加入NaClO3的作用是
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为
(5)滤渣3主要成分为
滤液3经过多次萃取与反萃取制备CoCl2晶体

(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是
您最近半年使用:0次
2019-09-07更新
|
274次组卷
|
2卷引用:四川省雅安市雅安中学2020届高三上学期开学摸底考试(9月)化学试题



