1 . 常温下,金属离子(Mn+)浓度的负对数pM[pM=-lgc(Mn+)]随溶液pH变化关系如图所示。当c(Mn+)≤10-6mol/L时认为该金属离子已沉淀完全,下列叙述正确的是
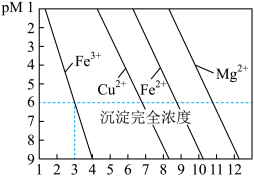

| A.常温下,Mg(OH)2的溶解度比Cu(OH)2的溶解度小 |
| B.常温下,Fe(OH)3的溶度积常数为1.0×10-39 |
| C.除去含Cu2+溶液中的少量Fe2+,可加入适量H2O2后控制溶液3≤pH<7 |
| D.能通过调节溶液pH的方法分步沉淀Mg2+和Fe2+ |
您最近半年使用:0次
2023-04-29更新
|
462次组卷
|
4卷引用:四川省德阳市第五中学2022-2023学年高二下学期5月月考化学试题
2 . 常温下, 在水中的沉淀溶解平衡曲线如图所示。已知:
在水中的沉淀溶解平衡曲线如图所示。已知: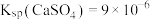 ,下列说法正确的是
,下列说法正确的是

 在水中的沉淀溶解平衡曲线如图所示。已知:
在水中的沉淀溶解平衡曲线如图所示。已知: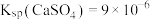 ,下列说法正确的是
,下列说法正确的是
A.在任何溶液中,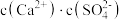 均相等 均相等 |
| B.d点溶液通过蒸发可以变到c点 |
C.b点对应的 大于a点对应的 大于a点对应的 |
D.b点将有沉淀生成,平衡后溶液中 一定小于 一定小于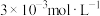 |
您最近半年使用:0次
2023-04-05更新
|
548次组卷
|
6卷引用:四川省德阳市广汉中学2022-2023学年高二下学期第一次月考化学试题
四川省德阳市广汉中学2022-2023学年高二下学期第一次月考化学试题2017届湖南省株洲市高三上教学质检一化学试卷四川省内江市第六中学2022-2023学年高二下学期期中考试化学试题(已下线)专题五 沉淀溶解平衡图象(练)(已下线)T13-溶液中的离子平衡云南省保山市高(完)中C、D类学校2022-2023学年高二下学期6月份联考化学试题
名校
解题方法
3 . 工业上利用废铁屑(含少量氧化铝和氧化铁等)生产高铁酸钾(K2FeO4)的工艺流程如图:
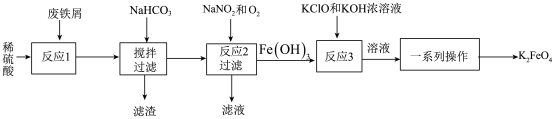
已知:流程中Fe2+被氧化的过程中NO可做催化剂。
回答下列问题:
(1)反应1中发生的氧化还原反应的离子方程式为______ ,______ 。
(2)根据题意推测流程中加入NaHCO3的目的是______ 。
(3)反应2中Fe2+被氧化的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率(Fe2+被氧化的量与反应前Fe2+总量之比)随时间的变化如图所示。
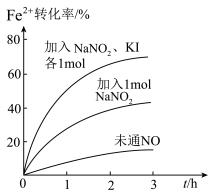
①加入NaNO2发生反应:2H++3NO =NO
=NO +2NO↑+H2O,该反应中若有6mol电子转移,得到的还原产物为
+2NO↑+H2O,该反应中若有6mol电子转移,得到的还原产物为______ mol。
②加入NaNO2、KI发生反应:4H++2NO +2I-=2NO↑+I2+2H2O,解释图中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O,解释图中该条件下能进一步提高单位时间内Fe2+转化率的原因:_____ 。
(4)写出反应3的离子方程式:______ 。
(5)K2FeO4可作为新型多功能水处理剂,其具有杀菌消毒功能的原因是_____ 。

已知:流程中Fe2+被氧化的过程中NO可做催化剂。
回答下列问题:
(1)反应1中发生的氧化还原反应的离子方程式为
(2)根据题意推测流程中加入NaHCO3的目的是
(3)反应2中Fe2+被氧化的过程中,控制起始时Fe2+的浓度、溶液体积和通入O2的速率不变,改变其他条件时,Fe2+被氧化的转化率(Fe2+被氧化的量与反应前Fe2+总量之比)随时间的变化如图所示。

①加入NaNO2发生反应:2H++3NO
 =NO
=NO +2NO↑+H2O,该反应中若有6mol电子转移,得到的还原产物为
+2NO↑+H2O,该反应中若有6mol电子转移,得到的还原产物为②加入NaNO2、KI发生反应:4H++2NO
 +2I-=2NO↑+I2+2H2O,解释图中该条件下能进一步提高单位时间内Fe2+转化率的原因:
+2I-=2NO↑+I2+2H2O,解释图中该条件下能进一步提高单位时间内Fe2+转化率的原因:(4)写出反应3的离子方程式:
(5)K2FeO4可作为新型多功能水处理剂,其具有杀菌消毒功能的原因是
您最近半年使用:0次
2023-03-29更新
|
346次组卷
|
2卷引用:四川省德阳中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
4 . 下列实验中,对现象的解释不正确 的是
| 选项 | A | B | C | D |
| 装置及操作 |  向右轻轻推动活塞压缩体积 | 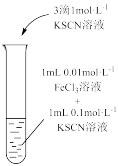 | 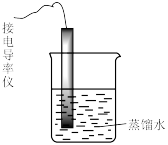 分别测定20℃和80℃蒸馏水的电导率 | 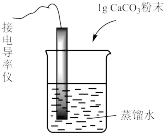 |
| 现象 | 气体红棕色先变深再变浅 | 溶液血红色加深 | 80℃蒸馏水的电导率大于20℃的 | 加入 粉末后电导率增大 粉末后电导率增大 |
| 解释 | 压强增大, 平衡先逆向移动,再正向移动 平衡先逆向移动,再正向移动 | 增大反应物浓度, 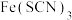 平衡正向移动 平衡正向移动 | 温度升高,水的电离平衡正向移动 |  在水中存在 在水中存在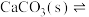  |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-01-06更新
|
926次组卷
|
13卷引用:四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题
四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市首都师范大学附属中学2022-2023学年高二上学期期末考试化学试题北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题河南省濮阳市第一高级中学2022-2023学年高二下学期期中质量检测化学试题北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 北京市第十三中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第五十中学2023-2024学年高二上学期12月月考化学试题天津市部分区2023-2024学年高二上学期期末练习化学试题北京交通大学附属中学第二分校2023-2024学年高二上学期12月月考化学试题
5 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O3、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
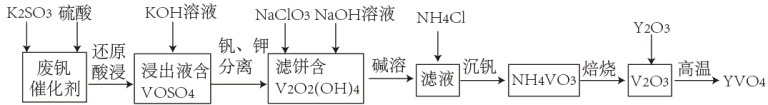
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是_______ 。V2O5被还原的离子方程式为_______ 。
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH_______ 7(填“>”“<”或“=”)。
(3)结合“碱溶”和“沉钒”可知, 、
、 中
中_______ 的氧化性更强,“沉钒”时发生反应的化学方程式为_______ 。
(4)利用上述表格数据,计算Fe(OH)2的Ksp=_______ 。
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为_______ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 阳离子 | VO2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mo/L)的pH | 3.0 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 7.0 | 3.2 | 9.0 |
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH
(3)结合“碱溶”和“沉钒”可知,
 、
、 中
中(4)利用上述表格数据,计算Fe(OH)2的Ksp=
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为
您最近半年使用:0次
名校
6 . 下列实验操作、实验现象和实验结论均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将大小相同的金属钠分别投入水和乙醇中 | 钠与水反应比钠与乙醇反应剧烈 | 乙醇羟基中的氢原子比水分子中的氢原子活泼 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 室温下,用pH试纸分别测定浓度为0.1 mol∙L−1NaClO溶液和0.1 mol∙L−1CH3COONa溶液的pH | pH试纸都变成碱色 | 可以用 pH试纸的颜色与标准比色卡比较,从而判断HClO和CH3COOH的酸性强弱 |
| D | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量Na2S溶液 | 开始有白色沉淀生成,后有黑色沉淀生成 | Ksp(Ag2S) <Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-01-01更新
|
577次组卷
|
6卷引用:四川省广汉中学2021届高三上学期“一诊”考试模拟检测化学试题
名校
解题方法
7 . 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是

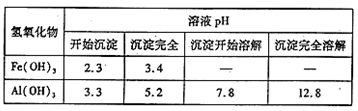
| A.OA段产生的沉淀为BaSO4和Fe(OH)3 |
| B.据图计算原溶液中c(Cl-)=c(SO42-) |
| C.AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-=2BaSO4↓+Al(OH)3↓ |
| D.C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3↓+OH一 |
您最近半年使用:0次
2018-04-11更新
|
1438次组卷
|
5卷引用:2015届四川省德阳市高中高三“二诊”考试化学试卷
2015届四川省德阳市高中高三“二诊”考试化学试卷2015届四川省德阳市高三4月模拟练习化学试卷湖南省衡阳市第八中学2018届高三(实验班)第三次质检化学试题(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检测陕西省西安市西安中学2020届高三下学期第3次考试化学试题



