1 . 利用如图装置探究铁在海水中的电化学防护,下列说法错误的是
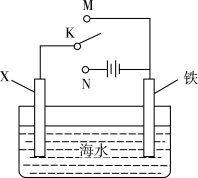

| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀 |
B.若X为锌棒,开关K置于M处,海水 降低 降低 |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀 |
| D.若X为碳棒,开关K置于N处,碳棒上发生氧化反应 |
您最近一年使用:0次
2022-12-10更新
|
542次组卷
|
3卷引用:上海市松江区2022-2023学年高三上学期一模测试化学试题
2 . 含可钝化金属的工业管道或反应器,由于会被内部溶液腐蚀,通过外接电源而钝化,称之为阳极保护法。下图是某金属外接电势与电流密度的变化关系,有关说法正确的是
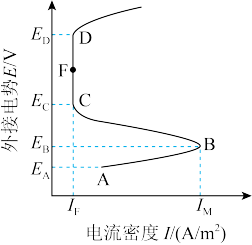

| A.阳极保护法中受保护的金属外接电源的负极 |
| B.电流密度越大,金属受保护程度越好 |
| C.CFD区,金属受到保护 |
| D.外接电势越高,对金属保护性越有效 |
您最近一年使用:0次
2022-06-14更新
|
907次组卷
|
4卷引用:江西省抚州市2022届高三下学期4月教学质量监测理综化学试题
江西省抚州市2022届高三下学期4月教学质量监测理综化学试题(已下线)专题11 金属的腐蚀与防护-备战2023年高考化学母题题源解密(广东卷)(已下线)第19讲 电解池 金属的电化学腐蚀与防护(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题
3 . 铁及其化合物在生活、生产中有着重要作用。请按要求回答下列问题。
(1)基态Fe原子的简化电子排布式为____ 。
(2)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同。
①用____ 实验测定铁晶体,测得A、B两种晶胞,其晶胞结构如图:
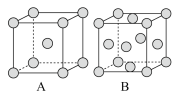
②A、B两种晶胞中含有的铁原子个数比为____ 。
③在A晶胞中,每个铁原子周围与它最近且相等距离的铁原子有____ 个。
(3)常温下,铁不易和水反应,而当撕开暖贴(内有透气的无纺布袋,袋内装有铁粉、活性炭、无机盐、水、吸水性树脂等)的密封外包装时,即可快速均匀发热。利用所学知识解释暖贴发热的原因:___ 。
(4)工业盐酸因含有[FeCl4]—而呈亮黄色,在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
①[FeCl4]—的中心离子是____ ,配体是____ ;其中的化学键称为____ 。
②取4mL工业盐酸于试管中,逐滴滴加AgNO3饱和溶液,至过量,预计观察到的现象有____ ,由此可知在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
(1)基态Fe原子的简化电子排布式为
(2)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同。
①用

②A、B两种晶胞中含有的铁原子个数比为
③在A晶胞中,每个铁原子周围与它最近且相等距离的铁原子有
(3)常温下,铁不易和水反应,而当撕开暖贴(内有透气的无纺布袋,袋内装有铁粉、活性炭、无机盐、水、吸水性树脂等)的密封外包装时,即可快速均匀发热。利用所学知识解释暖贴发热的原因:
(4)工业盐酸因含有[FeCl4]—而呈亮黄色,在高浓度Cl—的条件下[FeCl4]—才是稳定存在的。
①[FeCl4]—的中心离子是
②取4mL工业盐酸于试管中,逐滴滴加AgNO3饱和溶液,至过量,预计观察到的现象有
您最近一年使用:0次
2022-06-01更新
|
751次组卷
|
3卷引用:天津市河西区2022届高考三模化学试题
4 . 铁的腐蚀与防护与生产生活密切相关。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002
 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。
步骤2:向15.00 mL 1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。
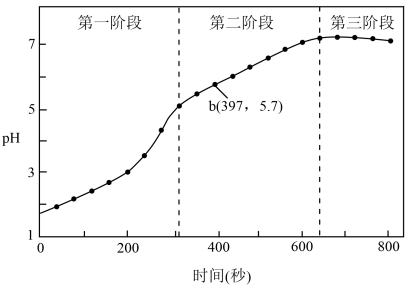
(1)第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为___________ 。
(2)第二、三阶段主要发生吸氧腐蚀。
①选取b点进行分析,经检验溶液中含有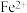 ,写出Fe被腐蚀的总反应
,写出Fe被腐蚀的总反应___________ 。
②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点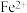 被氧化的离子方程式
被氧化的离子方程式___________ 。
③依据b点发生的反应,分析第二阶段pH上升的原因是___________ 。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知: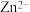 放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
①镀件Fe应与电源的___________ 相连。
②向 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将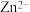 转化为
转化为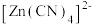 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是___________ 。
(4)电镀后的废水中含有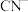 ,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c
,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 
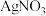 溶液滴定,消耗
溶液滴定,消耗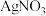 溶液V mL。已知:
溶液V mL。已知: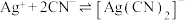 (无色)
(无色) 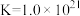 ,
,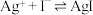
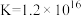 。
。
①滴定终点的现象是___________ 。
②废水中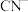 的含量是
的含量是___________  (填计算式)。
(填计算式)。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002

 溶液中浸泡,过滤后用水洗涤。
溶液中浸泡,过滤后用水洗涤。步骤2:向15.00 mL 1
 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。步骤3:采集溶液pH随时间变化的数据。

(1)第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为
(2)第二、三阶段主要发生吸氧腐蚀。
①选取b点进行分析,经检验溶液中含有
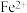 ,写出Fe被腐蚀的总反应
,写出Fe被腐蚀的总反应②取b点溶液向其中滴加KSCN无明显现象,加入稀盐酸后立即变红。写出b点
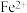 被氧化的离子方程式
被氧化的离子方程式③依据b点发生的反应,分析第二阶段pH上升的原因是
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:
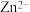 放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。
放电的速率缓慢且平稳,有利于得到致密、细腻的镀层。①镀件Fe应与电源的
②向
 电解液中加入NaCN溶液,将
电解液中加入NaCN溶液,将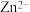 转化为
转化为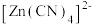 ,电解得到的镀层更加致密、细腻,原因是
,电解得到的镀层更加致密、细腻,原因是(4)电镀后的废水中含有
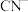 ,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c
,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c 
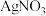 溶液滴定,消耗
溶液滴定,消耗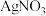 溶液V mL。已知:
溶液V mL。已知: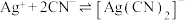 (无色)
(无色) 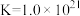 ,
,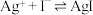
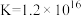 。
。①滴定终点的现象是
②废水中
 的含量是
的含量是 (填计算式)。
(填计算式)。
您最近一年使用:0次
2022-03-25更新
|
717次组卷
|
5卷引用:北京市丰台区2022届高三一模化学试题



