1 . 验证牺牲阳极法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
下列说法不正确 的是
| ① | ② | ③ |
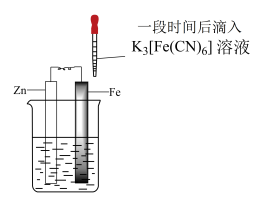 |  |  |
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
A.对比①②, 可能将Fe氧化 可能将Fe氧化 |
| B.对比②③,可以判定Zn保护了Fe |
C.用 酸性溶液代替 酸性溶液代替 溶液,也可验证牺牲阳极法 溶液,也可验证牺牲阳极法 |
| D.将Zn换成Cu,用①的方法无法判断Fe比Cu活泼 |
您最近一年使用:0次
2023-01-07更新
|
604次组卷
|
3卷引用:北京师范大学附属中学2022-2023学年上学期高二化学期末试题
2 . 利用如图装置探究铁在海水中的电化学防护,下列说法错误的是
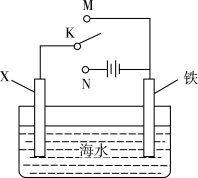

| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀 |
B.若X为锌棒,开关K置于M处,海水 降低 降低 |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀 |
| D.若X为碳棒,开关K置于N处,碳棒上发生氧化反应 |
您最近一年使用:0次
2022-12-10更新
|
542次组卷
|
3卷引用:新疆阿勒泰地区2022-2023学年高二上学期期末联考化学试题
名校
3 . 下列电极反应式与出现的环境相匹配的是
| 电极反应式 | 出现的环境 | |
| A | C2H5OH-12e-+3H2O=CO2↑+12H+ | 碱性环境下乙醇燃料电池的负极反应 |
| B | O2+2H2O-4e-=4OH- | 钢铁吸氧腐蚀的正极反应 |
| C | CO-2e-+CO =2CO2 =2CO2 | 熔融碳酸盐环境下的CO燃料电池负极 |
| D | 2H++2e-=H2↑ | 用惰性电极电解H2SO4溶液的阳极反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 电化学反应原理的实验装置如图所示。下列叙述错误的是
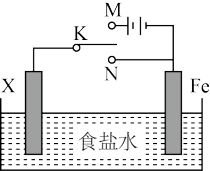

| A.若X为碳棒,开关K置于M处可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于M或N处都可减缓铁的腐蚀 |
| C.若X为锌棒,开关K置于N处时,为牺牲阳极的阴极保护法 |
| D.若X为碳棒,开关K置于N处时,X电极上发生的反应为2H+ +2e-=H2↑ |
您最近一年使用:0次
2022-09-06更新
|
918次组卷
|
16卷引用:河南省濮阳市2021-2022学年高二上学期期末学业质量监测化学试题
河南省濮阳市2021-2022学年高二上学期期末学业质量监测化学试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二上学期期末考试化学试题云南省玉溪第三中学2021-2022学年高二下学期3月入学考试化学试题第三节 金属的腐蚀与防护云南省曲靖市马龙区第一中学2021-2022学年高二下学期3月考试化学试题新疆柯坪县柯坪湖州国庆中学2021-2022学年高二3月月考化学试题(已下线)4.3 金属的腐蚀与防护-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)河北省唐山市第二中学2022-2023学年高二上学期期末考试化学试题山东省章丘市第一中学2020-2021学年高二上学期9月月考化学试题内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期期中考试化学试题河北省迁安市第一中学2020-2021学年高二上学期期中考试化学试题(已下线)4.3.2 金属(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)的防护安徽省六安市城南中学2021届高三上学期第三次月考化学试题山东省济南德润高级中学2021-2022学年高二上学期10月月考化学试题河北省保定市博野中学2021-2022学年高二上学期12月月考化学试题浙江省宁波市余姚中学2020-2021学年高二上学期期中考试化学试题
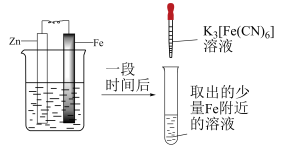
5 . 实验小组研究金属电化学腐蚀,实验如下:
实验Ⅰ

5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ
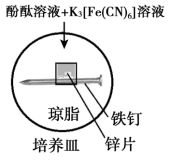
5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是
实验Ⅰ

5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ

5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是
| A.实验Ⅱ中Zn保护了Fe,使铁的腐蚀速率比实验Ⅰ慢 |
B.实验Ⅱ中正极的电极反应式: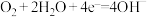 |
C.实验Ⅰ的现象说明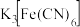 溶液与Fe反应生成了 溶液与Fe反应生成了 |
| D.若将Zn片换成Cu片,推测Cu片周边会出现红色,铁钉周边会出现蓝色 |
您最近一年使用:0次
2022-09-04更新
|
1372次组卷
|
13卷引用:山东省枣庄市第一中学2022-2023学年高二上学期期末达标化学试题
山东省枣庄市第一中学2022-2023学年高二上学期期末达标化学试题北京市朝阳区2021届高三上学期期末考试化学试题北京市第十二中学2021-2022学年高一下学期6月月考化学试题北京十二中2021-2022学年高一下学期六月月考(等级考)化学试题(已下线)【教材实验热点】17 金属的腐蚀与防护第四章 综合拔高练北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题(已下线)2021年高考化学押题预测卷(辽宁卷)(03)(已下线)北京市第四中学2021-2022学年高二上学期期中考试化学试题福建省龙岩市连城县第一中学2023-2024学年高二上学期8月月考化学试题山东省滨州市2023-2024学年高三上学期11月期中考试化学试题
6 . 用下列仪器或装置(夹持装置略)进行相应实验,能达到实验目的的是
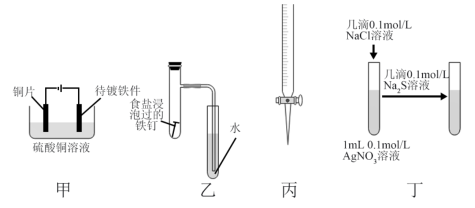

| A.甲装置:完成铁件上镀铜 |
| B.乙装置:验证铁的吸氧腐蚀 |
| C.丙装置:量取20.00mL NaOH溶液 |
D.丁装置:比较AgCl和 溶解度大小 溶解度大小 |
您最近一年使用:0次
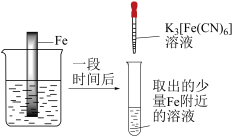
7 . 下列实验装置或操作正确,且能达到相应实验目的的是
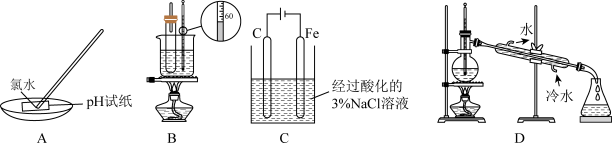

| A.图A是测定氯水的pH | B.图B是实验室制备硝基苯 |
| C.图C是用铁氰化钾溶液验证牺牲阳极法保护铁 | D.图D是分离苯和溴苯 |
您最近一年使用:0次
名校
解题方法
8 . 潮湿土壤中的铁管道在硫酸盐还原菌(最佳生存环境 为7~8)作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示。下列说法错误的是
为7~8)作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示。下列说法错误的是
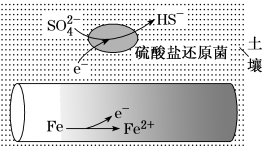
 为7~8)作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示。下列说法错误的是
为7~8)作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图所示。下列说法错误的是
| A.铁作负极发生氧化反应 |
B.正极反应为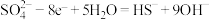 |
| C.将管道连接废锌块可防止腐蚀 |
| D.酸性环境下铁管道不易被硫酸根腐蚀 |
您最近一年使用:0次
2022-07-07更新
|
800次组卷
|
5卷引用:山东省潍坊2021-2022学年高一下学期期末测试化学试题
解题方法
9 . 工业废水中的六价铬[Cr(VI)]常采用还原沉淀法、离子交换法和微生物法等方法进行处理。
(1)室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4⇌H++HCrO ΔH1
ΔH1
HCrO ⇌H++CrO
⇌H++CrO ΔH2
ΔH2
2HCrO ⇌
⇌ +H2O ΔH3
+H2O ΔH3
室温下,反应2CrO +2H+⇌
+2H+⇌ +H2O的ΔH=
+H2O的ΔH=_______ (用含ΔH1、ΔH2或ΔH3的代数式表示)。
(2)还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力, 将
将 还原为Cr3+的离子方程式为
还原为Cr3+的离子方程式为_______ 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是_______ 。
(3)微生物法:
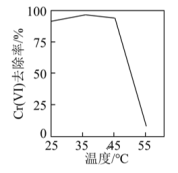
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是_______ 。
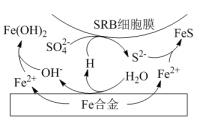
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+,_______ 。
(4)离子交换法:用强碱性离子交换树脂(ROH)与 和HCrO
和HCrO 等发生离子交换,交换过程中发生如下反应:
等发生离子交换,交换过程中发生如下反应:
ROH(s)+HCrO (aq)⇌ RHCrO4(s)+OH-(aq)
(aq)⇌ RHCrO4(s)+OH-(aq)
2ROH(s)+ (aq)⇌ R2CrO4(s)+2OH-(aq)
(aq)⇌ R2CrO4(s)+2OH-(aq)
其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是_______ 。
(1)室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4⇌H++HCrO
 ΔH1
ΔH1HCrO
 ⇌H++CrO
⇌H++CrO ΔH2
ΔH22HCrO
 ⇌
⇌ +H2O ΔH3
+H2O ΔH3室温下,反应2CrO
 +2H+⇌
+2H+⇌ +H2O的ΔH=
+H2O的ΔH=(2)还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力,
 将
将 还原为Cr3+的离子方程式为
还原为Cr3+的离子方程式为②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是

②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+,

(4)离子交换法:用强碱性离子交换树脂(ROH)与
 和HCrO
和HCrO 等发生离子交换,交换过程中发生如下反应:
等发生离子交换,交换过程中发生如下反应:ROH(s)+HCrO
 (aq)⇌ RHCrO4(s)+OH-(aq)
(aq)⇌ RHCrO4(s)+OH-(aq)2ROH(s)+
 (aq)⇌ R2CrO4(s)+2OH-(aq)
(aq)⇌ R2CrO4(s)+2OH-(aq)其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是
您最近一年使用:0次
10 . 下列说法正确的是
| A.反应物用量增加后,有效碰撞次数增多,反应速率一定增大 |
| B.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| C.△H<0、△S>0的反应在任何温度下都能自发进行 |
| D.铜铁交接处,在潮湿的空气中直接发生反应:Fe-3e-=Fe3+,继而形成铁锈 |
您最近一年使用:0次
2022-02-19更新
|
352次组卷
|
2卷引用:湖北省荆州市八县市2021-2022学年高二上学期期末质量检测化学试题



