1 . 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
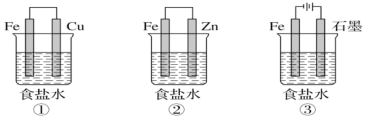
(1)某研究性学习小组设计了如图(包括①②③装置)所示装置探究钢铁的腐蚀与防护。为防止金属Fe被腐蚀,可以采用上述___________ (填装置序号)装置原理进行防护。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐碱性燃料电池原理示意图,电极为镁合金和铂合金。
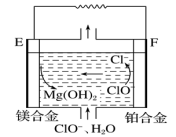
E为该燃料电池的___________ (填“正”或“负”)极。F电极上的电极反应式为 ___________ 。
(3)电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :
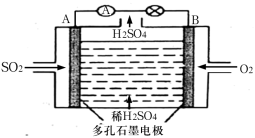
①电解质溶液中SO 离子向
离子向___________ (填“A极”或“B极” )移动。
②请写出正极电极反应式___________ 。
③用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为___________ 。
(1)某研究性学习小组设计了如图(包括①②③装置)所示装置探究钢铁的腐蚀与防护。为防止金属Fe被腐蚀,可以采用上述

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐碱性燃料电池原理示意图,电极为镁合金和铂合金。

E为该燃料电池的
(3)电化学技术是有效解决 CO、SO2、NOx 等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下 :

①电解质溶液中SO
 离子向
离子向②请写出正极电极反应式
③用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为
您最近半年使用:0次
名校
2 . 电化学原理在防止金属腐蚀、能最转换、物质合成、环境治理等方面应用广泛。研究金属腐蚀和防腐的原理很有现实意义。
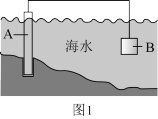
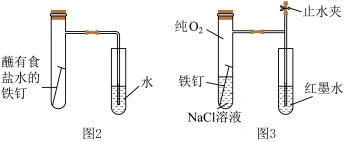
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择________ (填标号)。
A.碳棒 B.锌板 C.铜板
(2)某兴趣小组按图2装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有 (填序号)。
(3)该小组将图2装置改进成图3装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐________ (填“加快”“不变”或“减慢”),你认为影响因素为________ 。
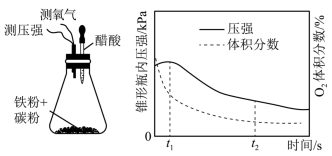
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生________ 腐蚀(填“吸氧”或“析氢”),原因________ 。
(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式_____________ 。


(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择
A.碳棒 B.锌板 C.铜板
(2)某兴趣小组按图2装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有 (填序号)。
| A.用纯氧气代替试管内空气 | B.用酒精灯加热试管提高温度 |
| C.将铁钉换成铁粉和炭粉混合粉末 | D.换成更细的导管,水中滴加红墨水 |
| 时间/min | 1 | 3 | 5 | 7 | 9 |
| 液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式
您最近半年使用:0次
3 . 电化学原理在能量转换、物质合成、防止金属腐蚀等方面应用广泛。回答下列问题:
(1)我国科学家最近发明了一种Zn—PbO2电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如图:
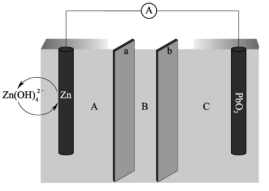
①电池中,Zn为___ 极(填“正”或“负”),PbO2电极的电极反应为___ 。
②B区域的电解质为___ (填“K2SO4”、“H2SO4”或“KOH”);阳离子交换膜为图中的___ 膜(填“a”或“b”)。
③此电池维持电流强度0.5A(相当于每秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造该电池所需的锌粉为6g,则电池失效时仍有___ %的金属锌未参加反应。
(2)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
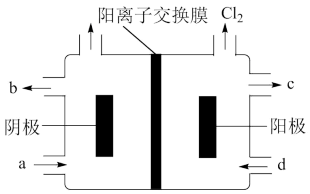
①收集到(CH3)4NOH的区域是___ (填a、b、c或d)。
②电解总反应的化学方程式为___ 。
(3)支撑海港码头基础的钢管桩,常用采用如图所示的方法进行防腐,其中高硅铸铁为惰性辅助阳极。
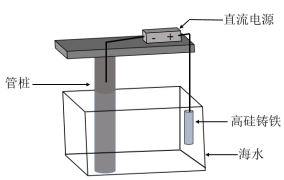
①该保护方法叫做___ (填“牺牲阳极法”或“外加电流法”)。
②下列有关表述正确的是___ (填序号)。
a.钢管桩被迫成为阴极而受到保护,其表面的腐蚀电流接近于零
b.高硅铸铁的作用是作为损耗阳极材料和传递电流
c.通电后,调整外加电压,外电路中的电子被强制从钢管桩流向高硅铸铁
d.石墨能导电且化学性质不活泼,可用石墨代替高硅铸铁作辅助阳极
(1)我国科学家最近发明了一种Zn—PbO2电池,电解质为K2SO4、H2SO4和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如图:

①电池中,Zn为
②B区域的电解质为
③此电池维持电流强度0.5A(相当于每秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造该电池所需的锌粉为6g,则电池失效时仍有
(2)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

①收集到(CH3)4NOH的区域是
②电解总反应的化学方程式为
(3)支撑海港码头基础的钢管桩,常用采用如图所示的方法进行防腐,其中高硅铸铁为惰性辅助阳极。

①该保护方法叫做
②下列有关表述正确的是
a.钢管桩被迫成为阴极而受到保护,其表面的腐蚀电流接近于零
b.高硅铸铁的作用是作为损耗阳极材料和传递电流
c.通电后,调整外加电压,外电路中的电子被强制从钢管桩流向高硅铸铁
d.石墨能导电且化学性质不活泼,可用石墨代替高硅铸铁作辅助阳极
您最近半年使用:0次
解题方法
4 . (1)合理使用化学知识可提高生活质量
①家用净水机常使用活性炭净水,其利用了活性炭的____________________ 性。
②误食重金属盐会使人中毒,应口服_______________ 来解毒
③自行车、助力车等雨雪天气骑行后,应及时擦干,否则一段时间后有些零件出现红棕色锈斑,主要原因是铁发生了___________________ (化学腐蚀、电化学腐蚀)。
④为防止白色污染,废旧的塑料需投入到贴下图所示的垃圾桶内,该标志表示的是_____________ 。

(2)均衡营养、合理用药是保证人体健康的重要保证,小明家某次晚餐菜谱如下图所示。
①菜谱中富含脂肪的食物是______________ 。
②鸡蛋中含有丰富的蛋白质,是人体需要的营养素之一,蛋白质在人体中完全水解的产物是___________ (填名称)。
③土豆丝中的主要营养物质是淀粉,写出淀粉的化学式__________ 。青椒、西红柿等蔬菜富含维生素C,维生素C 又称____________ 酸,用淀粉溶液和碘水可检验维生素C的_________ 性。
④当体内胃酸分泌过多时,医生会建议服用以下常用药物中的__________ (填字母)。
a.阿司匹林 b.青霉素片 C.复方氢氧化铝片 d.合成抗菌药
(3)创新发展能源、材料技术可推动人类社会的进步。
①近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油,如正戊烷C5H12,写出该反应的方程式____________________________________ 。
②可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,被看作是有望取代煤、石油的新能源。写出可燃冰(CH4·nH2O)在空气中充分燃烧的方程式__________ 。
③中国科学院昆明植物研究所许建初团队近日宣布,在塑料生物降解领域取得重大突破——发现了塔宾曲霉菌能对塑料的生物降解作用。写出聚乙烯塑料的结构简式________________________ 。
①家用净水机常使用活性炭净水,其利用了活性炭的
②误食重金属盐会使人中毒,应口服
③自行车、助力车等雨雪天气骑行后,应及时擦干,否则一段时间后有些零件出现红棕色锈斑,主要原因是铁发生了
④为防止白色污染,废旧的塑料需投入到贴下图所示的垃圾桶内,该标志表示的是

(2)均衡营养、合理用药是保证人体健康的重要保证,小明家某次晚餐菜谱如下图所示。
| 炒青菜、青椒土豆丝、银鱼炖蛋、芹菜香干、红烧五花肉、西红柿榨菜汤 |
①菜谱中富含脂肪的食物是
②鸡蛋中含有丰富的蛋白质,是人体需要的营养素之一,蛋白质在人体中完全水解的产物是
③土豆丝中的主要营养物质是淀粉,写出淀粉的化学式
④当体内胃酸分泌过多时,医生会建议服用以下常用药物中的
a.阿司匹林 b.青霉素片 C.复方氢氧化铝片 d.合成抗菌药
(3)创新发展能源、材料技术可推动人类社会的进步。
①近日,中科院大连化物所孙剑、葛庆杰研究员团队发现了二氧化碳高效转化新过程,通过设计一种新型多功能复合催化剂,首次实现了CO2 直接加氢制取高辛烷值汽油,如正戊烷C5H12,写出该反应的方程式
②可燃冰又称天然气水合物,是一种甲烷和水分子在低温高压情况下结合在一起的化合物,被看作是有望取代煤、石油的新能源。写出可燃冰(CH4·nH2O)在空气中充分燃烧的方程式
③中国科学院昆明植物研究所许建初团队近日宣布,在塑料生物降解领域取得重大突破——发现了塔宾曲霉菌能对塑料的生物降解作用。写出聚乙烯塑料的结构简式
您最近半年使用:0次
解题方法
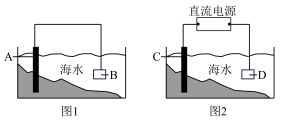
5 . 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择______ (填字母序号)。
a.碳棒 b.铜板 c.锌板 d.石墨块
(2)图2中,保护钢闸门C的方法叫_________________________________ 法。用氯化钠溶液模拟海水进行实验,D为石墨块,则如何检验D电极的产物____________________ 。
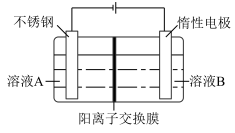
(3)以铬酸钾(K2CrO4)和KOH为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如上。溶液B是_________ ,产物在______ 室( 填“阴极”或“阳极”)得到。
已知:2CrO42- +2H+ Cr2O72-+H2O
Cr2O72-+H2O
(4)碳酸:H2CO3,Ka1=4.3×10-7,Ka2=5.6×10-11
草酸:H2C2O4,Ka1=5.9×10-2,Ka2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH______ 0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”);等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是_____ 。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____ 。(选填编号)
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) d.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(5)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。_____________ 。
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择
a.碳棒 b.铜板 c.锌板 d.石墨块
(2)图2中,保护钢闸门C的方法叫

(3)以铬酸钾(K2CrO4)和KOH为原料,电化学法制备重铬酸钾(K2Cr2O7)的实验装置示意图如上。溶液B是

已知:2CrO42- +2H+
 Cr2O72-+H2O
Cr2O72-+H2O(4)碳酸:H2CO3,Ka1=4.3×10-7,Ka2=5.6×10-11
草酸:H2C2O4,Ka1=5.9×10-2,Ka2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) d.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(5)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
您最近半年使用:0次
6 . 甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g) CH3OH(g)的反应热△H4=
CH3OH(g)的反应热△H4= 1 。
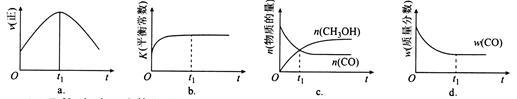
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是 2 (填选项字母)。
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)= 3 。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积 4 5 L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K= 5 。
(4)在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当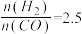 时,达到平衡状态,CH3OH的体积分数可能是图象中的
时,达到平衡状态,CH3OH的体积分数可能是图象中的 6 点。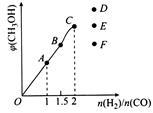
(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式: 7 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做 8 。
(6)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式: 9 。
 CH3OH(g)。
CH3OH(g)。已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g)
 CH3OH(g)的反应热△H4=
CH3OH(g)的反应热△H4=(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当
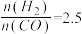 时,达到平衡状态,CH3OH的体积分数可能是图象中的
时,达到平衡状态,CH3OH的体积分数可能是图象中的
(5)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(6)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
您最近半年使用:0次
名校
解题方法
7 . (1)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标能体现空气的质量。下列各项指标不需要监测的是___________ 。
A.可吸入颗粒物(PM2.5) B.NO2浓度 C.SO2浓度 D.CO2浓度
②下列措施有利于改善环境质量的是___________ 。
A.将废电池深埋,以减少重金属的污染
B.将地沟油回收再加工为食用油,以减缓水体富营养化
C.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
(2)采取适当的措施能减少对环境的污染。
①酸雨是指pH___________ 的降水,大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因___________ 。
②一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为2C8H18+23O2 12CO2+4CO+18H2O
12CO2+4CO+18H2O
某环境监测兴趣小组的同学描绘的市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是____________ 。
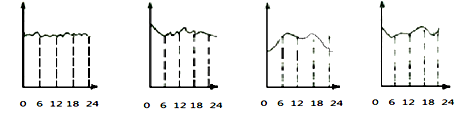
A B C D
③天然水中含有的细小悬浮颗粒可以用___________ 做混凝剂(写名称)进行净化处理。工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8至9时生成沉淀而除去,该反应的离子方程式是_____________ 。
(3)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是___________ (填字母)。
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种___________ (填字母)。
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗____________ (填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(4)化学与材料密切相关。
①人工合成的塑料有多种,其中聚乙烯是常见的塑料制品,结构简式是___________ 。
②钢铁的腐蚀主要发生吸氧腐蚀,其正极的电极反应为___________ 。为防止轮船的船体在海水中被腐蚀,一般在船身连接_____________ (填“锌块”或“铜块”)。
①空气质量报告的各项指标能体现空气的质量。下列各项指标不需要监测的是
A.可吸入颗粒物(PM2.5) B.NO2浓度 C.SO2浓度 D.CO2浓度
②下列措施有利于改善环境质量的是
A.将废电池深埋,以减少重金属的污染
B.将地沟油回收再加工为食用油,以减缓水体富营养化
C.利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯
(2)采取适当的措施能减少对环境的污染。
①酸雨是指pH
②一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为2C8H18+23O2
 12CO2+4CO+18H2O
12CO2+4CO+18H2O某环境监测兴趣小组的同学描绘的市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是

A B C D
③天然水中含有的细小悬浮颗粒可以用
(3)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗
A.麻黄碱 B.阿司匹林 C.抗酸药
(4)化学与材料密切相关。
①人工合成的塑料有多种,其中聚乙烯是常见的塑料制品,结构简式是
②钢铁的腐蚀主要发生吸氧腐蚀,其正极的电极反应为
您最近半年使用:0次
名校
8 . CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如下:
请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气(夹持仪器和加热装置省略)。观察到的现象是______________ ,
写出铜与氯气反应的化学方程式______________________ 。
(2)上述流程中固体K溶于稀盐酸的目的是___________________ 。试剂X、固体J的物质分别为____________________ 。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式____________________ 。
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是_____________ 。该腐蚀过程的正极反应式为___________________ 。
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式________ 。

请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气(夹持仪器和加热装置省略)。观察到的现象是
写出铜与氯气反应的化学方程式

(2)上述流程中固体K溶于稀盐酸的目的是
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该红褐色沉淀的主要化学式是
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式
您最近半年使用:0次
2016-01-15更新
|
147次组卷
|
2卷引用:2016届黑龙江省牡丹江高级中学高三上期末热身理综化学试卷



