名校
1 . 实验室利用锌粒和1mol/L的盐酸制取氢气,下列措施不能加快制取氢气速率的是
A.加入 固体 固体 | B.将锌粒改为锌粉 |
| C.将1mol/L的盐酸改为1mol/L硫酸 | D.加入几滴硫酸铜溶液 |
您最近一年使用:0次
2023-04-30更新
|
194次组卷
|
2卷引用:陕西省宝鸡市渭滨区2022-2023学年高一下学期期末检测化学试题
名校
解题方法
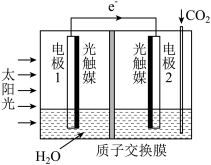
2 . 利用人工光合作用合成甲酸的原理: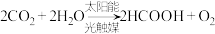 设计成原电池,装置如图所示。下列说法不正确的是
设计成原电池,装置如图所示。下列说法不正确的是
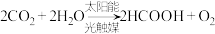 设计成原电池,装置如图所示。下列说法不正确的是
设计成原电池,装置如图所示。下列说法不正确的是
| A.电极1周围溶液的pH增大 |
| B.该装置将太阳能转化为化学能和电能 |
C. 由电极1室经过质子交换膜流向电极2室 由电极1室经过质子交换膜流向电极2室 |
D.电极2上发生的反应为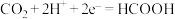 |
您最近一年使用:0次
2023-04-27更新
|
498次组卷
|
4卷引用:陕西省西安市第八十五中学2022-2023学年高一下学期月考化学试题
名校
解题方法
3 . 下列四个常用电化学装置的叙述正确的是
 | 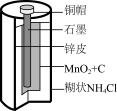 | 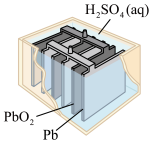 | 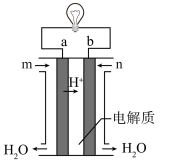 |
| 图I水果电池 | 图Ⅱ干电池 | 图Ⅲ铅蓄电池 | 图Ⅳ氢氧燃料电池 |
| A.图I所示电池中,电子从锌片流出经导线流向铜片,再通过番茄内部流回锌片 |
| B.图Ⅱ所示干电池中锌作负极,发生还原反应 |
C.图Ⅲ所示电池为二次电池,放电时负极的电极反应式为Pb-2e-+SO =PbSO4 =PbSO4 |
| D.图Ⅳ所示电池中从m处通入O2,a电极为正极,电极反应式为O2+4e-+4H+=2H2O |
您最近一年使用:0次
2023-04-26更新
|
198次组卷
|
3卷引用:陕西省武功县普集高级中学2022-2023学年高一下学期第三次月考化学试题
名校
4 . 某同学设计了如下一系列实验用于探究硫酸铜的量对锌与稀硫酸反应生成氢气速率的影响,该同学将表中所给的混合物分别加入6个盛有过量Zn粒的反应瓶中,记录获得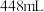 (已换算成标准状况)气体所需时间。忽略溶液体积和温度变化,下列说法错误的是
(已换算成标准状况)气体所需时间。忽略溶液体积和温度变化,下列说法错误的是
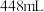 (已换算成标准状况)气体所需时间。忽略溶液体积和温度变化,下列说法错误的是
(已换算成标准状况)气体所需时间。忽略溶液体积和温度变化,下列说法错误的是| 实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 混合物 |   溶液/mL 溶液/mL | 50 | 50 | 50 | 50 | 50 | 50 |
 固体/g 固体/g | 0 | 0.5 | 2.5 | 5 | 10 | 20 | |
| 时间/min | 30 | 25 | 23 | 22 | 23 | 35 | |
A.第②组实验从反应开始至收集到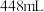 气体,反应的平均速率 气体,反应的平均速率 |
| B.加入适量的硫酸铜,反应生成的铜与锌形成了原电池,从而加快了锌与稀硫酸的反应速率 |
| C.加入硫酸铜较多,生成的铜覆盖在锌表面,有可能会减缓锌与稀硫酸的反应速率 |
D.实验中将硫酸铜固体改为硫酸钠固体, 浓度增大,也能达到加快反应速率的效果 浓度增大,也能达到加快反应速率的效果 |
您最近一年使用:0次
2023-04-20更新
|
163次组卷
|
4卷引用:陕西省部分名校2022-2023学年高一下学期期中联考化学试题
解题方法
5 . 现有如下两个反应:
A.NaOH+HCl=NaCl+H2O;B.Cu+2AgNO3=Cu(NO3)2+2Ag
(1)根据两反应本质判断,能用于设计原电池的是___________ 。
(2)请画出实验装置图___________ (注明电解质溶液名称和正负极材料)
电子流动方向___________ ,电流方向___________ 。
___________ 是正极,正极反应式:___________ ;
___________ 是负极,负极反应式:___________ 。
A.NaOH+HCl=NaCl+H2O;B.Cu+2AgNO3=Cu(NO3)2+2Ag
(1)根据两反应本质判断,能用于设计原电池的是
(2)请画出实验装置图
电子流动方向
您最近一年使用:0次
名校
解题方法
6 . 由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
| 装置 |
|
|
|
| 现象 | 金属W不断溶解 | Y的质量增加 | W上有气体产生 |
| A.装置甲中W作原电池负极 |
B.装置乙中Y电极上的反应式为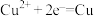 |
| C.装置丙中电流由Z流向W |
D.四种金属的活动性强弱顺序为 |
您最近一年使用:0次
2023-03-12更新
|
1175次组卷
|
8卷引用:陕西省汉中市2020-2021学年高一下学期期中联考化学试卷
陕西省汉中市2020-2021学年高一下学期期中联考化学试卷宁夏回族自治区银川一中2022-2023学年高一下学期期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期5月期中考试化学试题 河南大学附属中学2022-2023学年高一下学期期中考试 化学试题第2课时 化学反应与电能河南省濮阳市南乐县第一高级中学2023-2024学年高一下学期模拟预测化学试题(已下线)专题05 化学反应与能量变化(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)(已下线)专题02 化学反应与能量变化-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)
名校
解题方法
7 . 下列有关化学反应速率和化学反应限度的叙述不正确的是
| A.Na与水反应时,增加水的质量,能明显增大反应速率 |
| B.使用NaClO漂白时,加入适量稀盐酸可增大反应速率 |
C.实验室制取 时,用锌粉代替锌粒或滴加几滴 时,用锌粉代替锌粒或滴加几滴 溶液可加快反应速率 溶液可加快反应速率 |
D.一定条件下进行合成氨反应: , , 不可能完全转化为 不可能完全转化为 |
您最近一年使用:0次
2023-03-12更新
|
805次组卷
|
4卷引用:陕西省汉中市2020-2021学年高一下学期期中联考化学试卷
名校
8 . 某电池的总反应式为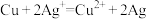 ,该原电池的正确组合是
,该原电池的正确组合是
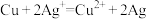 ,该原电池的正确组合是
,该原电池的正确组合是| 选项 | A | B | C | D |
| 正极材料 | Cu | Ag | Ag | Cu |
| 负极材料 | Ag | Cu | Cu | Ag |
| 电解质溶液 |  |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-12更新
|
1565次组卷
|
6卷引用:陕西省汉中市2020-2021学年高一下学期期中联考化学试卷
9 . 某原电池的结构示意图如图。下列说法正确的是
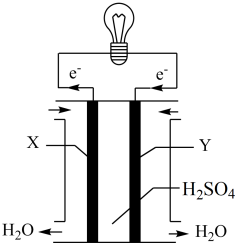

| A.稀硫酸和导线都是离子导体 |
| B.电流的流动方向为:锌→导线→铜→稀硫酸→锌 |
| C.在铜电极上氢离子得到电子而放出氢气,发生还原反应 |
| D.铜锌原电池工作时,若有6.5g锌被溶解,电路中就有0.1mol电子通过 |
您最近一年使用:0次
2023-03-02更新
|
395次组卷
|
5卷引用:陕西省安康市2022-2023学年高二下学期期中考试化学试题
陕西省安康市2022-2023学年高二下学期期中考试化学试题贵州省黔西南布依族苗族自治州2022-2023学年高二上学期期末考试化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(选择题11-13)四川省天府新区太平中学2022-2023学年高二下学期3月月考化学试题(已下线)专题09 原电池-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
解题方法
10 . 天津大学在光催化钠离子二次电池的应用研究取得重大进展。该电池工作原理如下图所示,光催化电极能在太阳光照下实现对设备进行充电。下列说法错误的是
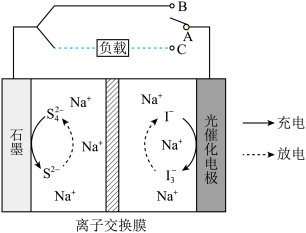

| A.充电时,电子从石墨电极流出通过导线流向光催化电极 |
B.放电时,石墨电极的电极反应式为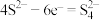 |
| C.离子交换膜为阳离子交换膜 |
D.放电时,当外电路转移 电子时,离子交换膜左室电解质溶液质量减少 电子时,离子交换膜左室电解质溶液质量减少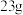 |
您最近一年使用:0次
2023-02-08更新
|
267次组卷
|
3卷引用:陕西省安康市重点名校2024届高三上学期10联考化学试题






