名校
解题方法
1 . 实验室用铁粉和稀硫酸反应制H2,能使该反应速率加快的措施是
| A.加少量Cu粉 | B.改用98%的浓硫酸 |
| C.增大压强 | D.改用等质量铁片 |
您最近一年使用:0次
2023-07-07更新
|
102次组卷
|
3卷引用:甘肃省武威市凉州区2023-2024学年高二上学期开学考试化学试题
名校
解题方法
2 . 把X、Y、Z、W四种金属浸入稀盐酸中,用导线两两相连,均可形成原电池。W、Y相连时,电流从Y经导线流向W,Z、W相连时,W上有气泡逸出,X、Y相连时,X为负极,X、Z相连时,X质量减少。则四种金属的活动性顺序由大到小排列为
| A.X、Z、W、Y | B.W、Y、Z、X | C.W、Z、Y、X | D.Y、W、Z、X |
您最近一年使用:0次
2023-04-16更新
|
799次组卷
|
10卷引用:甘肃省临洮中学2023-2024学年上学期高二下学期开学考试化学试题
甘肃省临洮中学2023-2024学年上学期高二下学期开学考试化学试题山东省聊城市2019-2020学年高一下学期期末考试化学试题湖北省部分高中联考协作体2022-2023学年高一下学期期中考试化学试题 河北省邢台市第二中学2022-2023学年高一下学期第二次月考化学试题河北省邢台市南宫中学2022-2023学年高一下学期第二次月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高一下学期期中考试化学试题湖南省益阳市安化县第二中学2022-2023学年高一下学期4月期中考试化学试题贵州省江口中学2022-2023学年高一下学期期中考试化学试卷重点 天津市第五中学2023-2024学年高一下学期4月期中考试化学试题新疆乌鲁木齐市第十一中学2023-2024学年高一下学期期中测试化学试卷
21-22高一·全国·假期作业
名校
3 . 用稀硫酸与过量锌粒反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施可行的是
| A.滴加少量水 | B.改用等质量的锌片 | C.滴加少量硫酸铜溶液 | D.滴加少量浓硫酸 |
您最近一年使用:0次
2022-10-07更新
|
163次组卷
|
4卷引用:甘肃省张掖市高台县第一中学2023-2024学年高二上学期开学(暑假学习效果)检测化学试题
甘肃省张掖市高台县第一中学2023-2024学年高二上学期开学(暑假学习效果)检测化学试题甘肃省张掖市高台县第一中学2022-2023学年高二上学期期中考试化学试题(已下线)第05讲 化学能转化为电能-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)广西桂林市第十九中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
4 . 下列变化中属于原电池反应且正确的是
| A.白铁(镀锌铁)表面有划损时,也能阻止铁被氧化 |
| B.在空气中,金属铝表面迅速被氧化,形成一层保护膜 |
| C.红热的铁丝与水接触,表面形成蓝色保护层 |
| D.铁与过最稀硫酸反应时,加入几滴CuSO4溶液,可加快H2的产生,但不会影响产生气体的总量 |
您最近一年使用:0次
名校
解题方法
5 . 中国将提高国家自主贡献力度,采取更加有力的政策和措施,力争于2030年前达到碳峰值,2060年前实现碳中和。我国科学家研发了一种水系可逆Zn—CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH-,在外加电场中可透过相应的离子膜定向移动。当闭合K1时,Zn—CO2电池工作原理如图所示。下列说法不正确的是
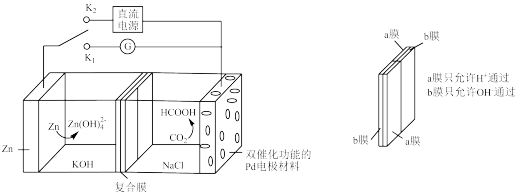

| A.闭合K1时,H+通过a膜向Pd电极方向移动 |
B.闭合K1时,Zn表面的电极反应式为Zn+4OH-_2e- = Zn(OH) |
| C.闭合K2时,Zn电极与直流电源正极相连 |
| D.闭合K2时,在Pd电极上有CO2生成 |
您最近一年使用:0次
2021-11-03更新
|
1065次组卷
|
16卷引用:甘肃省张掖市高台县第一中学2022-2023学年高三上学期开学第一次检测化学试题
甘肃省张掖市高台县第一中学2022-2023学年高三上学期开学第一次检测化学试题河南省信阳高级中学2020-2021学年高二下学期回顾测试化学试题甘肃省天水市一中2021届高三上学期第四次考试理综化学试题甘肃省高台县第一中学2021-2022学年高三上学期期中考试化学(理)试题陕西省汉中市2021届高三第一次模拟化学试题陕西省汉中市2021届高三教学质量第一次检测考试化学试卷黑龙江省哈尔滨市第六中学2021届高三上学期期末考试理综化学试题(已下线)练习2 原电池与常见的化学电源-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)(已下线)热点6 电化学及其应用-2021年高考化学专练【热点·重点·难点】(已下线)第18讲 原电池 化学电源(精练)-2022年高考化学一轮复习讲练测吉林省梅河口市第五中学2022届高三上学期第一次月考化学试题广东省汕头市金山中学2021-2022学年高三上学期期中考试试题(已下线)第15周 周测卷-备战2022年高考化学周测与晚练(新高考专用)河南省商丘市五校2021-2022学年高二下学期5月联考化学试题第四章化学反应与电能宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学
10-11高二上·北京·期末
名校
解题方法
6 . X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
您最近一年使用:0次
2021-01-05更新
|
1015次组卷
|
57卷引用:甘肃省武威市古浪县第三中学2022-2023学年高二下学期开校考试化学试题
甘肃省武威市古浪县第三中学2022-2023学年高二下学期开校考试化学试题甘肃省武威第十八中学2020-2021学年高一下学期期中考试化学试题(已下线)2010年北京育园中学高二上学期分班考试化学试题(已下线)2010—2011学年江西省德兴一中高一下学期第一次月考化学试卷(已下线)2010—2011学年安徽省滁州中学高一下学期期中考试化学试卷(已下线)2011-2012学年湖北省部分中学高一下学期期中考试化学试卷(已下线)2011-2012学年江西省九江一中高一下学期期中考试文科化学试卷(已下线)2011-2012学年江苏省盐城中学高一下学期期中考试化学试卷(已下线)2011-2012学年贵州省湄潭中学高一下学期期中考试化学试卷 (已下线)2011-2012年江苏南通小海中学高一下学期期中考试化学试卷(已下线)2011-2012学年江西上饶中学高一潜能班下期末考试化学试卷(已下线)2012-2013学年吉林省龙井市三中高一下学期期中考试化学试卷(已下线)2013-2014山东省兰陵县下学期期中考试高一化学试卷2014-2015浙江省嘉兴一中高二上学期期中化学(文)试卷2014-2015山东省乐陵市第一中学高一下学期期中化学试卷2014-2015学年云南省景洪市第四中学高一下学期期中考试化学试卷2016届山东省枣庄市滕州十一中高三上学期期末模拟化学试卷2015-2016学年广东实验中学高一下期中化学试卷2015-2016学年湖南省株洲十八中高一下期中理科化学试卷2015-2016学年湖南省株洲十八中高一下期中文科化学试卷2015-2016学年宁夏中卫一中高一下第三次月考化学试卷2016-2017学年河北省望都中学高二8月月考化学试卷2016-2017学年广东省湛江一中高二上第一次大考化学卷吉林省吉林油田实验中学2016-2017学年高一下学期期中考试化学试题湖南省邵阳市第二中学2016-2017学年高一下学期期末考试(理)化学试题湖南省邵阳市第二中学2016-2017学年高一下学期期末考试(文)化学试题吉林省长春外国语学校2016-2017学年高一下学期期末考试(文)化学试题山东省菏泽市2017-2018学年高一下学期期中考试化学试题【全国百强校】河北省武邑中学2017-2018学年高一下学期期末考试化学试题山西省忻州二中2017-2018学年高一下学期期中考试化学试题【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期第一次月考化学试题(已下线)2019年3月19日 《每日一题》必修2 原电池工作原理的应用宁夏回族自治区青铜峡市高级中学2018-2019学年高一下学期期中考试化学试题辽宁省大连渤海高级中学2018-2019学年高一下学期期中考试化学试题山西省阳泉市第二中学2018-2019学年高一下学期期中考试化学试题广西柳江中学2018-2019学年高一下学期期中考试(文)化学试题天津市部分区2018-2019学年高一下学期期末考试化学试题人教版 高中化学 必修2 第二章 《化学反应与能量》 单元能力检测天津市第二南开学校2019-2020学年高一下学期阶段性检测化学试题辽宁省营口市第二高级中学2018-2019学年高一下学期第一次月考化学试题山东省临沂市2019-2020学年高一下学期月考化学试题陕西省西安中学2019-2020学年高一下学期期末考试化学(文)试题湖南省衡阳市衡东县欧阳遇实验中学2019-2020学年高一上学期期末考试化学试题河北省沧州市第一中学2019-2020学年高一下学期期末考试化学试题河南省漯河市临颍县南街高级中学2020-2021学年高一10月质量检测化学试题湖北省沙洋县沙洋中学2020-2021学年高二12月月考化学试题(已下线)【浙江新东方】双师198高一下内蒙古通辽市科尔沁区大林高中2020-2021学年高二4月月考化学试题宁夏海原第一中学2020-2021学年高一下学期期末考试化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期末考试化学试卷(已下线)第4章 化学反应与电能(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)卷08 电化学及其应用-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)宁夏吴忠中学2021-2022学年高一下学期期中考试化学试题广东省佛山市顺德区容山中学2021-2022学年高一下学期期中化学试题黑龙江省黑河市五校(嫩江市第一中学,嫩江市职业高中,黑河七中,伊拉哈中学,海江中学)2021-2022学年高二上学期期末联考化学试题宁夏贺兰景博中学2021-2022学年高一下学期第一次月考化学试题黑龙江省伊春市铁力市马永顺中学校2023-2024学年高二上学期期末考试化学试题
名校
解题方法
7 . 以氨气代替氢气研发氨燃料电池是当前科研的一个热点.
(1)氨燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.该电池负极的电极反应式为______ ;每消耗1.7g NH3转移的电子数目为______ .
(2)用氨燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为______ ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为_______ L.
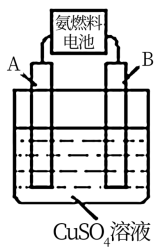
(3)纳米级氧化亚铜(Cu2O)是一种重要光电材料.现用铜棒和石墨做电极,饱和食盐水做电解质制备纳米级氧化亚铜(Cu2O),电解反应为2Cu+H2O Cu2O+H2↑铜棒上发生的电极反应式为
Cu2O+H2↑铜棒上发生的电极反应式为__ .
(1)氨燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O.该电池负极的电极反应式为
(2)用氨燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为

(3)纳米级氧化亚铜(Cu2O)是一种重要光电材料.现用铜棒和石墨做电极,饱和食盐水做电解质制备纳米级氧化亚铜(Cu2O),电解反应为2Cu+H2O
 Cu2O+H2↑铜棒上发生的电极反应式为
Cu2O+H2↑铜棒上发生的电极反应式为
您最近一年使用:0次
2020-07-30更新
|
112次组卷
|
2卷引用:甘肃省定西市岷县第一中学2019-2020学年高二下学期开学测试化学试题
9-10高一下·陕西西安·期末
名校
解题方法
8 . 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c上产生大量气泡,b、d相连时,b上产生大量气泡,则四种金属的活动性顺序由强到弱的是
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
您最近一年使用:0次
2020-07-23更新
|
1562次组卷
|
96卷引用:甘肃省天水市第一中学2017-2018学年高二下学期入学考试化学试题
甘肃省天水市第一中学2017-2018学年高二下学期入学考试化学试题2016-2017学年宁夏吴忠中学高二上学期开学考试化学试卷甘肃省嘉峪关市第一中学2016-2017学年高一下学期期末考试化学试题甘肃省武威市第一中学2017-2018学年度第一学期 高二化学期末试卷【校级联考】甘肃省兰州市第二片区丙组2018-2019学年高二上学期期末联考化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题甘肃省永昌县第四中学2019-2020学年高一下学期期末考试化学试题甘肃省武威市第十八中学2019-2020学年高一下学期期末模拟考试化学试题甘肃省平凉市庄浪县第一中学2019-2020学年高一下学期期中考试化学试题甘肃省兰州市教育局第四片区2021-2022学年高二上学期期末考试化学(理)试题甘肃省临夏州临夏县中学2021-2022学年高一下学期期中考试化学试题(已下线)2009---2010学年西安市一中高一下学期期末考试化学(已下线)2010—2011学年湖南省慈利一中高二上学期期末考试化学试卷(已下线)2010-2011学年山西省大同一中高一下学期期中考试化学试卷(已下线)2010—2011学年湖南省醴陵二中、醴陵四中高一上学期期末联考化学试卷(已下线)2010—2011学年云南省昆明三中高一下学期期末考试化学试卷(已下线)2010—2011学年山东省汶上一中高一下学期期末考试化学试卷(已下线)2010~2011学年湖南省(醴陵二中、四中)两校联考高一下学期期末考试化学(已下线)2011-2012学年江苏省射阳中学高二上学期期末考试化学(选修)试卷(已下线)2011-2012学年太原五中高一下学期期中考试化学试卷(已下线)2011-2012学年湖南省株洲四中高一上学期期中考试化学试卷(已下线)2011-2012学年吉林省扶余一中高一下学期期中考试化学试卷(已下线)2011-2012学年河北省唐山一中高一下学期期中考试化学试卷(已下线)2011-2012学年福建省建瓯二中高一下学期期末考试化学试卷(已下线)2011-2012学年福建省福州文博中学高二下学期期中考试化学试卷(已下线)2012-2013学年重庆市杨家坪中学高二12月月考化学试卷(已下线)2012-2013学年昆明三中、滇池中学高一下期中考试化学卷(滇中)(已下线)2012-2013学年山东省临沭县高一4月阶段(期中)质量检测化学试卷(已下线)2012-2013学年宁夏育才中学高一下学期期中考试化学试卷(已下线)2013-2014学年河北省遵化市高二上学期期中质量检测化学试卷(已下线)2014学年高一化学人教版必修2 2.2.1化学能转化为电能练习卷2014-2015山西省太原市五中高二12月月考化学试卷2014-2015河北省邯郸市高二上学期期末考试化学试卷2014-2015学年山西省太原五中高二12月月考化学试卷2015-2016学年福建省宁德市霞浦七中高二上期中(理)化学试卷2015-2016学年安徽省安庆市一中高一下学期期中化学试卷2015-2016学年山西大学附中高一下期中化学试卷2015-2016学年辽宁省抚顺市四方高级中学高二下期中文科化学试卷2016-2017学年山西省山西大学附中高二上9月月考化学卷2016-2017学年江西省上高县第二中学高一4月(第六次)月考化学试卷河北省馆陶县第一中学2016-2017学年高一下学期期中考试化学试题河南省濮阳市2016-2017学年高二下学期升级(期末)考试(A卷)化学试题广东省仲元中学2016-2017学年高一下学期期末考试(文)化学试题山东省济南市第一中学2017-2018学年高二10月阶段测试化学试题(已下线)4.1 原电池陕西省西安市长安区第一中学2017-2018学年高二上学期期中考试化学(重点、平行班)试题高中化学人教版 选修四 第四章 电化学基础 第一节 原电池 原电池湖北省荆州中学2017-2018学年高二12月阶段性质量检测化学试题青海省西宁市第四高级中学2017-2018学年高二上学期期末考试化学试题【全国百强校】贵州省铜仁市第一中学2017-2018学年高一下学期期中考试化学试题新疆兵团第二师华山中学2017-2018学年高一下学期期中考试化学试题云南省昭通市镇雄县一中2017-2018学年高一六月份月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高一下学期期末考试化学试题湖南省邵东县十中2018-2019学年高二(文)上学期期中考试化学试题青海省西宁市海湖中学2018-2019学年高一下学期第二次月考化学试题鲁科版高中化学必修2第二章《 化学键 化学反应与能量》单元检测题重庆市第三十中学2018-2019学年高一5月月考化学试题新疆乌鲁木齐市第四中学2018-2019学年高一下学期期中考试化学试题福建省莆田第七中学2019-2020学年高二上学期期中复习检测化学试题2山东省泰安市泰山国际学校2019-2020学年高二上学期期中考试化学试题山东省泰安市泰山国际学校2019-2020学年高二上学期第一次月考化学试题湖南省雅礼中学2019-2020学年高二上学期第一次月考化学试题新疆昌吉市教育共同体2019-2020学年高二年级上学期期末考试化学试题河南省郑州市巩义中学2019-2020学年高一下学期期中考试化学试题黑龙江省七台河市田家炳高级中学2019-2020学年高一下学期期中考试化学试题山西省运城市高中联合体2019-2020学年高一下学期第一次摸底考试化学试题贵州省铜仁市思南中学2019-2020学年高一下学期5月月考化学试题陕西省榆林市绥德县绥德中学2019-2020学年高一下学期第二次阶段检测化学试题宁夏银川市宁夏大学附属中学2019-2020学年高一下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期摸底考试化学试卷福建省福州福清市2017-2018学年高二上学期期中考试化学(理)试题鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第2节 化学能转化为电能——电池人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 教材帮(已下线)【全国百强校】贵州省思南中学2018-2019学年2018-2019学年高一下学期期中考试化学试题陕西省西安市长安一中2019-2020学年高二下学期第一次质量检测化学(理)试题河南省许昌市第三中学2020-2021学年高一上学期期末考试化学试题辽宁省海城市高中教育集团2019-2020学年高一下学期6月联考化学试题天津市第二十一中学2020-2021学年高一下学期期中质量检测化学试题贵阳市第三十七中学2020-2021学年高一下学期期中考试化学试题吉林省长春市第二十九中学2020-2021学年高一下学期期中考试化学(理)试题吉林省长春市北师大附属学校2020-2021学年高一下学期期中考试化学试题新疆新源县2020-2021学年高一5月联考化学试题辽宁省铁岭市六校2020-2021学年高一下学期期末联考化学试题河南省辉县市一中2020-2021学年高一下学期第一次阶段性考试化学试题吉林省通化市部分重点中学校2021-2022学年高一下学期期末联考化学试题河南省中原名校2021-2022学年高二上学期期末联考化学试题陕西省安康市汉滨区江北高级中学2020-2021学年高一下学期第二次月考化学试题山西省稷山中学2021-2022学年高一下学期期中考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高二上学期12月月考化学试题云南省红河县第一中学2020-2021学年高一下学期期末考试化学试题黑龙江省哈尔滨市双城区兆麟中学2022—2023学年高一下学期期中考试化学试题广东省东莞东方明珠学校2021-2022学年高一下学期期中考试化学试题天津市宝坻区第一中学2022-2023学年高一下学期阶段练习四化学试题云南省开远市第一中学校2022-2023学年高一下学期3月月考化学试题新疆喀什地区疏勒县疏勒县实验学校2023-2024学年高二上学期12月月考化学试题陕西省宝鸡市扶风县法门高中2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . (1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是____ (填字母)。
A. 铝片、铜片 B. 铜片、铝片 C. 铝片、铝片 D. 铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:______ 。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出A电极反应式:______ ;该电池在工作时,A电极的质量将____ (填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为____ 。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出B电极反应式:____ ;该电池在工作一段时间后,溶液的碱性将______ (填“增强”“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:_______ ;若该电池反应消耗了6.4gCH4,则转移电子的数目为_____ 。
A. 铝片、铜片 B. 铜片、铝片 C. 铝片、铝片 D. 铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出A电极反应式:
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出B电极反应式:
(4)若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:
您最近一年使用:0次
10 . 对于反应Zn+H2SO4=ZnSO4+H2↑,下列叙述不正确的是

| A.反应过程中能量关系可用上图表示 |
| B.若将该反应设计成原电池,锌为负极,碳为正极,稀硫酸溶液做电解质 |
| C.若设计为原电池,当有32.5 g锌溶解,负极放出11.2 L气体(标准状况下) |
| D.若设计为原电池,负极有电流流入 |
您最近一年使用:0次
2019-04-15更新
|
323次组卷
|
3卷引用:甘肃省天水一中2021-2022学年高二上学期开学考试化学试题



