解答题-原理综合题
|
适中(0.65)
|
1 . 铁元素价态繁多,回答下列问题。
I.单质铁和碳经常被用作原电池。
(1)如图利用铁碳原电池原理处理酸性污水。若上端开口关闭,可得到强还原性的 (氢原子);若上端开口打开并鼓入空气,可得到强氧化性的
(氢原子);若上端开口打开并鼓入空气,可得到强氧化性的 。下列说法错误的是___________。
。下列说法错误的是___________。
(2)燃料电池因污染小,使用寿命长,有着良好的发展前景。甲醇燃料电池以甲醇为燃料,其工作原理示意图如下:___________ 极;
②写出a极反应式___________ 。
Ⅱ.亚铁盐经常被制作成补血剂。为分析某补血剂(主要成分为亚铁盐)中铁元素的质量百分含量,可以用酸性标准溶液进行氧化还原滴定。
(3)实验前,首先要精确配制一定物质的量浓度的 溶液500mL,配制时需要用的仪器除电子天平、药匙、玻璃棒、烧杯、胶头滴管外,还需
溶液500mL,配制时需要用的仪器除电子天平、药匙、玻璃棒、烧杯、胶头滴管外,还需___________ 。配制时要用硫酸酸化 ,不能用盐酸酸化的原因是
,不能用盐酸酸化的原因是___________ 。
(4)称取12.2g补血剂在容量瓶中配成200mL溶液,量取25.00mL试样溶液,用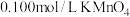 标准溶液滴定,判断到达滴定终点的实验现象是
标准溶液滴定,判断到达滴定终点的实验现象是___________ ,达到滴定终点时,消耗标准溶液20.00mL,则所测补血剂中铁元素的质量百分含量是___________ (结果精确到0.1%)。
I.单质铁和碳经常被用作原电池。
(1)如图利用铁碳原电池原理处理酸性污水。若上端开口关闭,可得到强还原性的
 (氢原子);若上端开口打开并鼓入空气,可得到强氧化性的
(氢原子);若上端开口打开并鼓入空气,可得到强氧化性的 。下列说法错误的是___________。
。下列说法错误的是___________。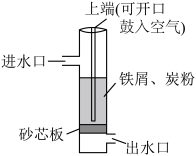
A.无论是否鼓入空气,负极: |
B.上端开口关闭,正极: |
C.鼓入空气,每生成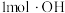 有2 mol电子转移 有2 mol电子转移 |
D.处理含 的污水时,打开上端开口并鼓入空气 的污水时,打开上端开口并鼓入空气 |
(2)燃料电池因污染小,使用寿命长,有着良好的发展前景。甲醇燃料电池以甲醇为燃料,其工作原理示意图如下:
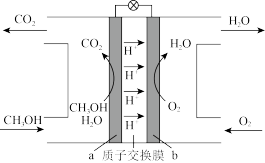
②写出a极反应式
Ⅱ.亚铁盐经常被制作成补血剂。为分析某补血剂(主要成分为亚铁盐)中铁元素的质量百分含量,可以用酸性标准溶液进行氧化还原滴定。
(3)实验前,首先要精确配制一定物质的量浓度的
 溶液500mL,配制时需要用的仪器除电子天平、药匙、玻璃棒、烧杯、胶头滴管外,还需
溶液500mL,配制时需要用的仪器除电子天平、药匙、玻璃棒、烧杯、胶头滴管外,还需 ,不能用盐酸酸化的原因是
,不能用盐酸酸化的原因是(4)称取12.2g补血剂在容量瓶中配成200mL溶液,量取25.00mL试样溶液,用
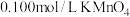 标准溶液滴定,判断到达滴定终点的实验现象是
标准溶液滴定,判断到达滴定终点的实验现象是
您最近一年使用:0次
名校
2 . 发生化学反应时,物质变化的同时常常伴随有能量变化。
(1)某反应过程的能量变化如图所示。请填写下列空白。
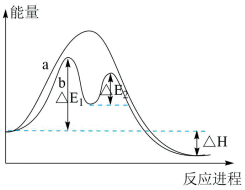
反应过程___________ (填“a”或“b”)有催化剂参与。该反应为___________ 反应(填“放热”或“吸热”)。
(2)写出热化学方程式:1mol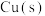 与适量
与适量 反应生成
反应生成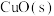 ,放出157.3kJ的热量
,放出157.3kJ的热量___________ 。
(3)已知:键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。
当 和
和 化合生成2mol
化合生成2mol 时,放出
时,放出___________ kJ的能量。
(4)利用 与
与 的反应设计氢氧燃料电池,装置如图所示。
的反应设计氢氧燃料电池,装置如图所示。

①通入 的电极是电池的
的电极是电池的___________ (填“正”或“负”)极。
②通入 的电极反应式是
的电极反应式是___________ 。
(1)某反应过程的能量变化如图所示。请填写下列空白。

反应过程
(2)写出热化学方程式:1mol
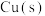 与适量
与适量 反应生成
反应生成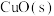 ,放出157.3kJ的热量
,放出157.3kJ的热量(3)已知:键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。
| 化学键 | H―H | O=O | H―O |
键能/ | 436 | 498 | 463 |
 和
和 化合生成2mol
化合生成2mol 时,放出
时,放出(4)利用
 与
与 的反应设计氢氧燃料电池,装置如图所示。
的反应设计氢氧燃料电池,装置如图所示。
①通入
 的电极是电池的
的电极是电池的②通入
 的电极反应式是
的电极反应式是
您最近一年使用:0次
名校
3 . 某化学兴趣小组为了探索 电极在原电池中的作用,设计并进行了以下一系列实验。已知:
电极在原电池中的作用,设计并进行了以下一系列实验。已知: 与
与 的化学性质基本相似,
的化学性质基本相似, 。回答下列问题:
。回答下列问题:
(1)实验1:电极材料为 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。
①正极的电极反应式为___________ 。
②每转移 电子,此时负极材料减少的质量为
电子,此时负极材料减少的质量为___________ g。
(2)实验2:电极材料为 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。
由实验1和实验2可知, 三种金属活动性由强到弱的顺序为
三种金属活动性由强到弱的顺序为___________ 。
(3)实验3:电极材料为石墨和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的 将
将___________ (填“变大”、“变小”或“不变”)。
②石墨电极上发生___________ (填“氧化”或“还原”)反应。
(4)实验4:电极材料为 和
和 ,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向
,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向 。
。
①负极的电极反应式为___________ 。
②外电路中电子的流动方向为___________ 。
 电极在原电池中的作用,设计并进行了以下一系列实验。已知:
电极在原电池中的作用,设计并进行了以下一系列实验。已知: 与
与 的化学性质基本相似,
的化学性质基本相似, 。回答下列问题:
。回答下列问题:(1)实验1:电极材料为
 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。①正极的电极反应式为
②每转移
 电子,此时负极材料减少的质量为
电子,此时负极材料减少的质量为(2)实验2:电极材料为
 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。由实验1和实验2可知,
 三种金属活动性由强到弱的顺序为
三种金属活动性由强到弱的顺序为(3)实验3:电极材料为石墨和
 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。①电池工作一段时间后,电解质溶液的
 将
将②石墨电极上发生
(4)实验4:电极材料为
 和
和 ,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向
,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向 。
。①负极的电极反应式为
②外电路中电子的流动方向为
您最近一年使用:0次
名校
解题方法
4 . 电池的应用给我们的生活带来了便利,请根据原电池工作原理回答下列问题:
(1)①图中原电池工作时,正极上的电极反应式为________ 。
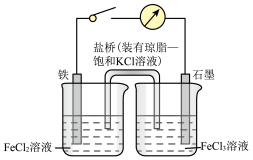
②该原电池工作时,下列说法正确的是_______ (填标号)。
A.电子移动的方向:铁电极 石墨电极
石墨电极
B.盐桥中的K+会向右侧烧杯移动
C.FeCl2溶液的颜色会逐渐变浅
D.将KCl盐桥换成AgNO3盐桥,该装置不能长时间正常工作
(2)铅酸蓄电池是常见的二次电池,其工作原理如图所示。
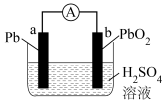
①写出放电时正极的电极反应式:_______ 。
②铅酸蓄电池放电时一段时间,当转移0.2mol电子时,负极质量将增大______ g。
(3)肼—空气燃料电池是一种无污染,能量高,有广泛的应用前景的燃料电池。某化学小组设计一种肼—空气燃料电池,除将化学能转化为电能外,还能将饱和食盐水淡化,同时还可获得盐酸和NaOH两种副产品。其工作原理如图所示:
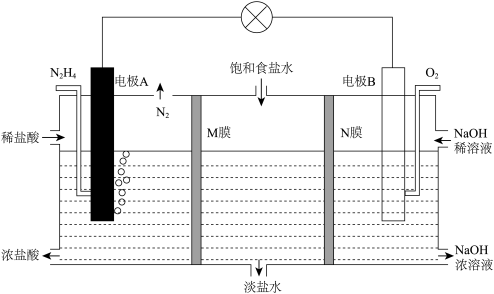
①该燃料电池A电极名称是______ (填“正极”或“负极”),A电极的电极反应式为_______ 。
②N膜为_______ (填“阳离子交换膜”或“阴离子交换膜”)。
③当电路中有0.2mol电子转移时,正极室质量增加_____ g。
(1)①图中原电池工作时,正极上的电极反应式为

②该原电池工作时,下列说法正确的是
A.电子移动的方向:铁电极
 石墨电极
石墨电极B.盐桥中的K+会向右侧烧杯移动
C.FeCl2溶液的颜色会逐渐变浅
D.将KCl盐桥换成AgNO3盐桥,该装置不能长时间正常工作
(2)铅酸蓄电池是常见的二次电池,其工作原理如图所示。

①写出放电时正极的电极反应式:
②铅酸蓄电池放电时一段时间,当转移0.2mol电子时,负极质量将增大
(3)肼—空气燃料电池是一种无污染,能量高,有广泛的应用前景的燃料电池。某化学小组设计一种肼—空气燃料电池,除将化学能转化为电能外,还能将饱和食盐水淡化,同时还可获得盐酸和NaOH两种副产品。其工作原理如图所示:

①该燃料电池A电极名称是
②N膜为
③当电路中有0.2mol电子转移时,正极室质量增加
您最近一年使用:0次
名校
5 . 电化学是当今化学研究的热点之一。回答下列问题:
(1)一种处理垃圾渗透液并用其发电的装置工作示意图如图。
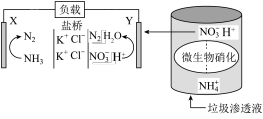
①在空气中,微生物将垃圾渗透液硝化,该反应的离子方程式为_______ 。
② 电极的电极方程式为
电极的电极方程式为_______ 。
③盐桥中 移向
移向_______ (填“ ”或“
”或“ ”)极,当转移
”)极,当转移 电子时,生成标准状况下
电子时,生成标准状况下 的体积为
的体积为_______ L
(2)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

①电极X是该电池的_______ (填“正”或“负”)极,正极反应式为_______ 。
②电池工作时,质子通过交换膜_______ (填“从左向右”或“从右向左”)迁移。
(1)一种处理垃圾渗透液并用其发电的装置工作示意图如图。

①在空气中,微生物将垃圾渗透液硝化,该反应的离子方程式为
②
 电极的电极方程式为
电极的电极方程式为③盐桥中
 移向
移向 ”或“
”或“ ”)极,当转移
”)极,当转移 电子时,生成标准状况下
电子时,生成标准状况下 的体积为
的体积为(2)用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

①电极X是该电池的
②电池工作时,质子通过交换膜
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)氮的氢化物在生产生活中具有重要作用,请根据所学知识解答下列问题:以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。其主要反应如下: 。某温度下,在2L恒容密闭容器中加入4mol NH3和6mol
。某温度下,在2L恒容密闭容器中加入4mol NH3和6mol 发生反应,NH3的转化率随时间的变化关系如图所示。
发生反应,NH3的转化率随时间的变化关系如图所示。
_______ 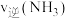 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②0~6min内,N2的平均反应速率v(N2)=_______  。
。
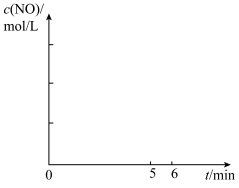
③在图中画出0~6min时间内,NO的浓度随时间变化的曲线图______ (请在图像上标出0min和5min时NO浓度)。_______
A.升高温度, 增大,
增大, 减小
减小
B.将容器的体积变为3L时,化学反应速率减慢
C.使用催化剂可以增大反应速率,提高生产效率
D.恒温恒容,充入He使压强增大,化学反应速率变快
E.当容器内气体平均相对分子质量不再变化时,说明反应达到平衡
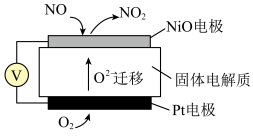
(2)通过NO传感器可监测汽车尾气中的NO含量,其工作原理如图所示。已知:O2-可在固体电解质中自由移动。外电路中,电流是从_______ (填“NiO”或“Pt”)电极流出。
(1)氮的氢化物在生产生活中具有重要作用,请根据所学知识解答下列问题:以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物。其主要反应如下:
 。某温度下,在2L恒容密闭容器中加入4mol NH3和6mol
。某温度下,在2L恒容密闭容器中加入4mol NH3和6mol 发生反应,NH3的转化率随时间的变化关系如图所示。
发生反应,NH3的转化率随时间的变化关系如图所示。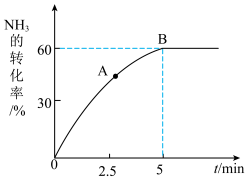

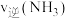 (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)②0~6min内,N2的平均反应速率v(N2)=
 。
。③在图中画出0~6min时间内,NO的浓度随时间变化的曲线图
A.升高温度,
 增大,
增大, 减小
减小B.将容器的体积变为3L时,化学反应速率减慢
C.使用催化剂可以增大反应速率,提高生产效率
D.恒温恒容,充入He使压强增大,化学反应速率变快
E.当容器内气体平均相对分子质量不再变化时,说明反应达到平衡
(2)通过NO传感器可监测汽车尾气中的NO含量,其工作原理如图所示。已知:O2-可在固体电解质中自由移动。外电路中,电流是从
您最近一年使用:0次
2023-04-25更新
|
81次组卷
|
2卷引用:浙江省钱塘联盟2022-2023学年高一下学期期中联考化学试题
名校
7 . 能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
I.
(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填字母)。
II.如图所示的装置,X、Y都是惰性电极。将电路接通后,向乙中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:
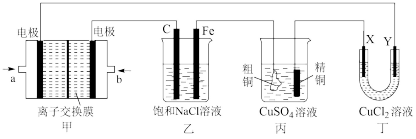
(2)甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是________________________ (填“CH4”或“O2”),负极的电极反应式是________
(3)在乙装置中,总反应的离子方程式是______ 。
(4)如果丙装置中精铜电极的质量增加了6.4 g,则甲装置中消耗的CH4的质量为_____ g。
I.
(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填字母)。
| A.C(s)+CO2(g)=2CO(g) ΔH>0 |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0 |
| C.2H2O(l)=2H2(g)+O2(g) ΔH>0 |
| D.C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH<0 |
II.如图所示的装置,X、Y都是惰性电极。将电路接通后,向乙中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:

(2)甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是
(3)在乙装置中,总反应的离子方程式是
(4)如果丙装置中精铜电极的质量增加了6.4 g,则甲装置中消耗的CH4的质量为
您最近一年使用:0次
解题方法
8 . 某化学兴趣小组为了探索Zn电极在原电池中的作用,设计并进行了以下一系列实验。
已知:Zn与Al的化学性质基本相似,Zn+2NaOH=Na2ZnO2+H2↑。回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为______ 。
②每转移0.2mol电子,此时负极材料减少的质量为_____ g。
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,电流表指针偏向原电池的_____ (填“正极”、或“负极”),Mg、Zn、Cu三种金属活动性由强到弱的顺序为______ 。
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将_____ (填“变大”、“变小”或“不变”)。
②石墨电极上发生_____ (填“氧化”或“还原”)反应。
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为______ 。
②外电路中电子的流动方向为______ 。
(5)根据实验1、实验2、实验3和实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素是:______ 。
已知:Zn与Al的化学性质基本相似,Zn+2NaOH=Na2ZnO2+H2↑。回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为
②每转移0.2mol电子,此时负极材料减少的质量为
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,电流表指针偏向原电池的
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将
②石墨电极上发生
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为
②外电路中电子的流动方向为
(5)根据实验1、实验2、实验3和实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素是:
您最近一年使用:0次
9 . 完成下列小题
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是_____
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
(2)氮是重要的化工原料,已知NH3在纯氧中燃烧的能量变化如图。
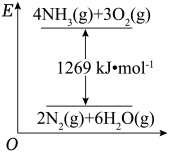
已知:H2O(l)=H2O(g) △H=+44kJ∙mol-1,则NH3(g)的摩尔燃烧焓的热化学方程式为_____ 。
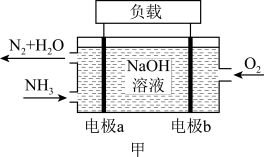
(3)NH3的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极a为_____ (填“正极”或“负极”);电极b上的电极反应为_____ 。当共消耗1.568L(标准状况)气体时,通过负载的电子的物质的量为_____ mol。
(4)一种肼N2H4燃料电池的工作原理如图乙所示。
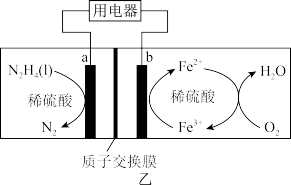
①a极的电极反应式为_____ ;电池中Fe2+→Fe3+的离子方程式为_____ 。
②若利用该电池给铅酸蓄电池充电,当消耗3.2gN2H4时,PbO2电极质量_____ (填“增加”或“减少”)_____ g。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是_____
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |

已知:H2O(l)=H2O(g) △H=+44kJ∙mol-1,则NH3(g)的摩尔燃烧焓的热化学方程式为
(3)NH3的燃烧反应可设计成燃料电池,工作原理如图甲所示。电极a为

(4)一种肼N2H4燃料电池的工作原理如图乙所示。

①a极的电极反应式为
②若利用该电池给铅酸蓄电池充电,当消耗3.2gN2H4时,PbO2电极质量
您最近一年使用:0次
名校
解题方法
10 . 根据化学能转化电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是_______ ,发生_______ 反应,电解质溶液是_______ 。
(2)正极上出现的现象是___________________ 。
(3)若导线上转移电子1 mol,则生成银___________________ g。
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
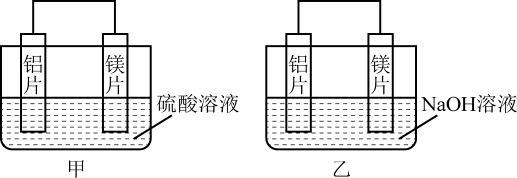
(4)写出甲中正极的电极反应式:___________________ 。
(5)乙中负极为___________________ ,总反应的离子方程式:___________________ 。
(6)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有___________________。
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是
(2)正极上出现的现象是
(3)若导线上转移电子1 mol,则生成银
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

(4)写出甲中正极的电极反应式:
(5)乙中负极为
(6)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有___________________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析 |
您最近一年使用:0次
2022-01-07更新
|
95次组卷
|
3卷引用:广西壮族自治区钦州市第四中学2022-2023学年高一下学期3月月考化学试卷



