名校
1 . 尿液燃料电池是一种微生物燃料电池,可利用微生物的新陈代谢将有机物转化为无污染气体,同时将化学能转换成电能。利用这种燃料电池既能去除工业废水中的尿素[CO(NH2)2],又能发电。其工作原理如图所示,微生物附着在多孔碳电极上。___________ (填“正极”或“负极”),其电极反应式为___________ ,电子从___________ (填“甲电极”或“乙电极”)流出。
(2)电池工作时,若交换膜为阴离子交换膜,则溶液中SO 经过交换膜的移动方向为
经过交换膜的移动方向为___________ (填“由左室移向右室”或“由右室移向左室”);若交换膜为阳离子交换膜,当有 通过交换膜时,消耗的尿素为
通过交换膜时,消耗的尿素为___________ g。
(3)该电池中发生反应的总化学方程式为___________ ,该电池不能在高温条件下工作的原因是___________ 。
(4)假设工业废水中含有9g/L的尿素,向电解装置中盛装1L工业废水,一段时间后消耗了4.48L氧气(标准状况下),此时,废水中尿素的含量___________ (填“达到”或“未达到”)排放标准(10mg/L),因为废水中尿素的含量为___________ g/L。

(2)电池工作时,若交换膜为阴离子交换膜,则溶液中SO
 经过交换膜的移动方向为
经过交换膜的移动方向为 通过交换膜时,消耗的尿素为
通过交换膜时,消耗的尿素为(3)该电池中发生反应的总化学方程式为
(4)假设工业废水中含有9g/L的尿素,向电解装置中盛装1L工业废水,一段时间后消耗了4.48L氧气(标准状况下),此时,废水中尿素的含量
您最近一年使用:0次
2022-01-21更新
|
108次组卷
|
3卷引用:河北省唐县第一中学2023-2024学年高二上学期10月考试化学化学
2 . 某大学开发出纸一样薄的可生物降解锌电池,一化学兴趣小组受到启发,设计出如图所示装置用于探究原电池构成条件。回答下列问题:
(1)甲同学设计了下列实验探究原电池的构成条件。
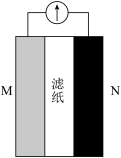
①实验1中电流计指针发生偏转的原因为_______ (填标号)。
A.铝与铜的活泼性不同 B.稀硫酸为电解质
C.整个装置形成了闭合回路 D.铜不与稀硫酸反应
②实验1中电流计发生偏转的原因之一是溶液中有自由移动的_______ (填“分子”、“离子”或“电子”);实验4中,原电池的负极为_______ (填“铝箔”或“铜箔”)。
(2)乙同学设计了下列实验探究原电池的构成条件。
①实验5、6中,所用稀H2SO4的物质的量的浓度相同,N极均观察到有气泡产生,产生气泡较快的是实验_______ (填“5”或“6”),原因是_______ 。
②实验7中的未知溶液可能为_______ (填标号)。
a.浓盐酸 b.浓硝酸 c.NaOH溶液 d.稀硫酸
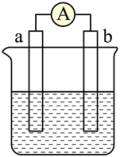
(3)丙同学按下列材料设计了一原电池,该电池工作时, 移向
移向_______ (填“M”或“N”)极,该电池的正极表面发生的电极反应为_______ 。
(1)甲同学设计了下列实验探究原电池的构成条件。

| 试验编号 | M极材料 | N极材料 | 滤纸浸泡物质 | 电流计指针是否偏转 |
| 1 | 铝箔 | 铜箔 | 稀H2SO4 | 是 |
| 2 | 铝箔 | 铜箔 | 乙醇 | 否 |
| 3 | 铝箔 | 铜箔 | 蔗糖溶液 | 否 |
| 4 | 铝箔 | 铜箔 | 番茄汁(pH≈4) | 是 |
A.铝与铜的活泼性不同 B.稀硫酸为电解质
C.整个装置形成了闭合回路 D.铜不与稀硫酸反应
②实验1中电流计发生偏转的原因之一是溶液中有自由移动的
(2)乙同学设计了下列实验探究原电池的构成条件。
| 试验编号 | M极材料 | N极材料 | 滤纸浸泡物质 | 电流计指针是否偏转及偏转方向 |
| 5 | 铝箔 | 铜箔 | 稀H2SO4 | 偏向铝箔 |
| 6 | 铝箔 | 铝箔 | 稀H2SO4 | 不偏转 |
| 7 | 铜箔 | 铝箔 | 未知溶液 | 偏向铜箔 |
②实验7中的未知溶液可能为
a.浓盐酸 b.浓硝酸 c.NaOH溶液 d.稀硫酸
(3)丙同学按下列材料设计了一原电池,该电池工作时,
 移向
移向| M极材料 | N极材料 | 滤纸浸泡物质 |
| 铁箔 | 铜箔 | FeCl3稀溶液 |
您最近一年使用:0次
2023-09-06更新
|
110次组卷
|
2卷引用:福建省部分名校2023-2024学年高二上学期入学联考化学试题
名校
解题方法
3 . 回答下列问题
(1)某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下设计并进行了以下一系列实验,实验结果记录如下。
试根据上表中的实验现象回答下列问题:
①实验3中,Mg作___________ 极,电池总反应的离子方程式:___________ 。
②实验4中正极的电极反应式:___________ 。
③根据实验结果总结出影响铝在原电池中作正极或负极的因素决定于两个电极的活泼性和___________ 。
(2)下图为CO燃料电池,氢氧化钠溶液为电解质溶液,电子由a移向b,则 应通入
应通入___________ 极(填“a”或“b”),CO参与的电极反应式为___________ 。
(1)某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下设计并进行了以下一系列实验,实验结果记录如下。
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 4 | Al、Zn | 浓硝酸 | 偏向Al |
①实验3中,Mg作
②实验4中正极的电极反应式:
③根据实验结果总结出影响铝在原电池中作正极或负极的因素决定于两个电极的活泼性和
(2)下图为CO燃料电池,氢氧化钠溶液为电解质溶液,电子由a移向b,则
 应通入
应通入
您最近一年使用:0次
4 . 任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、电能等不同形式的能量。
(1)H2可用于工业合成氨气,已知拆开1 mol H-H、1 mol N≡N分别需要吸收的能量为 436 kJ、946 kJ,形成1 mol N-H会放出能量 391 kJ,则在反应N2+3H2 2NH3中,每生成2 mol NH3
2NH3中,每生成2 mol NH3___________ (填“吸收”或“放出”)热量___________ kJ。
(2)Mg、Al设计成如图所示原电池装置:
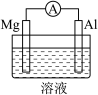
①若溶液为盐酸,Mg为___________ (填“正”或“负”)极;
②若溶液为氢氧化钠溶液,负极的电极反应方程式为___________ 。
(3)电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。
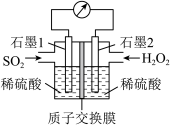
①质子通过交换膜向___________ (填“左”或“右”)移动;
②正极的电极反应式为___________ 。
③若11.2 L(折合为标准状况) SO2参与反应,则迁移H+的物质的量为___________ 。
(1)H2可用于工业合成氨气,已知拆开1 mol H-H、1 mol N≡N分别需要吸收的能量为 436 kJ、946 kJ,形成1 mol N-H会放出能量 391 kJ,则在反应N2+3H2
 2NH3中,每生成2 mol NH3
2NH3中,每生成2 mol NH3(2)Mg、Al设计成如图所示原电池装置:

①若溶液为盐酸,Mg为
②若溶液为氢氧化钠溶液,负极的电极反应方程式为
(3)电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。

①质子通过交换膜向
②正极的电极反应式为
③若11.2 L(折合为标准状况) SO2参与反应,则迁移H+的物质的量为
您最近一年使用:0次
名校
5 . 某原电池装置如图所示,装置中盐桥的作用是使整个装置形成一个闭合回路,电解质溶液足量,闭合开关,观察到电流计指针发生偏转,回答下列问题。
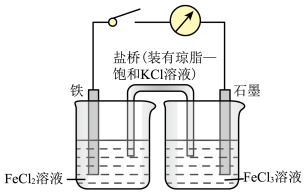
(1)该原电池工作过程中,电池的负极上的电极反应式为___________ ,石墨电极上发生了___________ (填“氧化”或“还原”)反应。
(2)该原电池工作时,下列说法正确的是___________(填标号)。
(3)当铁电极减少 时,外电路中转移的电子数目为
时,外电路中转移的电子数目为___________  ,右侧烧杯中
,右侧烧杯中 的物质的量改变了
的物质的量改变了___________  。
。
(4)原电池工作时能量转化形式为_______ ,根据原电池形成条件,下列反应理论上可以设计成原电池的是_______ (填标号)。
A. 与
与 的反应 B.
的反应 B. 和
和 的反应
的反应
C. 和
和 的反应 D.
的反应 D. 和
和 的反应
的反应
(5)以 为原理设计燃枓电池,其利用率高,装置如图所示。
为原理设计燃枓电池,其利用率高,装置如图所示。
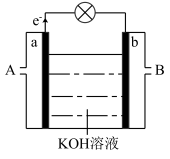
①A处加入的是___________ ,a处的电极反应式是_______ 。
②当消耗标准状况下3.36L 时,导线上转移的电子的物质的量是
时,导线上转移的电子的物质的量是___________ mol。

(1)该原电池工作过程中,电池的负极上的电极反应式为
(2)该原电池工作时,下列说法正确的是___________(填标号)。
A.电子移动的方向:石墨 铁 铁 |
B.盐桥中的 会向右侧烧杯移动 会向右侧烧杯移动 |
C. 溶液的颜色会逐渐变浅 溶液的颜色会逐渐变浅 |
D.将 盐桥换成 盐桥换成 盐桥,该装置不能长时间正常工作 盐桥,该装置不能长时间正常工作 |
 时,外电路中转移的电子数目为
时,外电路中转移的电子数目为 ,右侧烧杯中
,右侧烧杯中 的物质的量改变了
的物质的量改变了 。
。(4)原电池工作时能量转化形式为
A.
 与
与 的反应 B.
的反应 B. 和
和 的反应
的反应C.
 和
和 的反应 D.
的反应 D. 和
和 的反应
的反应(5)以
 为原理设计燃枓电池,其利用率高,装置如图所示。
为原理设计燃枓电池,其利用率高,装置如图所示。
①A处加入的是
②当消耗标准状况下3.36L
 时,导线上转移的电子的物质的量是
时,导线上转移的电子的物质的量是
您最近一年使用:0次
名校
6 . 能量、速率与限度是认识和研究化学反应的重要视角。
Ⅰ.为了探究原电池的工作原理,设计如下装置。

(1)甲装置中负极电极反应式为_____ 。
(2)当乙装置中的负极质量减少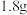 时,正极产生气体
时,正极产生气体_____ L(标准状况下); 向
向_____ (填“ ”或“
”或“ ”)电极移动。
”)电极移动。
(3)当丙装置中导线通过 电子时,两电极质量相差
电子时,两电极质量相差_____ g(放电前两电极质量相等)。
Ⅱ. 都是重要的能源物质,也是重要的化工原料。利用
都是重要的能源物质,也是重要的化工原料。利用 还原
还原 能有效促进“碳中和”,反应的化学方程式为
能有效促进“碳中和”,反应的化学方程式为 。
。
(4)反应过程中的能量变化如图所示:
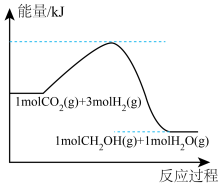
则该反应是_____ (填“放热”或“吸热”)反应。
(5)300℃时,向容积为 的恒容密闭容器中,充入
的恒容密闭容器中,充入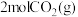 和
和 ,反应过程中测得各物质的物质的量浓度随时间变化如图所示。回答下列问题:
,反应过程中测得各物质的物质的量浓度随时间变化如图所示。回答下列问题:
① 的浓度随时间变化曲线为
的浓度随时间变化曲线为_____ (填“a”、“b”或“c”);在M点,
_____ 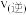 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
② 时,反应速率改变的原因可能是
时,反应速率改变的原因可能是_____ 。
A.升高温度B.降低温度C.充入一定量的 D.加入催化剂
D.加入催化剂
③下列叙述不能说明该反应达到平衡状态的是_____ 。
A.
B.混合气体的密度不再变化
C.混合气体的平均摩尔质量不再变化
D.单位时间内生成 ,同时消耗
,同时消耗
Ⅰ.为了探究原电池的工作原理,设计如下装置。

(1)甲装置中负极电极反应式为
(2)当乙装置中的负极质量减少
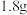 时,正极产生气体
时,正极产生气体 向
向 ”或“
”或“ ”)电极移动。
”)电极移动。(3)当丙装置中导线通过
 电子时,两电极质量相差
电子时,两电极质量相差Ⅱ.
 都是重要的能源物质,也是重要的化工原料。利用
都是重要的能源物质,也是重要的化工原料。利用 还原
还原 能有效促进“碳中和”,反应的化学方程式为
能有效促进“碳中和”,反应的化学方程式为 。
。(4)反应过程中的能量变化如图所示:

则该反应是
(5)300℃时,向容积为
 的恒容密闭容器中,充入
的恒容密闭容器中,充入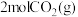 和
和 ,反应过程中测得各物质的物质的量浓度随时间变化如图所示。回答下列问题:
,反应过程中测得各物质的物质的量浓度随时间变化如图所示。回答下列问题:
①
 的浓度随时间变化曲线为
的浓度随时间变化曲线为
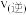 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。②
 时,反应速率改变的原因可能是
时,反应速率改变的原因可能是A.升高温度B.降低温度C.充入一定量的
 D.加入催化剂
D.加入催化剂③下列叙述不能说明该反应达到平衡状态的是
A.

B.混合气体的密度不再变化
C.混合气体的平均摩尔质量不再变化
D.单位时间内生成
 ,同时消耗
,同时消耗
您最近一年使用:0次
2023-07-12更新
|
214次组卷
|
2卷引用:山东省聊城市2022-2023学年高一下学期期末考试化学试题
7 . Ⅰ.汽车是重要的交通工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。
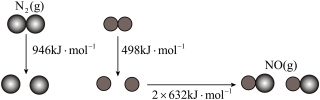
(1)汽车尾气中 生成过程的能量变化如图所示,1mol
生成过程的能量变化如图所示,1mol 和1mol
和1mol 完全反应生成
完全反应生成 应
应_______ (填“吸收”或“释放”)_______ kJ能量。
(2)实验室在一恒容密闭容器中模拟汽车尾气 和
和 的转化,主要发生的反应是:
的转化,主要发生的反应是: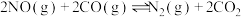
①下列方法能加快化学反应速率的是_______ (填标号)。
a.充入 b.升高温度 c.加入催化剂 d.及时分离出
b.升高温度 c.加入催化剂 d.及时分离出
②若容器为绝热容器,下列能说明反应达到平衡状态的是_______ (填标号)。
a.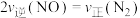 b.容器内的压强保持不变
b.容器内的压强保持不变
c.容器内混合气体密度保持不变 d.容器内温度不再变化
Ⅱ.由 制备甲醇(
制备甲醇( )是实现“双碳”目标的重要途径。已知:
)是实现“双碳”目标的重要途径。已知: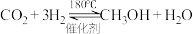 ,在体积为2L的密闭容器中,充入1mol
,在体积为2L的密闭容器中,充入1mol 催化剂和0.5mol
催化剂和0.5mol ,测得部分物质的物质的量随时间变化如下图所示:
,测得部分物质的物质的量随时间变化如下图所示:
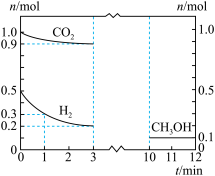
(3)0~1min内,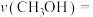
_______ (保留两位有效数字)。
(4)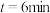 时,
时,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
Ⅲ.煤燃烧排放的烟气中含有 和
和 ,会污染大气,形成酸雨。
,会污染大气,形成酸雨。
(5)将生石灰与含硫的煤混合后再燃烧,可将 最终转化为
最终转化为 ,写出
,写出 转化为
转化为 的化学方程式
的化学方程式_______ 。
(6)如图是利用原电池原理将 转化为
转化为 的示意图。
的示意图。
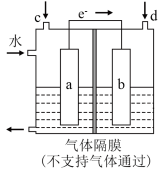
a电极为_______ (填“正极”或“负极”);d口通入的气体是_______ (填“ ”或“
”或“ ”)。
”)。
(1)汽车尾气中
 生成过程的能量变化如图所示,1mol
生成过程的能量变化如图所示,1mol 和1mol
和1mol 完全反应生成
完全反应生成 应
应
(2)实验室在一恒容密闭容器中模拟汽车尾气
 和
和 的转化,主要发生的反应是:
的转化,主要发生的反应是: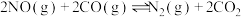
①下列方法能加快化学反应速率的是
a.充入
 b.升高温度 c.加入催化剂 d.及时分离出
b.升高温度 c.加入催化剂 d.及时分离出
②若容器为绝热容器,下列能说明反应达到平衡状态的是
a.
 b.容器内的压强保持不变
b.容器内的压强保持不变c.容器内混合气体密度保持不变 d.容器内温度不再变化
Ⅱ.由
 制备甲醇(
制备甲醇( )是实现“双碳”目标的重要途径。已知:
)是实现“双碳”目标的重要途径。已知: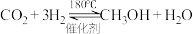 ,在体积为2L的密闭容器中,充入1mol
,在体积为2L的密闭容器中,充入1mol 催化剂和0.5mol
催化剂和0.5mol ,测得部分物质的物质的量随时间变化如下图所示:
,测得部分物质的物质的量随时间变化如下图所示:
(3)0~1min内,
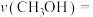
(4)
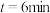 时,
时,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。Ⅲ.煤燃烧排放的烟气中含有
 和
和 ,会污染大气,形成酸雨。
,会污染大气,形成酸雨。(5)将生石灰与含硫的煤混合后再燃烧,可将
 最终转化为
最终转化为 ,写出
,写出 转化为
转化为 的化学方程式
的化学方程式(6)如图是利用原电池原理将
 转化为
转化为 的示意图。
的示意图。
a电极为
 ”或“
”或“ ”)。
”)。
您最近一年使用:0次
名校
解题方法
8 . I.已知反应: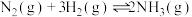 。将等物质的量的N2和H2的混合气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
。将等物质的量的N2和H2的混合气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
(1)工业上不同催化剂条件下合成氨反应的历程如图1所示,吸附在催化剂表面的物种用“*”表示。催化剂的催化效果更好的是___________ (填A或B);常温常压下,合成氨反应速率慢的根本原因___________ 。

(2)下列措施能使该反应速率加快的是___________
(3)下列可以说明该反应达到平衡状态的是___________
A. 保持不变
保持不变
B.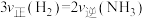
C.N2的体积分数保持不变
D.混合气体的压强不再变化
E.混合气体的密度保持不变
(4)若反应达到平衡状态时,容器内压强为原来的0.8,则N2的平衡转化率为___________ ;NH3的体积分数为___________ 。
Ⅱ.已知NO2、O2和熔融KNO3可制作燃料电池,其原理如图2所示。

(5)该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则石墨Ⅰ为___________ 极(填“正”或“负”)。
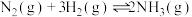 。将等物质的量的N2和H2的混合气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
。将等物质的量的N2和H2的混合气体充入体积为2L的恒容密闭容器中,控制反应温度为T。(1)工业上不同催化剂条件下合成氨反应的历程如图1所示,吸附在催化剂表面的物种用“*”表示。催化剂的催化效果更好的是

(2)下列措施能使该反应速率加快的是___________
| A.增大N2的浓度 | B.压缩容器体积 |
| C.将NH3液化分离 | D.恒容条件下充入He |
A.
 保持不变
保持不变 B.
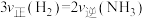
C.N2的体积分数保持不变
D.混合气体的压强不再变化
E.混合气体的密度保持不变
(4)若反应达到平衡状态时,容器内压强为原来的0.8,则N2的平衡转化率为
Ⅱ.已知NO2、O2和熔融KNO3可制作燃料电池,其原理如图2所示。

(5)该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用,则石墨Ⅰ为
您最近一年使用:0次
9 . 化学反应的快慢和限度对人类生产生活有重要的影响。
Ⅰ.某反应过程的能量变化如图所示:

(1)由图中曲线变化可知,该反应为___________ (填“放热”或“吸热”)反应,破坏旧键需要吸收的能量为___________ (填“ ”或“
”或“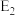 ”)。
”)。
Ⅱ. 时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,该反应的正反应为放热反应。回答下列问题:
时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,该反应的正反应为放热反应。回答下列问题:
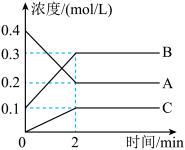
(2)该反应的反应物是___________ 。
(3) 内,C的反应速率为
内,C的反应速率为___________ 。
(4)在其他条件下,测得A的反应速率为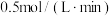 ,此时的反应速率与
,此时的反应速率与 时相比
时相比___________ 。
A.比 时慢 B.比
时慢 B.比 时快 C.和
时快 C.和 时速率一样
时速率一样
(5)能使该反应的反应速率增大的是___________。
Ⅲ.一种用于潜艇的液氨-液氧燃料电池原理示意图如下图所示。已知电池总电极反应为
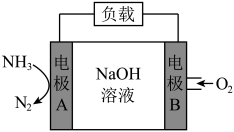
(6)电极B是___________ 极(填“正”或“负”)。
(7)该电池工作时,标况下每消耗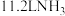 ,转移电子数为
,转移电子数为___________ 。
(8)电极A上发生的电极反应为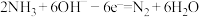 ;则电极B上发生的电极反应式为
;则电极B上发生的电极反应式为___________ 。
Ⅰ.某反应过程的能量变化如图所示:

(1)由图中曲线变化可知,该反应为
 ”或“
”或“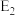 ”)。
”)。Ⅱ.
 时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,该反应的正反应为放热反应。回答下列问题:
时,A、B、C三种气体在恒容密闭容器中反应时的浓度变化如图所示,该反应的正反应为放热反应。回答下列问题:
(2)该反应的反应物是
(3)
 内,C的反应速率为
内,C的反应速率为(4)在其他条件下,测得A的反应速率为
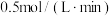 ,此时的反应速率与
,此时的反应速率与 时相比
时相比A.比
 时慢 B.比
时慢 B.比 时快 C.和
时快 C.和 时速率一样
时速率一样(5)能使该反应的反应速率增大的是___________。
| A.适当升高温度 | B.及时分离出 气体 气体 | C.适当降低温度 | D.选择高效的催化剂 |
Ⅲ.一种用于潜艇的液氨-液氧燃料电池原理示意图如下图所示。已知电池总电极反应为


(6)电极B是
(7)该电池工作时,标况下每消耗
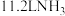 ,转移电子数为
,转移电子数为(8)电极A上发生的电极反应为
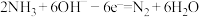 ;则电极B上发生的电极反应式为
;则电极B上发生的电极反应式为
您最近一年使用:0次
10 . 有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/L的硫酸溶液,乙同学将电极放入6mol/L的氢氧化钠溶液中,如图所示:
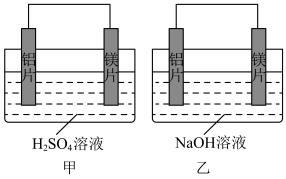
(1)写出甲电池中正极的电极反应式:_______ ;在标准状况下,正极产生33.6L气体得_______ mol电子。
(2)乙中负极为_______ ,总反应的离子方程式:_______ 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则负极材料的金属应比正极材料的金属活泼”,则甲会判断出_______ 活动性更强,而乙会判断出_______ 活动性更强。(填写元素符号)
(4)由此实验,可得到如下哪些正确结论_______。

(1)写出甲电池中正极的电极反应式:
(2)乙中负极为
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则负极材料的金属应比正极材料的金属活泼”,则甲会判断出
(4)由此实验,可得到如下哪些正确结论_______。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的强 |
| C.该实验说明金属活动性顺序表已过时,已没有利用价值 |
| D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析 |
您最近一年使用:0次



