解题方法
1 . 已知在1×105Pa,298 K时断裂1 mol H—H键吸收的能量为436kJ ,断裂l mol N—H键吸收的能量为391kJ,断裂1 mol N≡N键吸收的能量是945kJ。
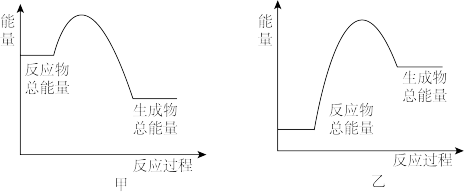
(1)根据以上数据判断工业合成氨的反应N2(g)+3H2(g) 2NH3(g)是
2NH3(g)是________ (填“吸热”或“放热”)反应。该反应的能量变化可用图______ 表示(填"甲”或”乙“)。
(2)H2还原CO电化学法制备甲醇(CO +2H2 CH3OH)的工作原理如图所示。
CH3OH)的工作原理如图所示。

①通入H2的一端是电池的____ 极(填”正”或“负”),电池工作过程中H+通过质子交换膜向______ (填”左”或"右”)移动,通入CO的一端发生的电极反应为_______ 。
②若电池中氢气(H2)通入量为224 mL(标准状况),且反应完全,则理论上通过电流表的电量为______ C(法拉第常数F=9.65×104C/mol)。
(1)根据以上数据判断工业合成氨的反应N2(g)+3H2(g)
 2NH3(g)是
2NH3(g)是
(2)H2还原CO电化学法制备甲醇(CO +2H2
 CH3OH)的工作原理如图所示。
CH3OH)的工作原理如图所示。
①通入H2的一端是电池的
②若电池中氢气(H2)通入量为224 mL(标准状况),且反应完全,则理论上通过电流表的电量为
您最近一年使用:0次
2 . 完成下列问题
(1)2mol (g)被氧化为2mol
(g)被氧化为2mol  (g)时放出热量198kJ,反应
(g)时放出热量198kJ,反应 的能量变化如图。
的能量变化如图。
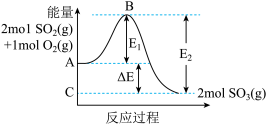
①B的大小对该反应的热量变化___________ (填“有”或“无”)影响。
②2mol (g)和1mol
(g)和1mol  (g)充分反应放出的热量
(g)充分反应放出的热量___________ 198kJ(填“>”、“<”或“=”)。
(2)一定温度下,在体积为2L的密闭容器中,充入1mol 和3mol
和3mol  发生如下反应:
发生如下反应:
 。测得
。测得 (g)和
(g)和 (g)的物质的量随时间变化如图。
(g)的物质的量随时间变化如图。
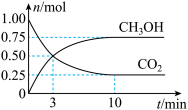
①从反应开始到平衡, 的平均反应速率
的平均反应速率
___________ 。
②达到平衡时, 的转化率为
的转化率为___________ 。(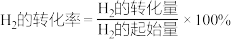 )
)
③下列措施不能提高化学反应速率的是___________ 。
A.升高温度 B.加入适当催化剂 C.缩小体积,增大压强 D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是___________ 。
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C.反应中 与
与 的物质的量之比为1:1
的物质的量之比为1:1
D.单位时间每消耗1mol 同时生成1mol
同时生成1mol 
(3)如图,左侧石墨上通入 ,右侧石墨上通入
,右侧石墨上通入 ,电解质溶液为KOH溶液。
,电解质溶液为KOH溶液。
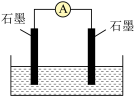
①通入 为
为___________ (填“正”或“负”)极。
②当外电路通过7mol电子时,通入 在标准状况下的体积为
在标准状况下的体积为___________ (列式即可,假设能量全部转化为电能)。
(1)2mol
 (g)被氧化为2mol
(g)被氧化为2mol  (g)时放出热量198kJ,反应
(g)时放出热量198kJ,反应 的能量变化如图。
的能量变化如图。
①B的大小对该反应的热量变化
②2mol
 (g)和1mol
(g)和1mol  (g)充分反应放出的热量
(g)充分反应放出的热量(2)一定温度下,在体积为2L的密闭容器中,充入1mol
 和3mol
和3mol  发生如下反应:
发生如下反应: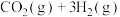
 。测得
。测得 (g)和
(g)和 (g)的物质的量随时间变化如图。
(g)的物质的量随时间变化如图。
①从反应开始到平衡,
 的平均反应速率
的平均反应速率
②达到平衡时,
 的转化率为
的转化率为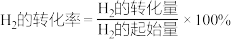 )
)③下列措施不能提高化学反应速率的是
A.升高温度 B.加入适当催化剂 C.缩小体积,增大压强 D.恒温、恒压下通入氦气
④下列叙述中不能说明上述反应达到平衡状态的是
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C.反应中
 与
与 的物质的量之比为1:1
的物质的量之比为1:1D.单位时间每消耗1mol
 同时生成1mol
同时生成1mol 
(3)如图,左侧石墨上通入
 ,右侧石墨上通入
,右侧石墨上通入 ,电解质溶液为KOH溶液。
,电解质溶液为KOH溶液。
①通入
 为
为②当外电路通过7mol电子时,通入
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
解题方法
3 . 原电池揭示了氧化还原反应的本质是电子转移,实现了化学能转化成电能,使氧化还原反应在现代生活中获得重大应用,从而改变了人们的生活方式。
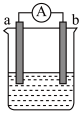
某兴趣小组为探究原电池工作原理,利用金属Zn与稀 反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。
反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。

根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作______ (填“正”或“负”)极,Zn电极上的电极反应式______ 。
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“离子导体”中主要离子的移动方向可描述为______ 。
(3)从能量转化的角度来看,装置A中反应物的总能量______ (填“高于”、“低于”或“=”)生成物的总能量;从反应速率的角度上看,可以观察到A中反应比B中______ (填“快”或“慢”)。
(4)装置B中稀 用足量
用足量 溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为
溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为______ 。
(5)该小组同学由此得出的结论错误的是______。(多选)
某兴趣小组为探究原电池工作原理,利用金属Zn与稀
 反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。
反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。
根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“离子导体”中主要离子的移动方向可描述为
(3)从能量转化的角度来看,装置A中反应物的总能量
(4)装置B中稀
 用足量
用足量 溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为
溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为(5)该小组同学由此得出的结论错误的是______。(多选)
| A.任何自发进行的氧化还原反应均可以设计成原电池 |
| B.装置B中Cu电极不可用碳棒代替 |
| C.原电池的负极发生还原反应 |
| D.原电池装置中化学能全部转化为电能 |
您最近一年使用:0次
名校
解题方法
4 . 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果:

分析上述实验,回答下列问题:
(1)实验2中电流由________ 极流向________ 极(填“A”或“B”)。A电极反应式________ ,
(2)实验6中电子由B极流向A极,表明负极是________ (填“镁”或“铝”)电极,发生________ (氧化反应,还原反应)
(3)实验5表明________ 。
A.铜在潮湿空气中不会被腐蚀B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是________ 。
A.相对活泼的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)

| 实验 序号 | A | B | 烧杯中的液体 | 灵敏电流计指针是否偏转 |
| 1 | Zn | Zn | 乙醇 | 无 |
| 2 | Zn | Cu | 稀硫酸 | 有 |
| 3 | Zn | Zn | 稀硫酸 | 无 |
| 4 | Zn | Cu | 苯 | 无 |
| 5 | Cu | C | 氯化钠溶液 | 有 |
| 6 | Mg | Al | 氢氧化钠溶液 | 有 |
(1)实验2中电流由
(2)实验6中电子由B极流向A极,表明负极是
(3)实验5表明
A.铜在潮湿空气中不会被腐蚀B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
您最近一年使用:0次
2020-07-26更新
|
92次组卷
|
2卷引用:江西省赣州中学2023-2024学年高二上学期月考化学试题
名校
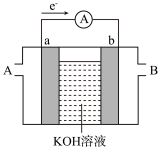
5 . Ⅰ.燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。
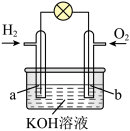
(1)负极是_________ (填“a”或“b”),该电极上发生_________ (填“氧化”或“还原”)反应。
(2)b极发生的电极反应式是__________________ 。
(3)标准状况下,消耗 时,转移的电子数为
时,转移的电子数为_________ 。
Ⅱ. 时,向
时,向 的恒容密闭容器中,充入
的恒容密闭容器中,充入 和
和 使之发生反应
使之发生反应 ,测得各物质的物质的量浓度变化如图所示:
,测得各物质的物质的量浓度变化如图所示:
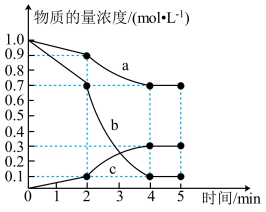
(4)由图可知, 的浓度随时间的变化为曲线
的浓度随时间的变化为曲线_________ (填“a”“b”或“c”); 内的平均反应速率
内的平均反应速率 为
为_________ 。
(5)已知:反应至 时,改变了某一反应条件。由图可知,
时,改变了某一反应条件。由图可知, 内
内 的生成速率
的生成速率_________ (填“大于”“小于”或“等于”) 内
内 的生成速率。
的生成速率。
(6) 时,
时, 的转化率(反应时消耗
的转化率(反应时消耗 的物质的量占起始投入
的物质的量占起始投入 的物质的量的百分比)为
的物质的量的百分比)为_________ ,此时容器内气体总压强与反应前容器内气体总压强之比为_________ 。

(1)负极是
(2)b极发生的电极反应式是
(3)标准状况下,消耗
 时,转移的电子数为
时,转移的电子数为Ⅱ.
 时,向
时,向 的恒容密闭容器中,充入
的恒容密闭容器中,充入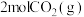 和
和 使之发生反应
使之发生反应 ,测得各物质的物质的量浓度变化如图所示:
,测得各物质的物质的量浓度变化如图所示:
(4)由图可知,
 的浓度随时间的变化为曲线
的浓度随时间的变化为曲线 内的平均反应速率
内的平均反应速率 为
为(5)已知:反应至
 时,改变了某一反应条件。由图可知,
时,改变了某一反应条件。由图可知, 内
内 的生成速率
的生成速率 内
内 的生成速率。
的生成速率。(6)
 时,
时, 的转化率(反应时消耗
的转化率(反应时消耗 的物质的量占起始投入
的物质的量占起始投入 的物质的量的百分比)为
的物质的量的百分比)为
您最近一年使用:0次
名校
解题方法
6 . 从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经外接导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
(1)下列反应通过原电池装置,不能实现化学能直接转化为电能的是___________(填序号)。
(2)FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为___________ ,若将此反应设计成原电池,请写出该原电池正极的电极反应:___________ 。
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
①当电极a为Zn片,电极b为Cu片,且两极板质量相等。电解质溶液为CuSO4溶液,当电路中有0.2mole-通过时,两极板的质量差为___________ g。
②当电极a为Mg片,电极b为Al片,电解质溶液为NaOH溶液时,则负极的电极反应式为___________ 。
(4)某种燃料电池的工作原理示意图如图所示,a、b均为惰性电极。
①溶液中OH-移向___________ 极(填“a”或“b”)
②空气从___________ (填“A”或“B”)口通入
(1)下列反应通过原电池装置,不能实现化学能直接转化为电能的是___________(填序号)。
A.2H2+O2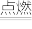 2H2O 2H2O | B.CaO+H2O=Ca(OH)2 | C.Fe+Cu2+=Cu+Fe2+ |
(3)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

①当电极a为Zn片,电极b为Cu片,且两极板质量相等。电解质溶液为CuSO4溶液,当电路中有0.2mole-通过时,两极板的质量差为
②当电极a为Mg片,电极b为Al片,电解质溶液为NaOH溶液时,则负极的电极反应式为
(4)某种燃料电池的工作原理示意图如图所示,a、b均为惰性电极。

①溶液中OH-移向
②空气从
您最近一年使用:0次
解题方法
7 . 化学物质在汽车的动力、安全等方面有着极为重要的作用。
(1)汽油是以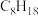 为主要成分的混合烃类。
为主要成分的混合烃类。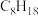 燃烧的化学方程式是
燃烧的化学方程式是___________ 。
(2)汽车尾气中含有NO,CO等污染物。其中NO生成过程的能量变化示意图如图。由该图形数据计算可得,该反应为___________ (填“吸热”或“放热”)反应。___________ 反应(填“氧化”或“还原”)。
②外电路中,电子流动方向是从___________ 电极流向___________ 电极(填“NiO”或“Pt”)。
③Pt电极上的电极反应式为___________ 。
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应: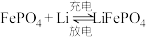 。
。
①放电时,Li做电池的___________ 极。
②Na也可以做电池的电极,但Li做电极更有优势。试解释原因___________ 。
(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有 、
、 、
、 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。
①推测 的作用是
的作用是___________ 。
②结合化学方程式解释 的作用
的作用___________ 。
③结合上述例子,在设计气囊中所运用的化学反应时,需要考虑的角度有___________ (填代号,可多选)。
a.反应速率 b.反应的能量变化 c.气体的量 d.气体毒性
(1)汽油是以
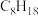 为主要成分的混合烃类。
为主要成分的混合烃类。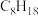 燃烧的化学方程式是
燃烧的化学方程式是(2)汽车尾气中含有NO,CO等污染物。其中NO生成过程的能量变化示意图如图。由该图形数据计算可得,该反应为

②外电路中,电子流动方向是从
③Pt电极上的电极反应式为
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应:
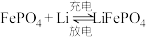 。
。①放电时,Li做电池的
②Na也可以做电池的电极,但Li做电极更有优势。试解释原因
(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有
 、
、 、
、 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。①推测
 的作用是
的作用是②结合化学方程式解释
 的作用
的作用③结合上述例子,在设计气囊中所运用的化学反应时,需要考虑的角度有
a.反应速率 b.反应的能量变化 c.气体的量 d.气体毒性
您最近一年使用:0次
名校
解题方法
8 . 含氮化合物在农业、工业、国防等领域都有着广泛的应用。氮元素部分常见物质间的相互转化如图所示。
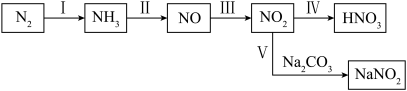
回答相关问题。
Ⅰ.
(1)图示中标示出了以氨为原料制备硝酸的全过程,写出过程Ⅱ的化学方程式:_____ ;过程Ⅳ不断通入空气,理论上能使 最终完全吸收,则1.7吨
最终完全吸收,则1.7吨 理论上可以得到
理论上可以得到_____ 吨质量分数为63%的硝酸。
(2)某温度下,在容积恒定为 的密闭容器中充入
的密闭容器中充入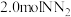 和
和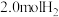 ,一段时间后反应达平衡状态,实验数据如下表所示
,一段时间后反应达平衡状态,实验数据如下表所示
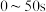 内的平均反应速率
内的平均反应速率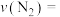
_____ ,250s时, 的转化率为
的转化率为_____ 。
Ⅱ.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是 )和水分子通过。其工作原理的示意图如图所示,请回答下列问题:
)和水分子通过。其工作原理的示意图如图所示,请回答下列问题:

(3)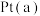 电极是电池的
电极是电池的_____ (填“正”或“负”)极。
(4)电解质溶液中的 向
向_____ (填“a”或“b”)极移动。
(5)该电池的负极反应式为_____

回答相关问题。
Ⅰ.
(1)图示中标示出了以氨为原料制备硝酸的全过程,写出过程Ⅱ的化学方程式:
 最终完全吸收,则1.7吨
最终完全吸收,则1.7吨 理论上可以得到
理论上可以得到(2)某温度下,在容积恒定为
 的密闭容器中充入
的密闭容器中充入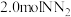 和
和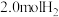 ,一段时间后反应达平衡状态,实验数据如下表所示
,一段时间后反应达平衡状态,实验数据如下表所示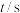 | 0 | 50 | 150 | 250 | 350 |
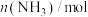 | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
 内的平均反应速率
内的平均反应速率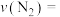
 的转化率为
的转化率为Ⅱ.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是
 )和水分子通过。其工作原理的示意图如图所示,请回答下列问题:
)和水分子通过。其工作原理的示意图如图所示,请回答下列问题:
(3)
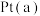 电极是电池的
电极是电池的(4)电解质溶液中的
 向
向(5)该电池的负极反应式为
您最近一年使用:0次
解题方法
9 . 请根据有关知识,填写下列空白:
(1)拆开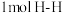 键,
键,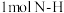 键,
键,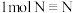 键分别需要吸收的能量为
键分别需要吸收的能量为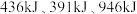 。则理论上
。则理论上 生成
生成
___________ 热量(填“吸收”或“放出”)___________ kJ;事实上,反应的热量总小于理论值,理由是___________
(2)某兴趣小组为研究原电池原理,设计如图装置。
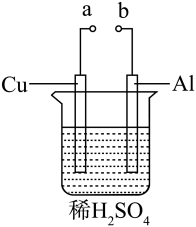
a和b用导线连接,Cu极为原电池___________ 极填(“正”或“负”),电极反应式是___________ Al极发生___________ 填(“氧化”或“还原”)反应,其电极反应式为___________ ,溶液中 移向
移向___________ (填“Cu”或“Al”极)。溶液pH___________ (填增大或减小)。当负极金属溶解5.4g时,___________  电子通过导线。
电子通过导线。
(1)拆开
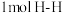 键,
键,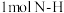 键,
键,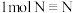 键分别需要吸收的能量为
键分别需要吸收的能量为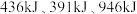 。则理论上
。则理论上 生成
生成
(2)某兴趣小组为研究原电池原理,设计如图装置。

a和b用导线连接,Cu极为原电池
 移向
移向 电子通过导线。
电子通过导线。
您最近一年使用:0次
解题方法
10 . Ⅰ.为了探究化学反应的热效应,某兴趣小组进行了如下实验:

(1)如图a所示,室温下,观察到甲处液面上升,乙处液面下降,则该反应是___________ (填“放热”或“吸热”)反应,写出该反应的化学方程式:___________ 。
(2)如图b所示,室温下,把装有固体A的试管放入盛有饱和澄清石灰水的烧杯中,向该试管中滴入一定量的液体B,观察到烧杯中的饱和澄清石灰水变浑浊,则该反应是___________ (填“放热”或“吸热”)反应,写出一个符合该条件的化学方程式:___________ 。
(3)如图c所示,室温下,通过仪器丙向仪器丁中的一定浓度的盐酸中加入一定浓度的氢氧化钠溶液,仪器丙的名称为___________ 。
Ⅱ.
(4)在一定温度下,容积为1 L的恒容密闭容器中某一反应中所涉及的物质仅有M、N,其物质的量随反应时间变化的曲线如图所示。下列表述中错误的是___________ 。
A.该反应的化学方程式为2N(g)⇌M(g)
B.0~t2,该反应的平均反应速率v(N)=4 mol•L-1•min-1
C.t3时,反应达到平衡
D.t1时,N的浓度是M的2倍
E.t3时,反应停止
Ⅲ.
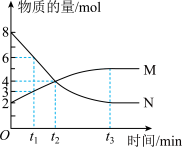
(5)铜锌原电池是人类最早研究的化学电源之一,其简易装置如图所示,可观察到的现象是锌片溶解,铜片表面产生气泡,电流计指针偏向铜电极,根据上述原理,以下各种原电池的分析正确的是___________ 。

(1)如图a所示,室温下,观察到甲处液面上升,乙处液面下降,则该反应是
(2)如图b所示,室温下,把装有固体A的试管放入盛有饱和澄清石灰水的烧杯中,向该试管中滴入一定量的液体B,观察到烧杯中的饱和澄清石灰水变浑浊,则该反应是
(3)如图c所示,室温下,通过仪器丙向仪器丁中的一定浓度的盐酸中加入一定浓度的氢氧化钠溶液,仪器丙的名称为
Ⅱ.
(4)在一定温度下,容积为1 L的恒容密闭容器中某一反应中所涉及的物质仅有M、N,其物质的量随反应时间变化的曲线如图所示。下列表述中错误的是

A.该反应的化学方程式为2N(g)⇌M(g)
B.0~t2,该反应的平均反应速率v(N)=4 mol•L-1•min-1
C.t3时,反应达到平衡
D.t1时,N的浓度是M的2倍
E.t3时,反应停止
Ⅲ.
(5)铜锌原电池是人类最早研究的化学电源之一,其简易装置如图所示,可观察到的现象是锌片溶解,铜片表面产生气泡,电流计指针偏向铜电极,根据上述原理,以下各种原电池的分析正确的是

| 选项 | A | B | C | D |
| 装置 | 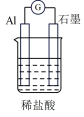 |  | 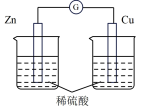 | 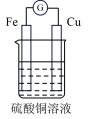 |
| 分析 | Al电极为负极,H+在该极发生还原反应 | 电流计指针偏向Al,溶液中的OH-移向Mg电极 | 电流由Cu电极流向Zn电极,Cu片表面产生气泡 | 电子由Fe电极流向Cu电极,Fe发生氧化反应 |
您最近一年使用:0次



