名校
解题方法
1 . 某小组同学实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:_______ 。
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为_______ 。
综合上述实验,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(2)采用电化学装置进行验证。
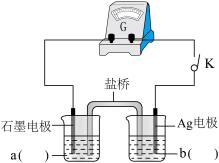
小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为_______ 溶液;b为_______ 溶液;(写a、b化学式)
ii.再向左侧烧杯中滴加较浓的_______ 溶液,产生的现象为_______ 。表明“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(1)实验验证
实验I:将0.0100mol/LAg2SO4溶液与0.0400mo/LFeSO4溶液(pH=1)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入0.0100mol/LFe2(SO4)3溶液(pH=1),固体完全溶解。
①取I中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:
②Ⅱ中溶液选用Fe2(SO4)3,不选用Fe(NO3)3的原因为
综合上述实验,证实“Ag++Fe2+
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(2)采用电化学装置进行验证。

小组同学设计如上图电化学装置进行实验:
i.按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为
ii.再向左侧烧杯中滴加较浓的
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
您最近一年使用:0次
2023-08-20更新
|
205次组卷
|
2卷引用:山东省青岛第一中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
2 . Ⅰ、在某温度时,在0.5L的恒容容器中发生气体M、N两种物质的相互转化,M、N的物质的量随时间变化的曲线如图所示,请根据图中数据分析,完成下列问题:
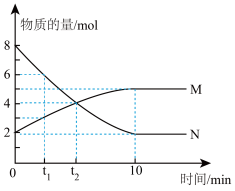
(1)该反应的化学方程式___________ 。
(2)反应开始的一瞬间进行的反应___________ (填“只有正反应发生”或者“只有逆反应发生”、“正、逆反应同时发生”),在t2时刻M的正反应速率___________ M的逆反应速率(填“大于”或者“小于”、“等于”),反应进行到10min时,N的平均反应速率为___________ 。
Ⅱ、被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
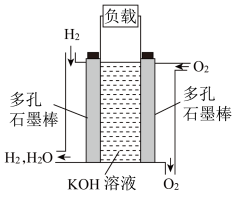
(3)O2进入的电极为___________ (填“正极”或“负极”)。
(4)电池工作时,溶液中的OH−向___________ (填“正极”或“负极”)迁移。
(5)若电池工作时转移0.04mol电子,理论上消耗标准状态下___________ mL O2。

(1)该反应的化学方程式
(2)反应开始的一瞬间进行的反应
Ⅱ、被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:

(3)O2进入的电极为
(4)电池工作时,溶液中的OH−向
(5)若电池工作时转移0.04mol电子,理论上消耗标准状态下
您最近一年使用:0次
3 . 自上世纪初,德国化学家哈伯开始研究“合成氨”起至今,许多科学家的研究一直在进行,也取得了许多成果。请按要求回答下列题目。
现已知N2(g)和H2(g)反应每生成1molNH3(g)放出46kJ的热量。
(1)根据下列键能数据计算N-H键键能为___________ kJ∙mol-1。
(2)①有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是___________ ,A是___________ (填名称)。

②利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向___________ (填“从a到b”或“从b到a”),负极发生的电极反应为___________ 。

现已知N2(g)和H2(g)反应每生成1molNH3(g)放出46kJ的热量。
(1)根据下列键能数据计算N-H键键能为
| 化学键 | H-H | N≡N |
| 键能(kJ∙mol-1) | 436 | 946 |

②利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向

您最近一年使用:0次
解题方法
4 . 能量转化是化学变化的重要特征,按要求回答下列问题:
(1)已知: 键的键能为
键的键能为 ,
, 键的键能为
键的键能为 ,
, 键的键能为
键的键能为 则反应
则反应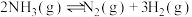 中,理论上消耗
中,理论上消耗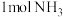
___________ (填“吸收”或“放出”)___________ kJ热量。
(2)把a、b、c、d四种金属片浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a、b相连,a为正极:c、d相连,c为负极:a﹑c相连,c上有气泡逸出:b、d相连,b质量减小,则四种金属的活动性由强到弱顺序为:___________ 。
(3)中国科学院长春应用化学研究所曾在甲烷( )燃料电池技术方面获得重大突破。甲烷燃料电池工作的原理如图所示,甲烷燃料电池采用铂作电板催化剂,电池中的质子交换膜只允许质子(
)燃料电池技术方面获得重大突破。甲烷燃料电池工作的原理如图所示,甲烷燃料电池采用铂作电板催化剂,电池中的质子交换膜只允许质子( )和水分子通过。其工作原理的示意图如下,请回答下列问题:
)和水分子通过。其工作原理的示意图如下,请回答下列问题:
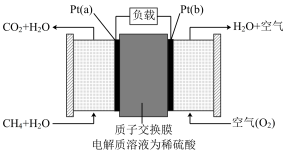
① 的电子式为
的电子式为___________ ,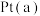 电极反应式为
电极反应式为___________
②电解质溶液中的 向
向___________ (填“a”或“b”)极移动,电子流出的电极是___________ (填“a”或“b”)极。
③该电池工作时消耗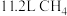 (标准状况下),假设电池的能量转化率为80%,则电路中通过
(标准状况下),假设电池的能量转化率为80%,则电路中通过___________ mol电子。
(1)已知:
 键的键能为
键的键能为 ,
, 键的键能为
键的键能为 ,
, 键的键能为
键的键能为 则反应
则反应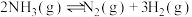 中,理论上消耗
中,理论上消耗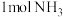
(2)把a、b、c、d四种金属片浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a、b相连,a为正极:c、d相连,c为负极:a﹑c相连,c上有气泡逸出:b、d相连,b质量减小,则四种金属的活动性由强到弱顺序为:
(3)中国科学院长春应用化学研究所曾在甲烷(
 )燃料电池技术方面获得重大突破。甲烷燃料电池工作的原理如图所示,甲烷燃料电池采用铂作电板催化剂,电池中的质子交换膜只允许质子(
)燃料电池技术方面获得重大突破。甲烷燃料电池工作的原理如图所示,甲烷燃料电池采用铂作电板催化剂,电池中的质子交换膜只允许质子( )和水分子通过。其工作原理的示意图如下,请回答下列问题:
)和水分子通过。其工作原理的示意图如下,请回答下列问题:
①
 的电子式为
的电子式为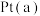 电极反应式为
电极反应式为②电解质溶液中的
 向
向③该电池工作时消耗
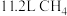 (标准状况下),假设电池的能量转化率为80%,则电路中通过
(标准状况下),假设电池的能量转化率为80%,则电路中通过
您最近一年使用:0次
5 . 碱性银锌二次航空电池为价格昂贵的高能电池。该电池的总反应为:Zn+Ag2O ZnO+2Ag。其电池中的基本单元示意图如图:
ZnO+2Ag。其电池中的基本单元示意图如图:

(1)该电池放电时,锌电极板为电池的____ (填“正极”或“负极”)。
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应i.锌电极板的溶解:…
反应ii.锌电极板上ZnO的析出:Zn(OH)
 ZnO+2OH-+H2O
ZnO+2OH-+H2O
补充反应i:_____ 。
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,从速率和平衡的角度说明其原因:____ 。
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响OH-进出蜂窝孔的速率,导致孔径内外OH-浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
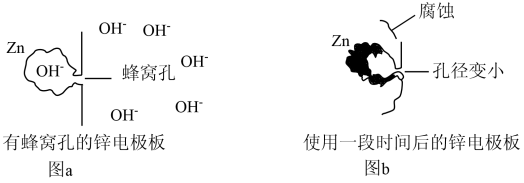
下列说法正确的是____ (填字母序号)。
a.充电时,OH-向锌极板方向迁移
b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外OH-浓度高于孔内OH-浓度
d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
(5)隔膜可有效阻止充放电循环中银的迁移,防止银在锌电极板析出造成电池短路。测定隔膜上附着银元素含量的方法是:用硝酸溶解隔膜上的附着物得溶解液,再以NH4Fe(SO4)2作指示剂,用NH4SCN溶液滴定溶解液。发生反应:
①Ag++SCN- AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012
②Fe3++SCN- FeSCN2+(红色) K=102.3
FeSCN2+(红色) K=102.3
结合上述两个反应的平衡常数,解释选择NH4Fe(SO4)2作为指示剂的原因:____ 。
 ZnO+2Ag。其电池中的基本单元示意图如图:
ZnO+2Ag。其电池中的基本单元示意图如图:
(1)该电池放电时,锌电极板为电池的
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应i.锌电极板的溶解:…
反应ii.锌电极板上ZnO的析出:Zn(OH)

 ZnO+2OH-+H2O
ZnO+2OH-+H2O补充反应i:
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,从速率和平衡的角度说明其原因:
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响OH-进出蜂窝孔的速率,导致孔径内外OH-浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。

下列说法正确的是
a.充电时,OH-向锌极板方向迁移
b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外OH-浓度高于孔内OH-浓度
d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
(5)隔膜可有效阻止充放电循环中银的迁移,防止银在锌电极板析出造成电池短路。测定隔膜上附着银元素含量的方法是:用硝酸溶解隔膜上的附着物得溶解液,再以NH4Fe(SO4)2作指示剂,用NH4SCN溶液滴定溶解液。发生反应:
①Ag++SCN-
 AgSCN↓(白色) K=1012
AgSCN↓(白色) K=1012②Fe3++SCN-
 FeSCN2+(红色) K=102.3
FeSCN2+(红色) K=102.3结合上述两个反应的平衡常数,解释选择NH4Fe(SO4)2作为指示剂的原因:
您最近一年使用:0次
2022-01-15更新
|
232次组卷
|
2卷引用:北京市海淀区2023-2024学年高二上学期期中考试化学试题
名校
解题方法
6 . 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
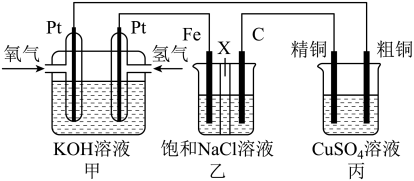
(1)石墨电极为_______ (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入”酚酞溶液,_______ (填“铁极”或“石墨极”)区的溶液先变红。乙池中电解总反应化学方程式为_______ 。
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将_______ (填“增大”“减小”或“不变”)。精铜电极上的电极反应式为_______ 。
(3)若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为_______ mL;丙装置中阴极析出铜的质量为_______ g。
(4)若将甲改用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得燃料电池,则该电池正极反应式为_______ 。

(1)石墨电极为
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将
(3)若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为
(4)若将甲改用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得燃料电池,则该电池正极反应式为
您最近一年使用:0次
2022-12-13更新
|
176次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2022-2023学年高二下学期开学考试化学试题
名校
7 . 电化学原理在电池制造、能量转换、物质合成等方面应用广泛。
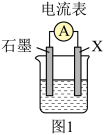
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为_____ (填化学式),石墨电极的电极反应式为_____ 。将石墨换成铁电极后,电池总反应变为_____ 。
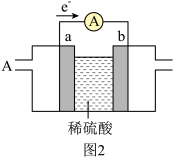
(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为_____ 极,正极的电极反应式为_____ 。当通入4.48L(标准状况下)甲烷气体时,测得电路中转移1.1mol电子,则甲烷的利用率为_____ 。(保留小数点后1位)。
(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为_____ 。当H2和CO共生成2mol时,生成标准状况下O2的体积为_____ 。
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为

(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为

(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为
您最近一年使用:0次
2023-04-29更新
|
238次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一下学期期中考试化学(A)试题
名校
解题方法
8 . 某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据上表中记录的实验现象,回答下列问题:
(1)与实验2中Al电极的作用相同的实验为___________ (填写实验编号)。
(2)实验1中镁为___________ 极,电极反应式为___________ 。
(3)实验4中铝为___________ 极,电极反应式为___________ ,若该实验反应一段时间后,收集到标准状况下的气体体积为224mL,则转移电子的物质的量为___________ 。
(4)实验5中指针偏向Al的原因为___________ 。
(5)根据实验结果总结出影响铝在原电池中做正极或负极的因素:___________ 。
| 实验编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石 墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH溶液 | 偏向Mg |
| 5 | Zn、Al | 浓硝酸 | 偏向Al |
(1)与实验2中Al电极的作用相同的实验为
(2)实验1中镁为
(3)实验4中铝为
(4)实验5中指针偏向Al的原因为
(5)根据实验结果总结出影响铝在原电池中做正极或负极的因素:
您最近一年使用:0次
解题方法
9 . Ⅰ、某小组同学用下列试剂研究将 转化为
转化为 。(已知:
。(已知: ,
, )
)
(1)实验操作:所用试剂: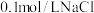 溶液,
溶液,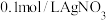 溶液,
溶液,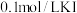 溶液;向盛有
溶液;向盛有 溶液的试管中滴加2滴
溶液的试管中滴加2滴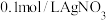 溶液,充分振荡后,
溶液,充分振荡后, ___________ (将操作补充完整)。
(2)实验现象:上述实验中,沉淀由白色变为___________ 色现象可证明 转化为
转化为 。
。
(3)分析及讨论
①该沉淀转化反应的离子方程式是___________ 。
②定量分析。由上述沉淀转化反应的化学平衡常数表达式可推导:
___________ (列式即可,不必计算结果)。
③同学们结合②中的分析方法,认为教材中的表述:“一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现”,可进一步表述为对于组成形式相同的沉淀,
___________ (填“小”或者“大”)的沉淀转化为
___________ (填“更小”或者“更大”)的沉淀容易实现。
Ⅱ、某同学设计如图实验装置研究 溶液和
溶液和 溶液间的反应(a、b均为石墨)。
溶液间的反应(a、b均为石墨)。
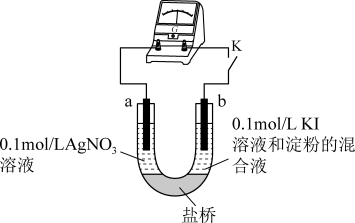
(4)当K闭合后,发现电流计指针偏转,b极附近溶液变蓝。
①b极发生的是___________ (填“氧化”或“还原”)反应。
②a极上的电极反应式是___________ 。
(5)事实证明: 溶液与
溶液与 的溶液混合只能得到
的溶液混合只能得到 沉淀,对比(4)中反应,从反应原理的角度解释产生该事实的可能原因是
沉淀,对比(4)中反应,从反应原理的角度解释产生该事实的可能原因是 与
与 之间发生沉淀反应比氧化还原反应的速率或限度
之间发生沉淀反应比氧化还原反应的速率或限度___________ (填“小”或者“大”)。
 转化为
转化为 。(已知:
。(已知: ,
, )
)(1)实验操作:所用试剂:
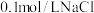 溶液,
溶液,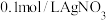 溶液,
溶液,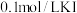 溶液;向盛有
溶液;向盛有 溶液的试管中滴加2滴
溶液的试管中滴加2滴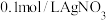 溶液,充分振荡后,
溶液,充分振荡后, (2)实验现象:上述实验中,沉淀由白色变为
 转化为
转化为 。
。(3)分析及讨论
①该沉淀转化反应的离子方程式是
②定量分析。由上述沉淀转化反应的化学平衡常数表达式可推导:

③同学们结合②中的分析方法,认为教材中的表述:“一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现”,可进一步表述为对于组成形式相同的沉淀,


Ⅱ、某同学设计如图实验装置研究
 溶液和
溶液和 溶液间的反应(a、b均为石墨)。
溶液间的反应(a、b均为石墨)。
(4)当K闭合后,发现电流计指针偏转,b极附近溶液变蓝。
①b极发生的是
②a极上的电极反应式是
(5)事实证明:
 溶液与
溶液与 的溶液混合只能得到
的溶液混合只能得到 沉淀,对比(4)中反应,从反应原理的角度解释产生该事实的可能原因是
沉淀,对比(4)中反应,从反应原理的角度解释产生该事实的可能原因是 与
与 之间发生沉淀反应比氧化还原反应的速率或限度
之间发生沉淀反应比氧化还原反应的速率或限度
您最近一年使用:0次
解题方法
10 . 如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_______ (填“正极”或“负极”),负极的电极反应式为_______ 。
(2)铁电极为_______ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______ (填“增大”“减小”或“不变”)
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_______ (用 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
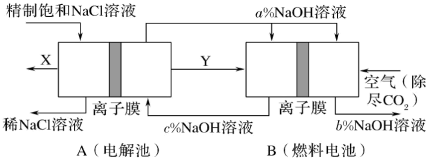
分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_______ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次



