名校
1 . 某小组设计不同实验方案比较 、
、 的氧化性。
的氧化性。
查阅资料: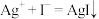
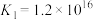 ;
;
(1)方案1:通过置换反应比较
向酸化的 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性 。反应的化学方程式是
。反应的化学方程式是___________ 。
(2)方案2:通过 、
、 分别与同一物质反应进行比较
分别与同一物质反应进行比较
①经检验,I中溶液不含 ,黄色沉淀是
,黄色沉淀是___________ 。
②经检验,II中溶液含 。推测
。推测 做氧化剂,白色沉淀A是CuI.确认A的实验如下:
做氧化剂,白色沉淀A是CuI.确认A的实验如下:

a.检验滤液无 。溶液呈蓝色说明溶液含有
。溶液呈蓝色说明溶液含有___________ (填离子符号)。
b.白色沉淀A与 溶液反应的离子方程式是
溶液反应的离子方程式是___________ ,说明氧化性 。
。
(3)分析方案2中 未能氧化
未能氧化 ,但
,但 氧化了
氧化了 的原因,设计实验如下:
的原因,设计实验如下:
(电极均为石墨,溶液浓度均为1mol/L,b,d中溶液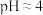 )
)
①a中溶液呈棕黄色的原因是___________ (用电极反应式表示)。
②“实验3”不能说明 氧化了
氧化了 。依据是空气中的氧气也有氧化作用,设计实验证实该依据,实验方案及现象是
。依据是空气中的氧气也有氧化作用,设计实验证实该依据,实验方案及现象是___________ 。
③方案2中, 能氧化
能氧化 ,而
,而 未能氧化
未能氧化 。其原因一是从K值分析:
。其原因一是从K值分析: ,故
,故 更易与
更易与 发生复分解反应,生成AgI;二是从
发生复分解反应,生成AgI;二是从 的反应特点分析:
的反应特点分析:___________ 。
 、
、 的氧化性。
的氧化性。查阅资料:
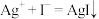
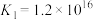 ;
;
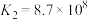
(1)方案1:通过置换反应比较
向酸化的
 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性 。反应的化学方程式是
。反应的化学方程式是(2)方案2:通过
 、
、 分别与同一物质反应进行比较
分别与同一物质反应进行比较| 实验 | 试剂 | 编号及现象 | |
| 试管 | 滴管 | ||
 | 1.0mol/LKI溶液 | 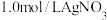 溶液 溶液 | I.产生黄色沉淀,溶液无色 |
 溶液 溶液 | II.产生白色沉淀A,溶液变黄 | ||
 ,黄色沉淀是
,黄色沉淀是②经检验,II中溶液含
 。推测
。推测 做氧化剂,白色沉淀A是CuI.确认A的实验如下:
做氧化剂,白色沉淀A是CuI.确认A的实验如下:
a.检验滤液无
 。溶液呈蓝色说明溶液含有
。溶液呈蓝色说明溶液含有b.白色沉淀A与
 溶液反应的离子方程式是
溶液反应的离子方程式是 。
。(3)分析方案2中
 未能氧化
未能氧化 ,但
,但 氧化了
氧化了 的原因,设计实验如下:
的原因,设计实验如下:| 编号 | 实验1 | 实验2 | 实验3 |
| 实验 |  | 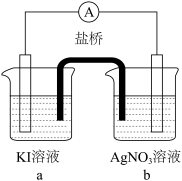 | 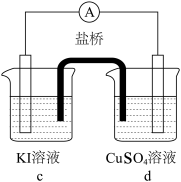 |
| 现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色;电流计指针偏转 |
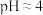 )
)①a中溶液呈棕黄色的原因是
②“实验3”不能说明
 氧化了
氧化了 。依据是空气中的氧气也有氧化作用,设计实验证实该依据,实验方案及现象是
。依据是空气中的氧气也有氧化作用,设计实验证实该依据,实验方案及现象是③方案2中,
 能氧化
能氧化 ,而
,而 未能氧化
未能氧化 。其原因一是从K值分析:
。其原因一是从K值分析: ,故
,故 更易与
更易与 发生复分解反应,生成AgI;二是从
发生复分解反应,生成AgI;二是从 的反应特点分析:
的反应特点分析:
您最近一年使用:0次
名校
解题方法
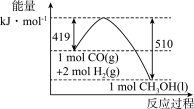
2 . CH3OH、CO、CH4等都是重要的能源,也是重要的化工原料。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。____ 。
②达到平衡时,H2的浓度为____ mol/L。
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是____ 。
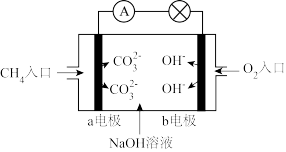
(3)某种甲烷燃料电池的工作原理如图所示氧气通入的一极为电源的____ 极,a电极反应式:____ ,b电极反应式:____ 。
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)____ L。
(1)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量,有效地开发利用CO2,工业上可以用CO2来生产甲醇燃料。在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CH3OH和CO2的物质的量随时间变化如图所示。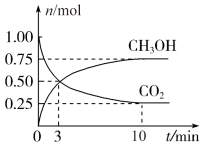
②达到平衡时,H2的浓度为
(2)工业上也可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)
 CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2进行上述反应。下列叙述中能说明上述反应达到平衡状态的是| A.反应中CO与CH3OH的物质的量之比为1:1 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗1 mol CO,同时生成1 mol CH3OH |
| D.CH3OH的质量分数在混合气体中保持不变 |
(4)当电路中累计有2 mol电子通过时,消耗的甲烷体积为(在标准状况下)
您最近一年使用:0次
2022-05-12更新
|
454次组卷
|
3卷引用:福建省福州市闽侯县第一中学2022-2023学年高一下学期5月月考化学试题
名校
3 . “绿水青山就是金山银山”,利用电池原理治理各种污染是科研工作人员致力研究的重要课题之一。

(1)硫化氢是一种具有臭鸡蛋气味的有毒气体,我国最近在太阳能光电催化-化学耦合分解硫化氢的研究中获得新进展,相关装置如图所示。

①电极a极的反应式是_______ ; 发生反应的离子方程式是
发生反应的离子方程式是_______ 。
②图示过程中的能量转化是_______ 。
(2)碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。

①有机电解液不能换为水电解质的原因是_______ 。
②正极电极反应是_______ 。
(3)为了减少对环境的污染,煤直接燃烧前要进行脱硫处理。应用电解法对煤进行脱硫处理具有脱硫效率高、经济效益高等优点。电解脱硫的基本原理是利用电极反应将 转化成
转化成 ,
, 再将煤中的含硫物质(主要是
再将煤中的含硫物质(主要是 )氧化为
)氧化为 和
和 (如图):
(如图):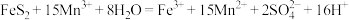
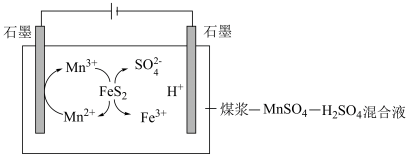
①阳极的电极反应式为_______ 。
②电解刚刚开始时,观察到阴极石墨棒上有无色气体产生,请用化学用语解释产生该现象的原因:_______ 。
③电解过程中,混合溶液中 的物质的量浓度将变大,理由是
的物质的量浓度将变大,理由是_______ 。

(1)硫化氢是一种具有臭鸡蛋气味的有毒气体,我国最近在太阳能光电催化-化学耦合分解硫化氢的研究中获得新进展,相关装置如图所示。

①电极a极的反应式是
 发生反应的离子方程式是
发生反应的离子方程式是②图示过程中的能量转化是
(2)碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。

①有机电解液不能换为水电解质的原因是
②正极电极反应是
(3)为了减少对环境的污染,煤直接燃烧前要进行脱硫处理。应用电解法对煤进行脱硫处理具有脱硫效率高、经济效益高等优点。电解脱硫的基本原理是利用电极反应将
 转化成
转化成 ,
, 再将煤中的含硫物质(主要是
再将煤中的含硫物质(主要是 )氧化为
)氧化为 和
和 (如图):
(如图):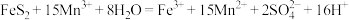

①阳极的电极反应式为
②电解刚刚开始时,观察到阴极石墨棒上有无色气体产生,请用化学用语解释产生该现象的原因:
③电解过程中,混合溶液中
 的物质的量浓度将变大,理由是
的物质的量浓度将变大,理由是
您最近一年使用:0次
2023-10-20更新
|
219次组卷
|
3卷引用:广西河池市八校2023-2024学年高二上学期10月联考化学试题
名校
解题方法
4 . 人类的一切活动都离不开能量,人们不仅利用化学反应获得新物质,也需从化学反应中获得能量。回答下列问题:
Ⅰ、键能是指在1 × 105 Pa、298 K时,将1 mol气态分子分离成气态原子所需要的能量,其单位为kJ·mol−1,已知H—H的键能为436 kJ·mol−1;N≡N的键能为946 kJ·mol−1;N—H的键能为391 kJ·mol−1。
(1)NH3的电子式为___________ 。
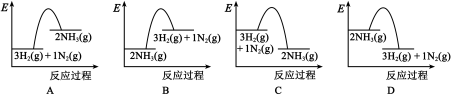
(2)在1 × 105 Pa、298 K时,生成2 mol NH3(g),吸收或放出的热量为Q kJ,则Q =___________ ,能正确表示该过程的能量变化的是___________ (填标号)。
Ⅱ、电化学气敏传感器可用于监测空气中的污染物,空气中NH3的含量监测原理如图所示。
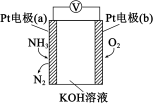
(3)正极为___________ (填“a”或“b”)电极,负极发生的电极反应式为___________ ,原电池总反应方程式为___________ 。
(4)溶液中OH−向电极___________ (填“a”或“b”)移动,电池工作一段时间后,溶液c(OH−)___________ (填“变大”“变小”或“不变”)。
(5)当转移电子数为6.02 × 1023时,被还原的气体的质量为___________ g。
Ⅰ、键能是指在1 × 105 Pa、298 K时,将1 mol气态分子分离成气态原子所需要的能量,其单位为kJ·mol−1,已知H—H的键能为436 kJ·mol−1;N≡N的键能为946 kJ·mol−1;N—H的键能为391 kJ·mol−1。
(1)NH3的电子式为
(2)在1 × 105 Pa、298 K时,生成2 mol NH3(g),吸收或放出的热量为Q kJ,则Q =

Ⅱ、电化学气敏传感器可用于监测空气中的污染物,空气中NH3的含量监测原理如图所示。

(3)正极为
(4)溶液中OH−向电极
(5)当转移电子数为6.02 × 1023时,被还原的气体的质量为
您最近一年使用:0次
2023-04-29更新
|
294次组卷
|
2卷引用:四川省成都市蓉城名校联盟2022-2023学年高一下学期期中联考化学试题
5 . 某小组研究化学反应中的能量变化,进行了如下实验。
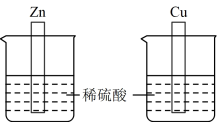
(1)实验 I:将Zn片和Cu片分别插入盛有50mL 2 mol/L稀硫酸的烧杯中。
①Zn片与稀硫酸反应的离子方程式为_________ 。
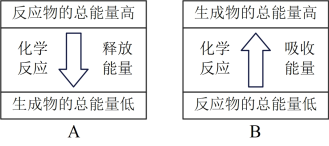
②Zn片与稀硫酸反应的能量变化关系符合如图_________ (填“A”或“B”)。
②结合电子的移动方向,解释Cu片表面产生气泡的原因_________ 。
(3)实验I和Ⅱ产生等量气体时,测得T2>T3。结合能量的转化形式,分析两溶液温度变化幅度不同 的原因 _________ 。
(4)根据实验Ⅱ,判断下列说法不正确 的是_________ 。
①在锌电极上也可观察到气泡产生
②电子可由锌电极经溶液流向铜电极
③溶液中的SO 向铜电极移动
向铜电极移动
(5)将Zn片和Cu片换成Fe片和石墨棒,重复实验Ⅱ,判断电流表指针是否发生偏转。若不偏转,说明理由;若偏转,写出Fe片表面发生的电极反应式。理由或电极反应式是_________ 。
(1)实验 I:将Zn片和Cu片分别插入盛有50mL 2 mol/L稀硫酸的烧杯中。
①Zn片与稀硫酸反应的离子方程式为
②Zn片与稀硫酸反应的能量变化关系符合如图

②结合电子的移动方向,解释Cu片表面产生气泡的原因
(3)实验I和Ⅱ产生等量气体时,测得T2>T3。结合能量的转化形式,分析两溶液温度变化幅度
(4)根据实验Ⅱ,判断下列说法
①在锌电极上也可观察到气泡产生
②电子可由锌电极经溶液流向铜电极
③溶液中的SO
 向铜电极移动
向铜电极移动(5)将Zn片和Cu片换成Fe片和石墨棒,重复实验Ⅱ,判断电流表指针是否发生偏转。若不偏转,说明理由;若偏转,写出Fe片表面发生的电极反应式。理由或电极反应式是
您最近一年使用:0次
2023-04-26更新
|
216次组卷
|
3卷引用:北京市丰台区2022-2023学年高一下学期期中练习化学试题
北京市丰台区2022-2023学年高一下学期期中练习化学试题辽宁省鞍山市普通高中2022-2023学年高一下学期期末考试化学试题(已下线)重难点03 原电池的工作原理与相关判断-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
6 . 实验室探究NaHSO3溶液与Cu2+的反应。
I.如图所示制备(经检验装置气密性良好)。
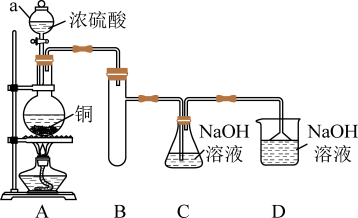
(1)仪器a的名称是___________ ,装置D的作用为___________ 。
(2)写出C中制备NaHSO3的离子方程式___________ 。
Ⅱ.探究NaHSO3溶液与Cu2+的反应,过程如图所示:
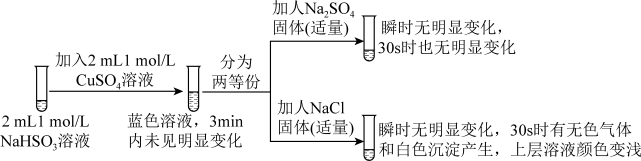
已知:硫酸亚铜易溶于水。回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因:
a.Cl-改变了 的还原性 b.Cl-改变了Cu2+的氧化性
的还原性 b.Cl-改变了Cu2+的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
①由实验1、2可知原因a不合理,依据是___________ 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
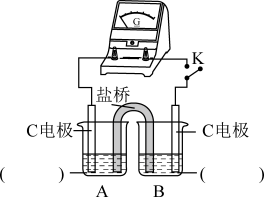
i.补全电化学装置示意图A________________ 、B_____________________ 。
ii.写出B中的电极反应方程式___________ 。
iii.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,___________ ,使 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
I.如图所示制备(经检验装置气密性良好)。

(1)仪器a的名称是
(2)写出C中制备NaHSO3的离子方程式
Ⅱ.探究NaHSO3溶液与Cu2+的反应,过程如图所示:

已知:硫酸亚铜易溶于水。回答下列问题:
(3)加入NaCl固体后产生的无色气体和白色沉淀经检验分别是SO2和CuCl,说明发生了氧化还原反应。加入NaCl固体发生反应的原因:
a.Cl-改变了
 的还原性 b.Cl-改变了Cu2+的氧化性
的还原性 b.Cl-改变了Cu2+的氧化性用原电池原理进行试验,探究上述现象可能的原因。
| 编号 | 实验1 | 实验2 |
| 实验 | 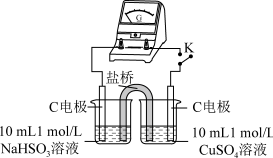 |  |
| 现象 | 闭合开关K,电流计指针发生微小偏 转,烧杯中未见明显现象 | 闭合开关K,电流计指针发生微小偏 转,烧杯中未见明显现象 |
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。

i.补全电化学装置示意图A
ii.写出B中的电极反应方程式
iii.请从反应原理的角度解释原因:Cl-与Cu2+的还原产物Cu+形成沉淀,
 与Cu2+的反应能够反应完全。
与Cu2+的反应能够反应完全。
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.在25℃、101kPa的条件下,已知部分化学键的断裂涉及能量变化如下图所示,请回答下列有关问题:

(1)对于反应 ,经实验测得每生成
,经实验测得每生成
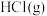 时,反应过程中放出
时,反应过程中放出 的热量,则断开
的热量,则断开
 键所需的能量是
键所需的能量是___________ kJ。
(2)有两个反应:a. ,b.
,b. 。这两个反应中,相同物质的量的
。这两个反应中,相同物质的量的 、
、 反应生成相同质量的
反应生成相同质量的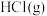 时,放出的能量
时,放出的能量___________ (填“相等”或“不相等”)。
(3)据下图能量转化关系,生成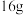

___________ (填“吸收”或“放出”)的能量___________ (填“>”、“=”或“<”) 。
。
Ⅱ.下图为原电池装置示意图,设 为阿伏加德罗常数:
为阿伏加德罗常数:

(4)若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式___________ ,反应过程中溶液的酸性___________ (填“变大”“变小”或“不变”)。一段时间后,当在电池中放出3.36L(标准状况)气体时,电路中有___________ 个电子通过了导线。
(5)若电池的总反应为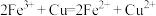 ,负极材料是
,负极材料是___________ (填名称),负极的电极反应式为___________ 。
(6)若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为___________ 极(填“正”或“负”)。

(1)对于反应
 ,经实验测得每生成
,经实验测得每生成
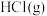 时,反应过程中放出
时,反应过程中放出 的热量,则断开
的热量,则断开
 键所需的能量是
键所需的能量是(2)有两个反应:a.
 ,b.
,b. 。这两个反应中,相同物质的量的
。这两个反应中,相同物质的量的 、
、 反应生成相同质量的
反应生成相同质量的 时,放出的能量
时,放出的能量(3)据下图能量转化关系,生成

 。
。
Ⅱ.下图为原电池装置示意图,设
 为阿伏加德罗常数:
为阿伏加德罗常数:
(4)若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式
(5)若电池的总反应为
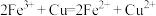 ,负极材料是
,负极材料是(6)若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
8 . 我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
(1)Li-CO2电池中,Li为单质锂片,则该电池中的CO2在_______ (填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式
Ⅰ.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ._______
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_______ 。
(1)Li-CO2电池中,Li为单质锂片,则该电池中的CO2在
Ⅰ.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
您最近一年使用:0次
9 .  一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
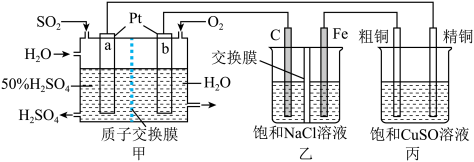
(1)a极的电极反应式为___________ ;Fe电极为___________ 极,其电极反应式为___________ 。
(2)甲装置每消耗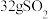 ,溶液中通过质子交换膜的
,溶液中通过质子交换膜的 为
为___________ mol,如果粗铜中含有锌、银等杂质,丙装置中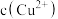
___________ (填“增大”“减小”或“不变”)。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(电极未标出)。
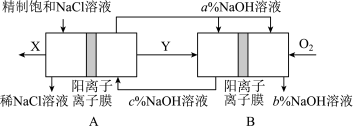
装置A发生反应的化学方程式为___________ ;图中X的化学式为___________ ;NaOH溶液的质量分数为a%、b%、c%,由大到小的顺序为___________ 。
 一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
(1)a极的电极反应式为
(2)甲装置每消耗
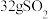 ,溶液中通过质子交换膜的
,溶液中通过质子交换膜的 为
为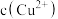
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(电极未标出)。

装置A发生反应的化学方程式为
您最近一年使用:0次
名校
10 . 应用电化学原理,回答下列问题。
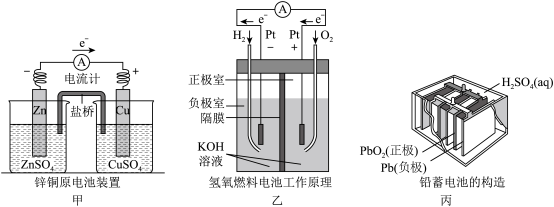
(1)上述三个装置中,负极反应物在化学性质上的共同特点是_____ 。
(2)电池装置中,盐桥中盛装浸有高浓度电解质溶液的琼脂,要求该电解质溶液中阴、阳离子扩散速率相近,即电迁移率(u∞)尽可能相接近。已知K+、Cl-、NO 的电迁移率(u∞×108/m2•s-1•V-1)分别为7.62、7.91、7.40,但是本实验盐桥中的电解质选择KCl而不选KNO3的可能原因是
的电迁移率(u∞×108/m2•s-1•V-1)分别为7.62、7.91、7.40,但是本实验盐桥中的电解质选择KCl而不选KNO3的可能原因是_____ 。甲中电流计指针偏移时,盐桥中离子移动的方向是______ 。
(3)乙中正极反应式为______ ,当消耗氢气的体积为22.4L(标准状况下)时,理论上导线中转移电子的物质的量为_____ 。若将H2换成CH4,则负极反应式为______ 。
(4)丙中铅蓄电池放电一段时间后,电解质溶液的pH值会_____ (填“升高”或“降低”或“不变”)。进行充电时,要将外接电源的负极与铅蓄电池的______ 极相连接(填“正”或“负”)。

(1)上述三个装置中,负极反应物在化学性质上的共同特点是
(2)电池装置中,盐桥中盛装浸有高浓度电解质溶液的琼脂,要求该电解质溶液中阴、阳离子扩散速率相近,即电迁移率(u∞)尽可能相接近。已知K+、Cl-、NO
 的电迁移率(u∞×108/m2•s-1•V-1)分别为7.62、7.91、7.40,但是本实验盐桥中的电解质选择KCl而不选KNO3的可能原因是
的电迁移率(u∞×108/m2•s-1•V-1)分别为7.62、7.91、7.40,但是本实验盐桥中的电解质选择KCl而不选KNO3的可能原因是(3)乙中正极反应式为
(4)丙中铅蓄电池放电一段时间后,电解质溶液的pH值会
您最近一年使用:0次



