解题方法
1 . 到目前为止,由化学能转变的热能或电能仍然是人类使用的主要能源。
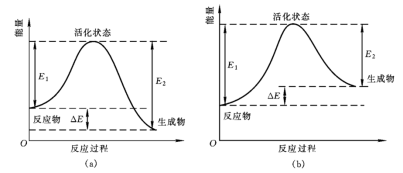
(1)从能量变化角度研究反应: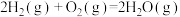 。下图能正确表示该反应中能量变化的是
。下图能正确表示该反应中能量变化的是___________ (填字母)。
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:
则生成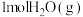 放出热量
放出热量___________ kJ。
(3)肼-空气燃料电池的电解质溶液是20%~30%的KOH溶液,反应方程式是:N2H4+O2=N2+2H2O,该燃料电池的负极电极反应式是___________ 。
(4)用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一、Fe还原水体中
)已成为环境修复研究的热点之一、Fe还原水体中 的反应原理如图所示。
的反应原理如图所示。
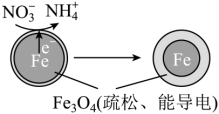
①作负极的物质是___________ 。
②正极的电极反应式是___________ 。
(1)从能量变化角度研究反应:
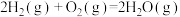 。下图能正确表示该反应中能量变化的是
。下图能正确表示该反应中能量变化的是
(2)从断键和成键角度分析上述反应中能量的变化。部分化学键的键能如下表:
| 化学键 |  |  |  |
| 键能(kJ/mol) | 436 | 496 | 463 |
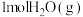 放出热量
放出热量(3)肼-空气燃料电池的电解质溶液是20%~30%的KOH溶液,反应方程式是:N2H4+O2=N2+2H2O,该燃料电池的负极电极反应式是
(4)用零价铁(Fe)去除水体中的硝酸盐(
 )已成为环境修复研究的热点之一、Fe还原水体中
)已成为环境修复研究的热点之一、Fe还原水体中 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质是
②正极的电极反应式是
您最近一年使用:0次
名校
解题方法
2 . 化学变化过程中均存在物质变化与能量变化,某化学兴趣小组进行如图所示实验,以验证此结论。
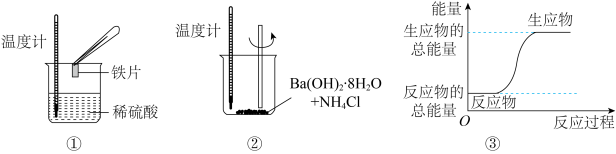
请回答下列问题:
(1)将①中涉及的反应设计成如图所示的原电池,则溶液中的SO 移向
移向_____ (填“正”或“负”)极,电极材料X不能是_____ (填序号)。

A.Cu B.Zn C.Pb D.石墨
(2)进行实验②时,温度计中水银液面变化_____ (填“升高”或“降低”)。
(3)下列化学反应中的能量变化关系与③相符合的是_____ (填序)。
(4)在300℃时,X、Y、Z三种气体在恒容密闭容器中反应时的浓度变化如图所示:

请回答下列问题:
①该反应的化学方程式为_____ 。
②下列事实能表明300℃时该反应处于平衡状态的是_____ (填序号)。
A.v(X):v(Y):v(Z)=2:2:1 B.X(g)的物质的量浓度不变
C.混合气体的质量不变 D.混合气体的密度不变

请回答下列问题:
(1)将①中涉及的反应设计成如图所示的原电池,则溶液中的SO
 移向
移向
A.Cu B.Zn C.Pb D.石墨
(2)进行实验②时,温度计中水银液面变化
(3)下列化学反应中的能量变化关系与③相符合的是
| A.生石灰溶于水 | B.盐酸与碳酸氢钠反应 |
| C.甲烷在空气中燃烧 | D.灼热的木炭与CO2反应 |

请回答下列问题:
①该反应的化学方程式为
②下列事实能表明300℃时该反应处于平衡状态的是
A.v(X):v(Y):v(Z)=2:2:1 B.X(g)的物质的量浓度不变
C.混合气体的质量不变 D.混合气体的密度不变
您最近一年使用:0次
解题方法
3 . 为了保护“青山绿水”,临夏大力加快清洁能源生产项目,增大天然气使用覆盖率。
(1)甲烷充分燃烧的化学方程式为_______ ,反应过程中,化学键断裂_______ (填“吸收”或“放出”)的总能量_______ (填“>”“<”或“=”)化学键形成_______ (填“吸收”或“放出”)的总能量。
(2)燃料电池是一种将燃料和氧化剂的化学能直接转化为电能的电化学反应装置,在航天、军事和交通等领域有广泛的应用前景。甲烷燃料电池的工作原理如图所示,电解质溶液为稀硫酸,质子交换膜仅允许 通过。
通过。_______ (填“a”或“b”),负极发生_______ (填“氧化”或“还原”)反应。
②正极反应式是_______ , 通过质子交换膜向
通过质子交换膜向_______ (填“左”或“右”)移动。
③a极消耗标准状况下4.48 L ,在外电路有
,在外电路有_______ mol电子转移。
(1)甲烷充分燃烧的化学方程式为
(2)燃料电池是一种将燃料和氧化剂的化学能直接转化为电能的电化学反应装置,在航天、军事和交通等领域有广泛的应用前景。甲烷燃料电池的工作原理如图所示,电解质溶液为稀硫酸,质子交换膜仅允许
 通过。
通过。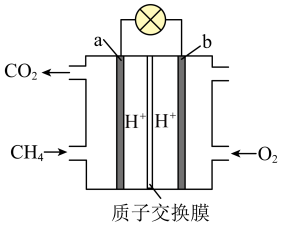
②正极反应式是
 通过质子交换膜向
通过质子交换膜向③a极消耗标准状况下4.48 L
 ,在外电路有
,在外电路有
您最近一年使用:0次
名校
4 . 化学电池的发明,是贮能和供能技术的巨大进步。
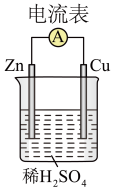
(1)如图所示装置中,Cu 片是_____ (填“正极”或“负极”)。
(2)写出负极发生的电极反应式_____ 。
(3)电子流动的方向是_____ 。
(4)如图所示装置可将_____ (写化学方程式)反应释放的能量 直接转变为电能;能证明产生电能的实验现象是_____ 。
(5)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。
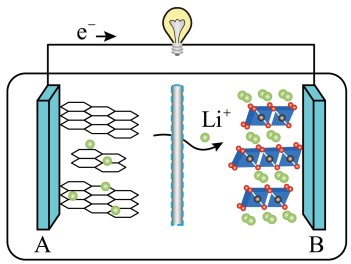
下列说法正确的是_____ (填序号)。
① A 为电池的正极
② 该装置实现了化学能转化为电能
③ 电池工作时,电池内部的锂离子定向移动

(1)如图所示装置中,Cu 片是
(2)写出负极发生的电极反应式
(3)电子流动的方向是
(4)如图所示装置可将
(5)2019 年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如下。

下列说法正确的是
① A 为电池的正极
② 该装置实现了化学能转化为电能
③ 电池工作时,电池内部的锂离子定向移动
您最近一年使用:0次
2020-05-02更新
|
1119次组卷
|
3卷引用:河北省衡水市武强中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
5 . Ⅰ.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 表示。能量请认真观察下图,回答下列问题。
表示。能量请认真观察下图,回答下列问题。
(1)下列变化中满足如图图示的是___________ (填选项字母);
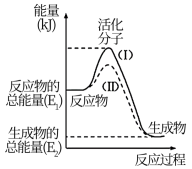
A.镁和稀盐酸的反应B. 与
与 的反应
的反应
C.NaOH固体加入水中D.乙醇燃烧
Ⅱ.人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___________ (填选项字母);
A.铝片、铜片B.铜片、铝片C.铝片、铝片
(3) 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生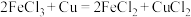 ,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为
,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为___________ g;
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的正极反应化学方程式是:___________ ,
②电池工作一段时间后硫酸溶液的pH___________ (填“增大”“减小”或“不变”)
(5)T℃时,在0.5L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。
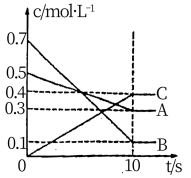
①该反应的化学方程式为___________ ,
②10s内用B表示的反应速率为___________ 。
 表示。能量请认真观察下图,回答下列问题。
表示。能量请认真观察下图,回答下列问题。(1)下列变化中满足如图图示的是

A.镁和稀盐酸的反应B.
 与
与 的反应
的反应C.NaOH固体加入水中D.乙醇燃烧
Ⅱ.人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(2)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铜片B.铜片、铝片C.铝片、铝片
(3)
 溶液常用于腐蚀印刷电路铜板,发生
溶液常用于腐蚀印刷电路铜板,发生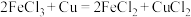 ,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为
,若将此反应设计成原电池,当线路中转移0.2mol电子时,则被腐蚀铜的质量为(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的正极反应化学方程式是:
②电池工作一段时间后硫酸溶液的pH
(5)T℃时,在0.5L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。

①该反应的化学方程式为
②10s内用B表示的反应速率为
您最近一年使用:0次
2021-07-22更新
|
769次组卷
|
2卷引用:广东省汕尾市城区汕尾中学2022-2023学年高二下学期4月期中考试化学试题
解题方法
6 . Ⅰ.研原电池是化学对人类的一项重大贡献。
(1)如图是甲烷燃料电池原理示意图,回答下列问题:
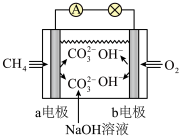
①电池的负极是_______ (填“a”或“b”)电极,该极的电极反应式为_______
②电池工作一段时间后电解质溶液的pH_______ (填 “增大”、“减小”或“不变”)。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池。请完成有关的电池反应式:
负极反应式:2CO+2 —4e—=4CO2;
—4e—=4CO2;
正极反应式:_______ ,总电池反应式:_______
Ⅱ.“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
(3)飞船在光照区运行时,太阳能电池帆板将太阳能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为Cd+2NiO(OH)+2H2O Cd(OH)2 +2Ni(OH)2;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性
Cd(OH)2 +2Ni(OH)2;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性 _______ (填“增大”“减小”或“不变”)。
(4)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O 2Ag+ Zn(OH)2,负极的电极反应式为
2Ag+ Zn(OH)2,负极的电极反应式为_______ 。
(1)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是
②电池工作一段时间后电解质溶液的pH
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池。请完成有关的电池反应式:
负极反应式:2CO+2
 —4e—=4CO2;
—4e—=4CO2;正极反应式:
Ⅱ.“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
(3)飞船在光照区运行时,太阳能电池帆板将太阳能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为Cd+2NiO(OH)+2H2O
 Cd(OH)2 +2Ni(OH)2;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性
Cd(OH)2 +2Ni(OH)2;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性 (4)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O
 2Ag+ Zn(OH)2,负极的电极反应式为
2Ag+ Zn(OH)2,负极的电极反应式为
您最近一年使用:0次
名校
解题方法
7 . I.下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。
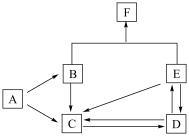
据此,请回答下列问题:
(1)写出以下物质的化学式:A_______ ,D_______ ,F_______ 。
(2)写出下列变化的化学方程式:
BC_______
EC_______
II.氢燃料电池车是北京冬奥会期间的交通服务用车,酸性氢氧燃料电池的构造如图所示。
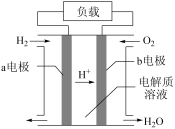
(3)若该电池中的电解质溶液是稀硫酸溶液,则a电极上发生反应的电极反应式为_______ 。
(4)b电极是该电池的_______ 极(填“正”或“负”),从氧化还原反应的角度分析,该电极发生的反应属于_______ 反应。
(5)当转移0.2mol电子时,需要消耗标况下的氢气体积是_______ L。

据此,请回答下列问题:
(1)写出以下物质的化学式:A
(2)写出下列变化的化学方程式:
BC
EC
II.氢燃料电池车是北京冬奥会期间的交通服务用车,酸性氢氧燃料电池的构造如图所示。

(3)若该电池中的电解质溶液是稀硫酸溶液,则a电极上发生反应的电极反应式为
(4)b电极是该电池的
(5)当转移0.2mol电子时,需要消耗标况下的氢气体积是
您最近一年使用:0次
名校
8 . 按要求回答问题:
(1)由SiO2制备高纯度硅的工业流程如图所示:
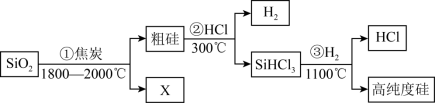
①写出SiO2转化为Si(粗)的化学方程式:____________________________________________ 。
②可以循环使用的物质为_________________________ 。
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
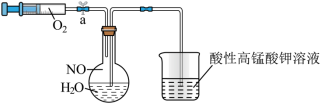
①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是____________ ,产生此现象的化学方程式为______________________________________________ 。
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式________________________________ 。
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向________ 极移动(填“正”或“负”)。
②若有 1 mol e- 流过导线,则理论上负极质量减少________ g。
③若将稀硫酸换成浓硝酸,正极电极方程式为:______________________ 。
(1)由SiO2制备高纯度硅的工业流程如图所示:

①写出SiO2转化为Si(粗)的化学方程式:
②可以循环使用的物质为
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。

①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向
②若有 1 mol e- 流过导线,则理论上负极质量减少
③若将稀硫酸换成浓硝酸,正极电极方程式为:
您最近一年使用:0次
2023-05-18更新
|
326次组卷
|
2卷引用:陕西延安中学2022-2023学年高一下学期期中考试化学试题
名校
9 . 某化学兴趣小组为了探索Zn电极在原电池中的作用,设计并进行了以下一系列实验。
已知:Zn与Al的化学性质基本相似, 。
。
回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为___________ 。
②每转移0.1 mol电子,此时负极材料减少的质量为___________ g。
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,Mg、Zn、Cu三种金属活动性由强到弱的顺序为___________ 。
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将___________ (填“变大”、“变小”或“不变”)。
②石墨电极上发生___________ (填“氧化”或“还原”)反应。
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为___________ 。
②外电路中电子的流动方向为___________ 。
(5)根据实验1、实验2、实验3、实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素为___________ 。
已知:Zn与Al的化学性质基本相似,
 。
。回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为
②每转移0.1 mol电子,此时负极材料减少的质量为
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,Mg、Zn、Cu三种金属活动性由强到弱的顺序为
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将
②石墨电极上发生
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为
②外电路中电子的流动方向为
(5)根据实验1、实验2、实验3、实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素为
您最近一年使用:0次
2023-04-18更新
|
360次组卷
|
7卷引用:河北省2022-2023学年高一下学期期中考试化学试题
23-24高一上·全国·假期作业
解题方法
10 . I.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
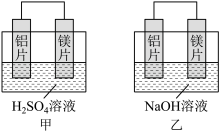
(1)写出甲中正极的电极反应式:_______
(2)乙中负极为_______ , 总反应的离子方程式:_______
(3)由此实验得出的下列结论中,正确的有_______
II.利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
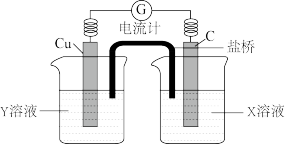
(4)写出电极反应式:正极_______ ;负极_______ 。
(5)图中X溶液是_______ ,Y溶液是_______ 。

(1)写出甲中正极的电极反应式:
(2)乙中负极为
(3)由此实验得出的下列结论中,正确的有_______
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
II.利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

(4)写出电极反应式:正极
(5)图中X溶液是
您最近一年使用:0次



