名校
解题方法
1 . 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。下列说法正确的是
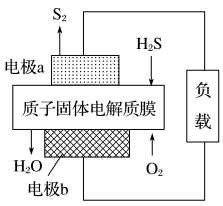

| A.电极a为电池的正极 |
| B.电极b上发生的电极反应为:O2+4H++4e-=2H2O |
| C.电路中每通过2mol电子,在正极消耗22.4LH2S |
| D.每17g H2S参与反应,有1 mol H+经质子膜进入正极区 |
您最近一年使用:0次
解题方法
2 . 下列说法中正确的是( )
| A.原电池是把化学能转变为电能的装置 |
| B.原电池中电子流出的一极是正极,发生氧化反应 |
| C.原电池的两极发生的反应均为氧化还原反应 |
| D.形成原电池后,原电池中的阳离子向负极方向移动 |
您最近一年使用:0次
名校
解题方法
3 . 用甲醇燃料电池做电源,用铁做电极电解含Cr2O 的酸性废水,最终可将Cr2O
的酸性废水,最终可将Cr2O 转化成Cr(OH)3沉淀而除去,装置如图。下列说法不正确的是( )
转化成Cr(OH)3沉淀而除去,装置如图。下列说法不正确的是( )

 的酸性废水,最终可将Cr2O
的酸性废水,最终可将Cr2O 转化成Cr(OH)3沉淀而除去,装置如图。下列说法不正确的是( )
转化成Cr(OH)3沉淀而除去,装置如图。下列说法不正确的是( )
| A.Fe(Ⅱ)为阴极 |
| B.电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出 |
C.M电极的电极反应式为:CH3OH+8OH--6e-=CO +6H2O +6H2O |
D.电路中每转移6mol电子,最多有1molCr2O 被还原 被还原 |
您最近一年使用:0次
2020-09-29更新
|
401次组卷
|
3卷引用:山东省德州市夏津第一中学2021届高三上学期9月月考化学试题
名校
解题方法
4 . 固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
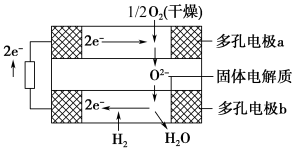

| A.有O2参加反应的a极为电池的负极 |
| B.b极的电极反应式为H2-2e-= 2H+ |
| C.a极对应的电极反应式为O2+2H2O+4e-= 4OH- |
| D.该电池的总反应式为2H2+O2= 2H2O |
您最近一年使用:0次
2020-09-28更新
|
174次组卷
|
2卷引用:山东省滕州市第一中学2020-2021学年高二一部9月小测试化学试题
名校
解题方法
5 . 通过膜电池可除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是
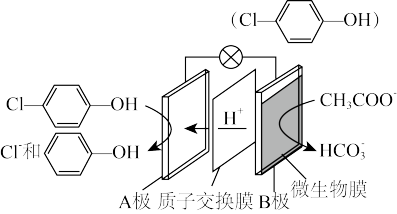

| A.B 极为电池的正极,发生还原反应 |
| B.电流方向从 B 极沿导线经小灯泡流向 A 极 |
C.A 极的电极反应式为 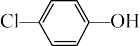 +e-=Cl-+ +e-=Cl-+ |
| D.当外电路中有0.2mole-转移时,A极区增加的H+的数目为0.1NA |
您最近一年使用:0次
2020-09-23更新
|
138次组卷
|
5卷引用:山东省济南市长清第一中学2019届高三12月月考理科综合-化学试题
9-10高一下·山东聊城·期末
解题方法
6 . 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液: 溶液、
溶液、 溶液、稀硫酸。按要求回答下列问题:
溶液、稀硫酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因:________________ 。
(2)若电极材料选铜和石墨,电解质溶液选 溶液,外加导线,能否构成原电池?
溶液,外加导线,能否构成原电池?______ 。若能,请写出电极反应式,负极:__________________ ,正极:_________________ (若不能,后两空不填)。
(3)设计一种以铁和稀硫酸反应为原理的原电池,在下面的方框中画出装置图__________ (需标明电极材料及电池的正负极)。

 溶液、
溶液、 溶液、稀硫酸。按要求回答下列问题:
溶液、稀硫酸。按要求回答下列问题:(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因:
(2)若电极材料选铜和石墨,电解质溶液选
 溶液,外加导线,能否构成原电池?
溶液,外加导线,能否构成原电池?(3)设计一种以铁和稀硫酸反应为原理的原电池,在下面的方框中画出装置图

您最近一年使用:0次
2020-09-19更新
|
316次组卷
|
4卷引用:2010年山东省聊城二中高一第二学期期末考试化学试题
(已下线)2010年山东省聊城二中高一第二学期期末考试化学试题(已下线)2012-2013学年甘肃省武威市第六中学高一下学期期中测试化学试卷鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第2节 化学能转化为电能——电池人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 方法帮
7 . 1905年哈珀开发实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈珀也因此获得了1918年的诺贝尔化学奖。
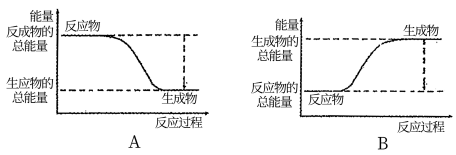
(1)工业合成氨的反应如下:N2+3H2 2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成1 mol NH3的能量变化为
2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成1 mol NH3的能量变化为________ kJ。下图能正确表示该反应中能量变化的是________ (填“A”或“B”)。
(2)反应2NH3(g) N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上述数据回答:对比实验①②中,有一个实验没有使用催化剂,它是实验_________ (填序号);实验①③对比说明了_________ 。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_________ (填序号)。
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.c(NH3)=c(H2) d.混合气体的压强不变
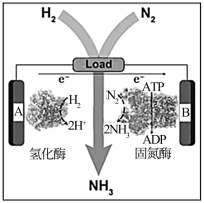
(3)近日美国犹他大学Minteer教授成功构筑了H2-N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则B电极为_________ 极(填“正”、“负”),该电池放电时溶液中的H+向_________ 极移动(填“A”、“B”)。
(1)工业合成氨的反应如下:N2+3H2
 2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成1 mol NH3的能量变化为
2NH3。已知断裂1 mol N2中的共价键吸收的能量为946 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2和H2生成1 mol NH3的能量变化为
(2)反应2NH3(g)
 N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2(g)+3H2(g)在三种不同条件下进行,N2、H2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。实验 序号 | 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据回答:对比实验①②中,有一个实验没有使用催化剂,它是实验
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.c(NH3)=c(H2) d.混合气体的压强不变
(3)近日美国犹他大学Minteer教授成功构筑了H2-N2生物燃料电池。该电池类似燃料电池原理,以氮气和氢气为原料、氢化酶和固氮酶为两极催化剂、质子交换膜(能够传递H+)为隔膜,在室温条件下即实现了氨的合成同时还能提供电能。则B电极为

您最近一年使用:0次
名校
解题方法
8 . 某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光。下列有关该电池的说法正确的是( )


| A.电池工作时电能直接转化为化学能 |
| B.锌片为电池的负极 |
| C.外电路中电子由铜片经导线流向锌片 |
| D.铜片上的电极反应:Cu2++2e-=Cu |
您最近一年使用:0次
2020-09-11更新
|
212次组卷
|
11卷引用:山东省新泰二中2018-2019学年高一下学期第一次月考化学试题
山东省新泰二中2018-2019学年高一下学期第一次月考化学试题2014-2015江苏省南通中学高二上学期期末化学试卷河北省保定市唐县第一中学2018-2019学年高一下学期期中考试化学试题课时2 原电池的原理及应用——A学习区 夯实基础(鲁科版(2019)第二册)课时1 利用化学反应制备物质——A学习区 夯实基础(鲁科版必修2)课时1 化学能转化为电能——A学习区 夯实基础(苏教版必修2)江苏省清江中学2019-2020学年高一下学期期中考试化学试题陕西省西安市临潼区2021-2022学年高一下学期期末质量检测化学试题内蒙古自治区2021-2022学年普通高中学业水平考试(高二会考)化学真题甘肃省定西市临洮中学2022-2023学年高一下学期3月第一次月考化学试题湖南省株洲市炎陵县2022-2023学年高一下学期4月期中素质检测化学试题
名校
解题方法
9 . 某小组为研究原电池原理,设计如图装置。下列叙述不正确 的是
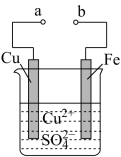
| A.a和b不连接时,铁片上会有金属铜析出 |
B.a和b用导线连接时,铜片上发生的反应为: |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b用导线连接时,电子由铜片通过导线流向铁片,溶液中的Cu2+得电子 |
您最近一年使用:0次
2020-09-08更新
|
278次组卷
|
4卷引用:广东省广州市越秀区省实越秀学校2019-2020学年高一下学期期末考试化学考试题
名校
解题方法
10 . 熔融盐燃料电池是未来最有前景的发电系统之一。用 Li2CO3 和K2CO3 的熔融盐混合物作电解质,一极通H2,另一极通O2和 CO2 混合气体,可制得在 873- 973K 工作的燃料电池。 已知该电池总反应为:2H2 + O2 = 2 H2O。 则下列说法不正确的是
| A.通O2 和 CO2的一极是电池的正极 |
| B.该电池工作过程中需不断补充H2和O2,CO2可循环利用 |
C.正极反应式为:O2 +2CO2+4e-=2CO |
| D.负极反应式为:H2 -2 e- =2 H+ |
您最近一年使用:0次



