名校
解题方法
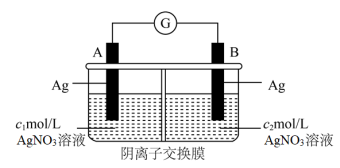
1 . 成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”。当电解质中某离子的浓度越大时其氧化性或还原性越强。如图将两个银电极插入不同浓度的 溶液中
溶液中 ,实验开始观察到灵敏电流计的指针偏转,下列说法正确的是
,实验开始观察到灵敏电流计的指针偏转,下列说法正确的是
 溶液中
溶液中 ,实验开始观察到灵敏电流计的指针偏转,下列说法正确的是
,实验开始观察到灵敏电流计的指针偏转,下列说法正确的是
A.B极电极反应为: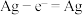 |
B. 穿过交换膜由A极区移向B极区 穿过交换膜由A极区移向B极区 |
| C.电流计指针偏转幅度始终不变 |
D.A极发生氧化反应,A极区 溶液浓度不断增大 溶液浓度不断增大 |
您最近一年使用:0次
解题方法
2 . 能源、资源问题是当前人类社会面临的一项重大课题。直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。燃料电池将能量转化效率比直接燃烧效率高,H2、CH4、CH3OH都是重要的能源物质。
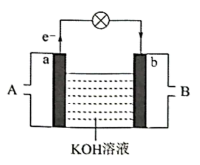
(1)其中氢氧燃料电池是常见的燃料电池,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
①使用时,空气从_____ 口通入(填“A”或“B”);负极是_____ (填“a”或“b”)。电流由_____ 流向_____ (填“a”或“b”)。其总反应方程式为_____ ,在碱性条件下,负极反应式为_____ 。
②假设使用的“燃料”是甲烷(酸性条件下),a极的电极反应为:_____ 。
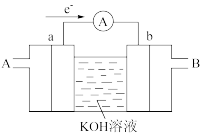
(2)某同学设计如图的原电池,负极实验现象为_____ ,则正极的电极反应式为:_____ ,当导线中有3.01×1023个电子流过,溶液质量变化为_____ g。

(3)能把硫酸铜溶液改成氢氧化钠溶液吗_____ (填“能”或“不能”),为什么_____ 。
(1)其中氢氧燃料电池是常见的燃料电池,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从
②假设使用的“燃料”是甲烷(酸性条件下),a极的电极反应为:
(2)某同学设计如图的原电池,负极实验现象为

(3)能把硫酸铜溶液改成氢氧化钠溶液吗
您最近一年使用:0次
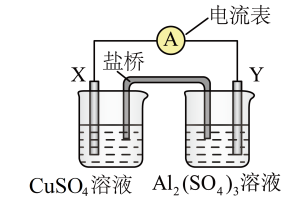
3 . 某同学控制适当条件,将反应Ag+Fe3+⇌Ag++Fe2+设计成如图所示的原电池装置(已知电流表指针偏向与电子的流向相同,盐桥中装有含有硝酸钾的琼胶)。下列有关判断不正确的是
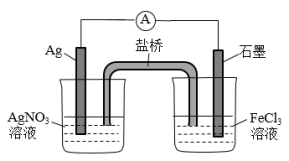

| A.若电流表指针向左转,则盐桥中的K+向右烧杯中移动 |
| B.若电流表指针归零时,则反应达到平衡状态 |
| C.若电流表指针向右偏转,则银电极发生氧化反应 |
| D.上述实验能说明其他条件不变时Ag+与Fe3+的氧化性强弱与其离子浓度有关 |
您最近一年使用:0次
名校
解题方法
4 . 氮的化合物在工业中应用十分广泛。
(1)工业上尿素【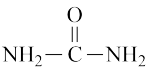 】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=
】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=___
(2)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。
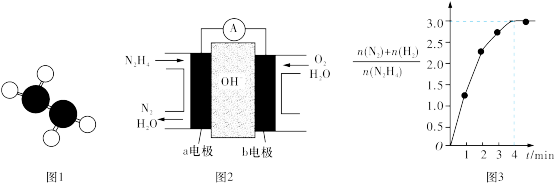
①已知肼的球棍模型如图1所示,试写出肼的电子式:_______ 。
②目前正在研发的一种肼燃料电池的结构如图2所示,_____ (填“a”或“b”)电极为电池的负极。
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应
N2H4(l)⇌N2(g)+2H2(g),测得容器中的[n(N2)+n(H2)]/n(N2H4)与时间的关系如图3所示,则0~4 min内氮气的平均反应速率v(N2)=________ 。
(1)工业上尿素【
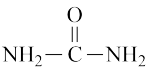 】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=
】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=化学键 | 键能(KJ·mol-1) |
C=O | 728 |
C—N | 305 |
N—H | 389 |
O—H | 464 |
(2)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。

①已知肼的球棍模型如图1所示,试写出肼的电子式:
②目前正在研发的一种肼燃料电池的结构如图2所示,
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应
N2H4(l)⇌N2(g)+2H2(g),测得容器中的[n(N2)+n(H2)]/n(N2H4)与时间的关系如图3所示,则0~4 min内氮气的平均反应速率v(N2)=
您最近一年使用:0次
名校
解题方法
5 . 在第十三届阿布扎比国际防务展上,采用先进的氢氧燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录。下列有关氢氧燃料电池的说法正确的是
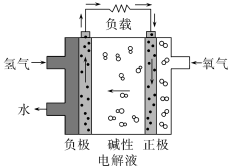

| A.通入氧气的电极发生氧化反应 |
| B.碱性电解液中阳离子向通入氢气的方向移动 |
C.正极的电极反应式为: |
D.该电池工作时,每消耗22.4L 转移4mol电子 转移4mol电子 |
您最近一年使用:0次
2021-07-31更新
|
475次组卷
|
3卷引用:重庆市清华中学2020-2021学年高一下学期第一次月考化学试题
名校
6 . 化学反应与生产研究息息相关,我们不仅关注能量变化,还需要关注化学反应的快慢和程度。请根据要求,回答下列问题:
(1)下面是四个化学反应理论上不可以用于设计原电池的化学反应是_______ (填字母,下同)
A.
B.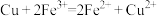
C.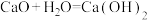
D.
(2)将氢气与氧气的反应设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中_______ (填A或B)处电极入口通氧气,其电极反应式为_______ 。当消耗标准状况下氢气11.2L时,假设能量转化率为85%,则导线中转移电子的物质的量为_______  。
。
(3)某温度时,在2L容器中发生X、Y两种物质间的转化反应,X、Y物质的量随时间变化的曲线如图所示:

①该反应的化学方程式为_______ 。
②反应开始至2min时,Y的平均反应速率为_______ 。
③2min时,v正_______ (填“>”“<”或“=”)v逆。
(1)下面是四个化学反应理论上不可以用于设计原电池的化学反应是
A.

B.
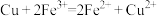
C.
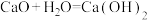
D.

(2)将氢气与氧气的反应设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中
 。
。
(3)某温度时,在2L容器中发生X、Y两种物质间的转化反应,X、Y物质的量随时间变化的曲线如图所示:

①该反应的化学方程式为
②反应开始至2min时,Y的平均反应速率为
③2min时,v正
您最近一年使用:0次
2021-07-05更新
|
921次组卷
|
4卷引用:湖北省黄冈市2020-2021学年高一下学期期末调研考试化学试题
解题方法
7 . 铝作为一种应用广泛的金属,在电化学领域也发挥着举足轻重的作用。回答下列问题:
(1)某同学根据氧化还原反应:2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s),设计如图所示的原电池。
①两个电极一个是铜,一个是铝,电极X的化学式为_______ 。
②盐桥中的阴离子向_______ (填化学式)溶液中移动。
(2)新型电池中的铝电池类型较多。Li-Al/FeS是一种二次电池,可用于车载电源,其电池总反应为2Li+FeS=Li2S+Fe。放电时的正极反应式为_______ 。
(3)钢铁发生电化学腐蚀可分为析氢腐蚀和吸氧腐蚀,可以采用电化学手段进行防腐。
①写出钢铁在酸性较强的环境中发生电化学腐蚀的正极反应式:_______ 。
②为了减缓水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案:

其中连接在铁闸门上的固体材料R可以采用_______ (填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
(1)某同学根据氧化还原反应:2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s),设计如图所示的原电池。

①两个电极一个是铜,一个是铝,电极X的化学式为
②盐桥中的阴离子向
(2)新型电池中的铝电池类型较多。Li-Al/FeS是一种二次电池,可用于车载电源,其电池总反应为2Li+FeS=Li2S+Fe。放电时的正极反应式为
(3)钢铁发生电化学腐蚀可分为析氢腐蚀和吸氧腐蚀,可以采用电化学手段进行防腐。
①写出钢铁在酸性较强的环境中发生电化学腐蚀的正极反应式:
②为了减缓水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案:

其中连接在铁闸门上的固体材料R可以采用
A.铜 B.钠 C.锌 D.石墨
您最近一年使用:0次
名校
解题方法
8 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___ (填字母)。
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2=2CO2(l)
(2)如图为原电池装置示意图:___ ,反应过程中溶液的酸性___ (填“变大”变小“或”不变“)。一段时间后,当在电池中放出1.68L(标准状况)气体时,电路中有___ 个电子通过了导线(设NA为阿伏加德罗常数的值)。
②若电池的总反应为2Fe3++Cu=2Fe2++Cu2+,负极材料是___ ,负极的电极反应式为___ 。
③若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为___ 极(填正或负);写出该电极电极反应式:__ 。
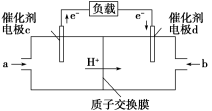
④燃料电池是一种具有应用前景的绿色电源,H2和O2组合形成的燃料电池的结构如图(电解液是稀硫酸):___ (填“正极”或“负极”),电极d的电极反应式为_____ 。若线路中转移2mol电子,则该燃科电池理论上消耗的O2在标准状况下的体积为___ L。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2=2CO2(l)
(2)如图为原电池装置示意图:
②若电池的总反应为2Fe3++Cu=2Fe2++Cu2+,负极材料是
③若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为
④燃料电池是一种具有应用前景的绿色电源,H2和O2组合形成的燃料电池的结构如图(电解液是稀硫酸):
您最近一年使用:0次
2021-05-13更新
|
455次组卷
|
2卷引用:山东省实验中学2020~2021学年高一下学期期中考试化学试题
名校
解题方法
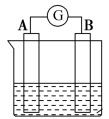
9 . 已知氧化性:Au3+>Ag+>Cu2+>Pb2+>Cr3+>Zn2+>Ti2+。现有如图所示的电化学装置,下列叙述中正确的是
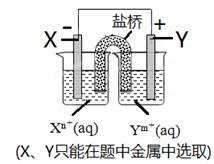

| A.若X为Ti,则Y极的电极反应式可能是Zn-2e-=Zn2+ |
| B.若X为Cr,则Y可以选Zn或Ti |
| C.若Y为Cu,则X极的电极反应式可能是Cr-3e-=Cr3+ |
| D.若Y为Pb,则Xn+(aq)中阴离子数会减少 |
您最近一年使用:0次
2016-12-09更新
|
1336次组卷
|
10卷引用:江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题
江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题(已下线)第四章 电化学基础(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)山东省德州市夏津第一中学2021-2022学年高二上学期第一次月考化学试卷山东省枣庄市第三中学2021-2022学年高二10月月考化学试题(已下线)4.1.1 原电池的工作原理(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)2013-2014学年江西省鹰潭一中高二上学期期中考试化学试卷福建省晋江市季延中学2018-2019学年高二(理)上学期期中考试化学试题山东省济南市山东师范大学附属中学2020-2021学年高二上学期10月学业质量检测化学试题河南省郑州市第106中学2020-2021学年高二上学期9月月考化学(理)试题第一节 原电池 第1课时 原电池的工作原理



