氮的化合物在工业中应用十分广泛。
(1)工业上尿素【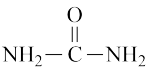 】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=
】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=___
(2)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。
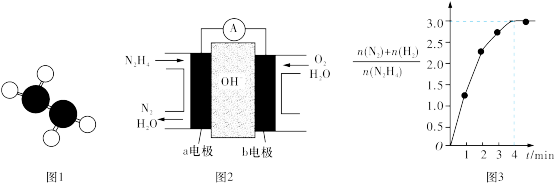
①已知肼的球棍模型如图1所示,试写出肼的电子式:_______ 。
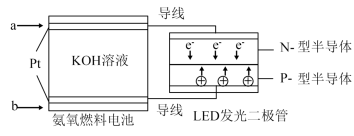
②目前正在研发的一种肼燃料电池的结构如图2所示,_____ (填“a”或“b”)电极为电池的负极。
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应
N2H4(l)⇌N2(g)+2H2(g),测得容器中的[n(N2)+n(H2)]/n(N2H4)与时间的关系如图3所示,则0~4 min内氮气的平均反应速率v(N2)=________ 。
(1)工业上尿素【
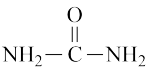 】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=
】由CO2和NH3在一定条件下合成,其热反应方程式CO2(g)+2NH3(g)=CO(NH2)2(g)+H2O(g);∆H=化学键 | 键能(KJ·mol-1) |
C=O | 728 |
C—N | 305 |
N—H | 389 |
O—H | 464 |
(2)肼(N2H4)是一种无色易溶于水的油状液体。其具有碱性和极强的还原性,在工业生产中应用非常广泛。

①已知肼的球棍模型如图1所示,试写出肼的电子式:
②目前正在研发的一种肼燃料电池的结构如图2所示,
③在1 L固定体积的密闭容器中加入0.1 mol N2H4,在303 K、Pt催化下发生反应
N2H4(l)⇌N2(g)+2H2(g),测得容器中的[n(N2)+n(H2)]/n(N2H4)与时间的关系如图3所示,则0~4 min内氮气的平均反应速率v(N2)=
更新时间:2021/05/19 22:19:09
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题
(1)“哈伯法”合成氨的反应:N2(g)+3H2(g) 2NH3(g) ΔH,相关键能数据如下表:
2NH3(g) ΔH,相关键能数据如下表:
ΔH=___________ kJ·mol-1;
②向密闭容器中按 1:3 体积比通入N2和H2,反应达平衡时NH3的体积分数为25.0%, 则N2的平衡转化率a(N2)=___________ 。
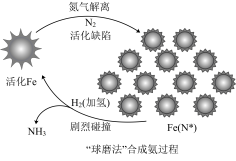
(2)“球磨法”是在温和的条件下(45℃和1 bar,l bar≈100 kPa)合成氨,氨的最终体积分数可高达 82.5%。该法分为两个步骤(如图):第一步,铁粉在球磨过程中被反复剧烈碰撞而活化,产生高密度的缺陷,氮分子被吸附在这些缺陷上([Fe(N*)]),有助于氮分子的解离。第二步,N*发生加氢反应得到NH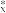 (x=1~3),剧烈碰撞中,NH
(x=1~3),剧烈碰撞中,NH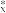 从催化剂表面脱附得到产物氨。
从催化剂表面脱附得到产物氨。
①“球磨法”与“哈伯法”相比较, 下列说法中正确的是___________ (选填标号)。
A.催化剂(Fe)缺陷密度越高,N2的吸附率越高
B.“哈伯法”采用高温主要用于解离氮氮三键,而“球磨法”不用解离氮氮三键
C.“球磨法”中“剧烈碰撞”仅仅为了产生“活化缺陷”
D.“球磨法”不采用高压,是因为低压产率已经较高,加压会增大成本
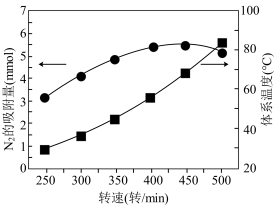
②机械碰撞有助于催化剂缺陷的形成,而摩擦生热会使体系温度升高。图甲是N2吸附量、体系温度随球磨转速变化曲线,则应选择的最佳转速约___________ 转/min。若选择500转/min的转速,N2的吸附量降低的原因是___________ 。
(3)用氨气研发燃料电池,电池反应为:4NH3+3O2=2N2+6H2O, 使用1mol/L的KOH溶液做电解质溶液。每消耗6.4gO2转移的电子数为___________ (用NA表示阿伏加德罗常数的值)。请写出通入a气体一极的电极反应式为___________ 。
(1)“哈伯法”合成氨的反应:N2(g)+3H2(g)
 2NH3(g) ΔH,相关键能数据如下表:
2NH3(g) ΔH,相关键能数据如下表:| 化学键 | N≡N | H-H | N-H |
| 键能(kJ·mol-1) | 946.0 | 436.0 | 390.8 |
②向密闭容器中按 1:3 体积比通入N2和H2,反应达平衡时NH3的体积分数为25.0%, 则N2的平衡转化率a(N2)=
(2)“球磨法”是在温和的条件下(45℃和1 bar,l bar≈100 kPa)合成氨,氨的最终体积分数可高达 82.5%。该法分为两个步骤(如图):第一步,铁粉在球磨过程中被反复剧烈碰撞而活化,产生高密度的缺陷,氮分子被吸附在这些缺陷上([Fe(N*)]),有助于氮分子的解离。第二步,N*发生加氢反应得到NH
 (x=1~3),剧烈碰撞中,NH
(x=1~3),剧烈碰撞中,NH 从催化剂表面脱附得到产物氨。
从催化剂表面脱附得到产物氨。
①“球磨法”与“哈伯法”相比较, 下列说法中正确的是
A.催化剂(Fe)缺陷密度越高,N2的吸附率越高
B.“哈伯法”采用高温主要用于解离氮氮三键,而“球磨法”不用解离氮氮三键
C.“球磨法”中“剧烈碰撞”仅仅为了产生“活化缺陷”
D.“球磨法”不采用高压,是因为低压产率已经较高,加压会增大成本
②机械碰撞有助于催化剂缺陷的形成,而摩擦生热会使体系温度升高。图甲是N2吸附量、体系温度随球磨转速变化曲线,则应选择的最佳转速约

(3)用氨气研发燃料电池,电池反应为:4NH3+3O2=2N2+6H2O, 使用1mol/L的KOH溶液做电解质溶液。每消耗6.4gO2转移的电子数为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】回答下列问题。
(1)下列变化中属于吸热反应的是_______ (填字母)
A.液态水汽化 B.将胆矾加热变为白色粉末
C.苛性钠固体溶于水 D.生石灰跟水反应生成熟石灰
(2)断开1molH-H键、1molN-H键、1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,则1mol N2生成NH3理论上能_______ (填“吸收”或“放出”)能量_______ kJ。
(3)某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如表:
在此5组实验中,速率最快的是_______ (填实验序号);实验1和2表明_______ 对反应速率有影响;实验1和3表明_______ 对反应速率有影响。
(4)用CH4和O2组合形成的燃料电池的结构如图丙:
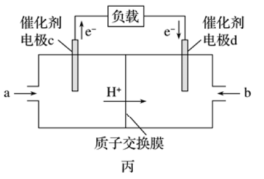
则电极d是_______ (填“正极”或“负极”),电池总反应式为_______ 。
(1)下列变化中属于吸热反应的是
A.液态水汽化 B.将胆矾加热变为白色粉末
C.苛性钠固体溶于水 D.生石灰跟水反应生成熟石灰
(2)断开1molH-H键、1molN-H键、1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,则1mol N2生成NH3理论上能
(3)某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如表:
| 序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
在此5组实验中,速率最快的是
(4)用CH4和O2组合形成的燃料电池的结构如图丙:

则电极d是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】I 用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应A可实现氯的循环利用。反应A:4HCl+O2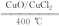 2Cl2+2H2O。
2Cl2+2H2O。
已知:ⅰ反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
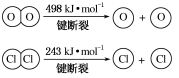
(1)H2O的电子式是______________________ 。
(2)反应A的热化学方程式是_________________________________________________ 。
(3)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________ kJ,H2O中H—O键比HCl中H—Cl键________ (填“强”或“弱”)。
II 在一定条件下,可逆反应A2(g) + B2(g) 2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
(1)a、b应满足的关系是________________________________ ;
(2)a的取值范围是________________________________ 。
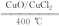 2Cl2+2H2O。
2Cl2+2H2O。已知:ⅰ反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

(1)H2O的电子式是
(2)反应A的热化学方程式是
(3)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为
II 在一定条件下,可逆反应A2(g) + B2(g)
 2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:(1)a、b应满足的关系是
(2)a的取值范围是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇用途广泛,可用作溶剂、防冻剂、燃料,也可用于生产生物柴油,利用合成气(主要成分为CO、CO2和H2)可以合成甲醇,涉及的反应如下,回答下列问题:
反应ⅰ:CO(g)+2H2(g) CH3OH(g) △H1=−91.5kJ∙mol−1
CH3OH(g) △H1=−91.5kJ∙mol−1
反应ii:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
反应iii:CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):___________ 。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式___________ 。
③m=___________ (计算结果保留两位有效数字,已知1eV=1.6×10−22kJ)。
(2)反应ⅰ的Arrhenius经验公式Rlnk=− +C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是
+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是___________ 。 和CO的选择性
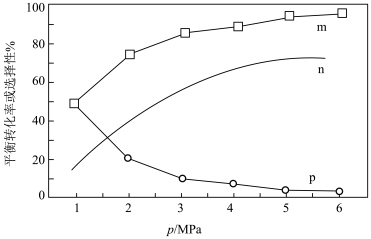
和CO的选择性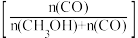 随压强变化曲线如图所示。
随压强变化曲线如图所示。___________ (填“m”“n”或“p”),简述判断方法___________ 。___________ mol·L−1·s−1(保留两位有效数字)。
反应ⅰ:CO(g)+2H2(g)
 CH3OH(g) △H1=−91.5kJ∙mol−1
CH3OH(g) △H1=−91.5kJ∙mol−1反应ii:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1反应iii:CO2(g)+H2(g)
 CO(g)+H2O(g) △H3=+41.6kJ∙mol−1
CO(g)+H2O(g) △H3=+41.6kJ∙mol−1(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):
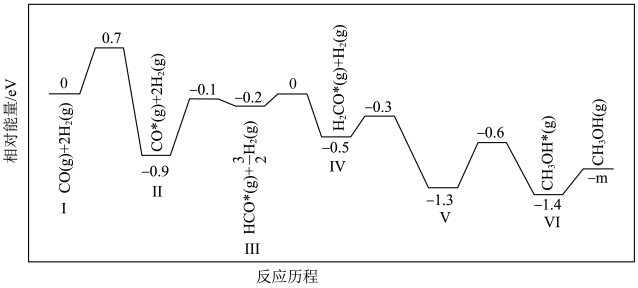
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式
③m=
(2)反应ⅰ的Arrhenius经验公式Rlnk=−
 +C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是
+C(Ea为活化能,k为速率常数,R和C均为常数,T为温度),实验数据如图中曲线M所示。当改变外界条件时,实验数据如图中曲线N所示,则实验可能改变的外界条件是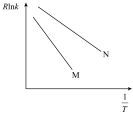
 和CO的选择性
和CO的选择性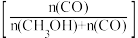 随压强变化曲线如图所示。
随压强变化曲线如图所示。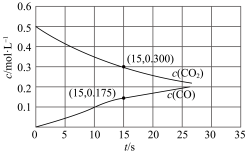
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】请根据有关知识,填写下列空白:
(1)拆开1molH﹣H键,1molN﹣H键,1mol 键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上1molN2生成NH3
键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上1molN2生成NH3_______ 热量(填“吸收”或“放出”)_______ kJ;事实上,反应的热量总小于理论值,理由是_______ 。
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
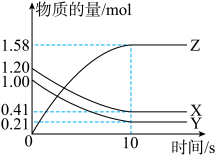
(2)写出该反应的化学方程式_______ 。
(3)从开始到10s用Z表示该反应的速率为_______ 。
(4)下列叙述中能说明上述反应达到平衡状态的是_______。
(5)为加快该反应的反应速率,可采取的措施是_______。
(1)拆开1molH﹣H键,1molN﹣H键,1mol
 键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上1molN2生成NH3
键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上1molN2生成NH3一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(2)写出该反应的化学方程式
(3)从开始到10s用Z表示该反应的速率为
(4)下列叙述中能说明上述反应达到平衡状态的是_______。
| A.X、Y、Z的反应速率之比为1:1:2 |
| B.在混合气体中X的体积分数保持不变 |
| C.混合气体的平均摩尔质量不随时间的变化而变化 |
| D.混合气体的压强不随时间的变化而变化 |
| A.适当升高温度 | B.恒容时充入Ne使压强增大 |
| C.增大容器的体积 | D.选择高效催化剂 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,该反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时测得CO的浓度为0.5mol/L。回答下列问题:
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时测得CO的浓度为0.5mol/L。回答下列问题:
(1)0~5min时间内用H2表示的化学反应速率为___________ 。
(2)5min时CH4的物质的量分数为___________ ,CO2的转化率是___________ 。
(3)反应前后混合气体的压强之比为___________ 。
(4)为了加快反应速率,可采取什么措施(写两条)___________ 。
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
该催化重整反应中反应物的总能量___________ 生成物的总能量(填“大于”或“小于”)。
(6)乙醇可用于燃料电池,若用NaOH作电解质溶液,负极电极反应方程式为___________ 。
 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时测得CO的浓度为0.5mol/L。回答下列问题:
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时测得CO的浓度为0.5mol/L。回答下列问题:(1)0~5min时间内用H2表示的化学反应速率为
(2)5min时CH4的物质的量分数为
(3)反应前后混合气体的压强之比为
(4)为了加快反应速率,可采取什么措施(写两条)
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
| 物质 | CH4 | CO2 | CO | H2 |
| 能量/kJ | 1660 | 1490 | 1072 | 436 |
该催化重整反应中反应物的总能量
(6)乙醇可用于燃料电池,若用NaOH作电解质溶液,负极电极反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】利用化学反应将储存在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产生活提供能量。回答下列问题:
(1)将2Ag+ +Cu=Cu2+ +2Ag设计成原电池,装置如图所示。
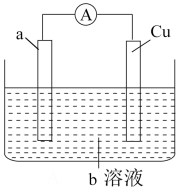
①a电极为_______ (填 “负极”或“正极”),b溶液为_______ (填化学式),Cu电极上发生的反应为_______ 。
②当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池电路中转移的电子数目是_______ 。
③如图所示能正确表示实验过程中变化的是_______ (填序号)。
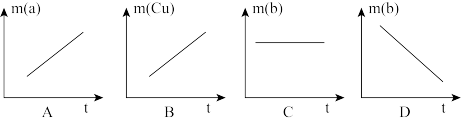
(2)某学习小组利用原电池探究浓硝酸或稀硝酸与铁的反应。
①取少量I中溶液,加入KSCN溶液,溶液变红,写出I中发生反应的离子方程式_______ 。
②II中Fe表面产生红棕色气泡,此时Cu是_______ 极,而后停止的原因是_______ 。
(1)将2Ag+ +Cu=Cu2+ +2Ag设计成原电池,装置如图所示。

①a电极为
②当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池电路中转移的电子数目是
③如图所示能正确表示实验过程中变化的是

(2)某学习小组利用原电池探究浓硝酸或稀硝酸与铁的反应。
| 实验 | 现象 |
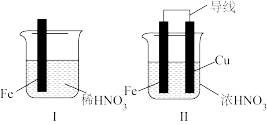 | I中: Fe表面产生大量无色气泡,液面上方变为红棕色 II中:连接导线,一段时间后Fe表面产生红棕色气泡,而后停止;Cu表面始终产生红棕色气泡 |
②II中Fe表面产生红棕色气泡,此时Cu是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】(1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
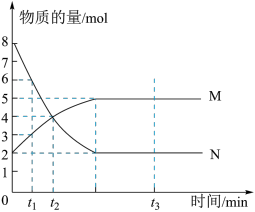
①此反应的化学方程式中a :b=__________
②t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________
③下列叙述中能说明上述反应达到平衡状态的是______________
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(2)如图是某锌锰干电池的基本构造图。

①该干电池的总反应式为2MnO2+Zn+2H2O=2MnO(OH)+ Zn(OH)2,该电池的负极是___________ ,工作时正极的电极反应式是______________________________ 。
②关于该电池的使用和性能,下列说法正确的是____________
A.该电池属于蓄电池
B.电池工作时OH-向负极移动
C.该电池的电解质溶液是H2SO4溶液
D.该电池用完后可随意丢弃,不需要回收处理
(3)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因_______________________________ 。
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一氢氧燃料电池,以电极a为正极,电极b为负极,采用氢氧化钠溶液为电解液,则氧气应通入_________ 极(填序号),电解质溶液的pH将____________ (填“变大”,“变小”或“不变”)
 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
①此反应的化学方程式中a :b=
②t1到t2时刻,以M的浓度变化表示的平均反应速率为:
③下列叙述中能说明上述反应达到平衡状态的是
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(2)如图是某锌锰干电池的基本构造图。

①该干电池的总反应式为2MnO2+Zn+2H2O=2MnO(OH)+ Zn(OH)2,该电池的负极是
②关于该电池的使用和性能,下列说法正确的是
A.该电池属于蓄电池
B.电池工作时OH-向负极移动
C.该电池的电解质溶液是H2SO4溶液
D.该电池用完后可随意丢弃,不需要回收处理
(3)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一氢氧燃料电池,以电极a为正极,电极b为负极,采用氢氧化钠溶液为电解液,则氧气应通入
您最近一年使用:0次
【推荐3】铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有 、
、 、FeO、
、FeO、 等)来制备绿矾
等)来制备绿矾 和
和 ,其工艺流程如图:
,其工艺流程如图: 是酸性氧化物,不溶于盐酸。回答下列问题:
是酸性氧化物,不溶于盐酸。回答下列问题:
(1)发生过程1时,通常会将“矿石”粉碎,其目的是_______ 。
(2)滤渣1的成分是:_______ (填化学式)。
(3)向溶液A中加入过量铁粉的目的是_______ ,涉及到的离子方程式为_______ 。
(4)写出由滤液1生成滤液2的离子方程式为:_______ 。
(5)由溶液B得到绿矾的实验操作是_______ 。
(6)某原电池用镁、铝作电极,电解质溶液为KOH溶液。该电池的正极为_______ 。负极反应式为_______ 。
 、
、 、FeO、
、FeO、 等)来制备绿矾
等)来制备绿矾 和
和 ,其工艺流程如图:
,其工艺流程如图: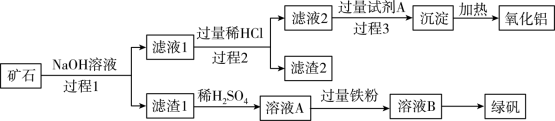
 是酸性氧化物,不溶于盐酸。回答下列问题:
是酸性氧化物,不溶于盐酸。回答下列问题:(1)发生过程1时,通常会将“矿石”粉碎,其目的是
(2)滤渣1的成分是:
(3)向溶液A中加入过量铁粉的目的是
(4)写出由滤液1生成滤液2的离子方程式为:
(5)由溶液B得到绿矾的实验操作是
(6)某原电池用镁、铝作电极,电解质溶液为KOH溶液。该电池的正极为
您最近一年使用:0次



