名校
解题方法
1 . 碘是人体所需的微量元素之一,使用加碘盐是为缺碘地区人群补碘的重要方式。某化学兴趣小组对碘盐中的含碘物质进行了成分探究。
【猜想预测】
(1)预测1:食盐中加入的含碘物质是碘化钾(KI)。
预测2:___________
预测3:食盐中加入的含碘物质是碘化钾(KI)和碘酸钾(KIO3)。
【实验探究】
可选试剂:碘盐溶液、0.5 mol/LKI溶液、稀硫酸、新制氯水、淀粉溶液。
查阅资料:KIO3在酸性条件下具有较强氧化性,可以与具有较强还原性的物质发生反应。
(2)甲同学基于预测,运用实验室提供的试剂,设计了如下实验,请补全表格:
【实验反思】
Ⅰ、乙同学认为使用Na2S溶液也可以验证该预测,因此设计了实验3如下:
查阅资料:同浓度下,S2-的还原性强于I-。
(3)试推测实验3中溶液未变蓝的可能原因___________ 。
Ⅱ、丙同学使用酸化的溶液进行了食盐中碘元素含量的测定,具体步骤如下:
查阅资料:根据中华人民共和国国家标准(GB26878-2011),在食用盐中加入碘强化剂后,食用盐产品(碘盐)中碘含量的平均水平(以碘元素计)为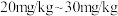 。
。
(4)用天平称量100 g某食盐样品于烧杯中,加入一定量的蒸馏水溶解,该烧杯中的KIO3与过量KI溶液完全反应后,经测定,生成的碘单质为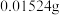 。则该样品中碘含量(以碘元素计)为
。则该样品中碘含量(以碘元素计)为___________ 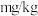 ,符合国家标准。
,符合国家标准。
【猜想预测】
(1)预测1:食盐中加入的含碘物质是碘化钾(KI)。
预测2:
预测3:食盐中加入的含碘物质是碘化钾(KI)和碘酸钾(KIO3)。
【实验探究】
可选试剂:碘盐溶液、0.5 mol/LKI溶液、稀硫酸、新制氯水、淀粉溶液。
查阅资料:KIO3在酸性条件下具有较强氧化性,可以与具有较强还原性的物质发生反应。
(2)甲同学基于预测,运用实验室提供的试剂,设计了如下实验,请补全表格:
| 实验编号 | 实验操作 | 实验现象 | 解释与结论 |
| 实验1 | 步骤1:取2 mL碘盐溶液,加入2 mL稀硫酸,滴加1滴淀粉溶液。 步骤2:在上述溶液中滴加1 mL新制氯水。 | 步骤1证明预测3不正确;步骤2证明预测1不正确 | |
| 实验2 | 步骤1:取 滴加1滴淀粉溶液。 步骤2:取2 mL碘盐溶液,加入上一步配制的检验试剂。 | 步骤1中溶液不变蓝色,步骤2中溶液变为蓝色 | 步骤1可排除空气带来的干扰;步骤2反应的离子方程式为 结论:预测2正确。 |
【实验反思】
Ⅰ、乙同学认为使用Na2S溶液也可以验证该预测,因此设计了实验3如下:
查阅资料:同浓度下,S2-的还原性强于I-。
| 实验编号 | 加入试剂或操作 | 实验现象 |
| 实验3 | 取2 mL碘盐溶液,滴加1滴淀粉溶液,再滴加1 mL0.5 mol/LNa2S溶液。 | 溶液未变蓝 |
Ⅱ、丙同学使用酸化的溶液进行了食盐中碘元素含量的测定,具体步骤如下:
查阅资料:根据中华人民共和国国家标准(GB26878-2011),在食用盐中加入碘强化剂后,食用盐产品(碘盐)中碘含量的平均水平(以碘元素计)为
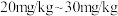 。
。(4)用天平称量100 g某食盐样品于烧杯中,加入一定量的蒸馏水溶解,该烧杯中的KIO3与过量KI溶液完全反应后,经测定,生成的碘单质为
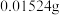 。则该样品中碘含量(以碘元素计)为
。则该样品中碘含量(以碘元素计)为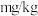 ,符合国家标准。
,符合国家标准。
您最近一年使用:0次
解题方法
2 . 某化学小组在实验室中对SO2进行探究。回答下列问题:
(1)①学生甲用如图E装置制备SO2。写出该反应的化学方程式___________ ,该反应中,硫酸体现的的性质有___________
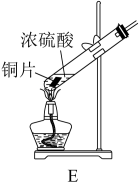
A.氧化性 B.还原性 C.酸性 D.碱性
②学生乙以 粉末和
粉末和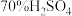 为原料制取SO2,反应的化学方程式是:
为原料制取SO2,反应的化学方程式是:___________
③现欲收集一瓶干燥的SO2,选用下图中的A、B、C、D装置,其连接顺序(按气流方向,用小写字母表示,可重复选用)为:___________
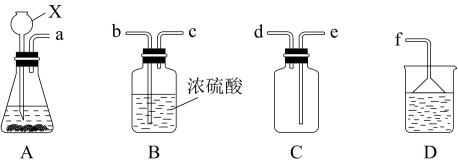
(2)学生丙用浓H2SO4和蔗糖反应,得到的气体中含有SO2、CO2。现选择下图中的装置,验证混合气体中存在CO2和SO2,A和C中盛放的是品红溶液,B中盛放的是酸性高锰酸钾溶液。其中,能证明存在CO2的现象是___________ 。
(3)学生甲实验中,大试管内产生了大量黑色固体。查阅资料知:
①黑色固体可能含有CuO、CuS、 。
。
②CuS和 不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
③向含微量 的溶液中滴加
的溶液中滴加 溶液,能产生红褐色沉淀。
溶液,能产生红褐色沉淀。
现取少量黑色沉淀,加入稀硫酸,充分振荡以后,再滴加 溶液,未见红褐色沉淀,由此所得结论是
溶液,未见红褐色沉淀,由此所得结论是___________ 。另取少量黑色沉淀,加入足量稀硝酸并加热,发现黑色固体最终完全溶解,溶液变为蓝色,有无色气泡生成,管口处出现红棕色。试写出CuS溶于足量稀硝酸的离子方程式:___________
为测定黑色沉淀中 的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应:
的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应: ,
,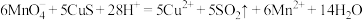 ,恰好用去KMnO4溶液23.50mL。则混合物中
,恰好用去KMnO4溶液23.50mL。则混合物中 的质量分数为
的质量分数为___________
(1)①学生甲用如图E装置制备SO2。写出该反应的化学方程式

A.氧化性 B.还原性 C.酸性 D.碱性
②学生乙以
 粉末和
粉末和 为原料制取SO2,反应的化学方程式是:
为原料制取SO2,反应的化学方程式是:③现欲收集一瓶干燥的SO2,选用下图中的A、B、C、D装置,其连接顺序(按气流方向,用小写字母表示,可重复选用)为:

(2)学生丙用浓H2SO4和蔗糖反应,得到的气体中含有SO2、CO2。现选择下图中的装置,验证混合气体中存在CO2和SO2,A和C中盛放的是品红溶液,B中盛放的是酸性高锰酸钾溶液。其中,能证明存在CO2的现象是

(3)学生甲实验中,大试管内产生了大量黑色固体。查阅资料知:
①黑色固体可能含有CuO、CuS、
 。
。②CuS和
 不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。③向含微量
 的溶液中滴加
的溶液中滴加 溶液,能产生红褐色沉淀。
溶液,能产生红褐色沉淀。现取少量黑色沉淀,加入稀硫酸,充分振荡以后,再滴加
 溶液,未见红褐色沉淀,由此所得结论是
溶液,未见红褐色沉淀,由此所得结论是为测定黑色沉淀中
 的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应:
的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应: ,
,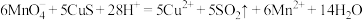 ,恰好用去KMnO4溶液23.50mL。则混合物中
,恰好用去KMnO4溶液23.50mL。则混合物中 的质量分数为
的质量分数为
您最近一年使用:0次
2021-05-20更新
|
359次组卷
|
2卷引用:江苏省无锡先锋高级中2020-2021学年高一下学期第一次月考化学试题
解题方法
3 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究Na2SO3的性质,进行了如下实验。
(1)Na2SO3中硫元素的化合价是___ ,属于S元素的中间价态,既具有氧化性,又具有还原性。
资料:酸性条件下,KMnO4为紫色,Mn2+为无色。
(2)实验ⅰ中,能说明Na2SO3具有___ (填“氧化性”或“还原性”)。
(3)实验ⅱ中,能说明Na2S在酸性条件下被氧化的实验现象是___ 。
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设a:酸性溶液中的SO 具有氧化性,可产生S;
具有氧化性,可产生S;
假设b:空气中存在O2,在酸性条件下,由于___ (用离子方程式表示),可产生S;
假设c:酸性溶液中的SO 具有氧化性,可产生S。
具有氧化性,可产生S。
②设计实验iii证实了假设a和b不是产生S的主要原因。
实验iii:向Na2S溶液中加入___ (填试剂),产生有臭鸡蛋气味的气体,溶液未变浑。
(1)Na2SO3中硫元素的化合价是
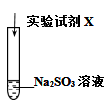 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊 |
(2)实验ⅰ中,能说明Na2SO3具有
(3)实验ⅱ中,能说明Na2S在酸性条件下被氧化的实验现象是
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设a:酸性溶液中的SO
 具有氧化性,可产生S;
具有氧化性,可产生S;假设b:空气中存在O2,在酸性条件下,由于
假设c:酸性溶液中的SO
 具有氧化性,可产生S。
具有氧化性,可产生S。②设计实验iii证实了假设a和b不是产生S的主要原因。
实验iii:向Na2S溶液中加入
您最近一年使用:0次
4 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3的性质,进行了如下实验。
【性质预测】
(1)Na2SO3中硫元素的化合价是_______ ,属于S元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下,KMnO4 被还原为无色的 Mn2+。
【分析解释】
(2)实验ⅰ中,反应的离子方程式是_______ 。
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是_______ 。
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO 具有氧化性,可产生 S;
具有氧化性,可产生 S;
假设 b:空气中存在 O2,在酸性条件下,由于_______ (用离子方程式表示),可产生 S;
假设 c:酸性溶液中的 SO 具有氧化性,可产生 S。
具有氧化性,可产生 S。
②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入_______ (填试剂名称),产生有臭鸡蛋气味的气体,离子方程式为_______ ,溶液未变浑浊。
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:_______ 。
【性质预测】
(1)Na2SO3中硫元素的化合价是
【实验验证】
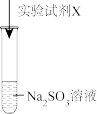 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S 溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊。 |
【分析解释】
(2)实验ⅰ中,反应的离子方程式是
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO
 具有氧化性,可产生 S;
具有氧化性,可产生 S;假设 b:空气中存在 O2,在酸性条件下,由于
假设 c:酸性溶液中的 SO
 具有氧化性,可产生 S。
具有氧化性,可产生 S。②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:
您最近一年使用:0次
5 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3的性质,进行了如下实验。
【性质预测】
(1)Na2SO3中硫元素的化合价是_____ ,属于 S 元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下,KMnO4被还原为无色的 Mn2+。
【分析解释】
(2)实验ⅰ中,反应的离子方程式是___________ 。
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是___________ 。
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO 具有氧化性,可产生 S;
具有氧化性,可产生 S;
假设 b:空气中存在 O2,在酸性条件下,由于___________ (用离子方程式表示),可产生 S;
假设 c:酸性溶液中的 SO 具有氧化性,可产生 S。
具有氧化性,可产生 S。
②设计实验 iii 证实了假设 a 和 b 不是产生 S 的主要原因。
实验 iii:向 Na2S 溶液中加入___________ (填试剂),产生有臭鸡蛋气味的气体,溶液未变浑浊。
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:_______
【性质预测】
(1)Na2SO3中硫元素的化合价是
【实验验证】
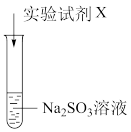 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S 溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊 |
【分析解释】
(2)实验ⅰ中,反应的离子方程式是
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO
 具有氧化性,可产生 S;
具有氧化性,可产生 S;假设 b:空气中存在 O2,在酸性条件下,由于
假设 c:酸性溶液中的 SO
 具有氧化性,可产生 S。
具有氧化性,可产生 S。②设计实验 iii 证实了假设 a 和 b 不是产生 S 的主要原因。
实验 iii:向 Na2S 溶液中加入
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:
您最近一年使用:0次
2021-02-01更新
|
1111次组卷
|
4卷引用:北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题
名校
6 . 某研究小组制备氯气并对产生氯气的反应原理进行探究。
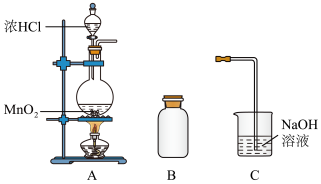
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的_______ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质有_______ (填化学式)。
(3)B用于排空气法收集Cl2,请完善装置B,并用箭头标明进出气体方向_______ 。
(4)该小组对产生氯气的反应原理,设计实验进行如下探究。
结合查阅资料,可知:
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是_______ 。
②Ⅱ中发生了分解反应,反应的化学方程式是_______ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质有
(3)B用于排空气法收集Cl2,请完善装置B,并用箭头标明进出气体方向
(4)该小组对产生氯气的反应原理,设计实验进行如下探究。
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是
②Ⅱ中发生了分解反应,反应的化学方程式是
您最近一年使用:0次
解题方法
7 . 亚硝酸钠(NaNO2)有毒、有咸味,外形与食盐相似,人若误食会引起中毒。某兴趣小组欲研究亚硝酸钠,查阅资料得到如表信息。试根据信息回答下列问题:
(1)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,则该反应中氧化剂是 _______ ;若有0.75mol电子发生转移,则被氧化的还原剂的粒子数为 _______ (用NA表示阿伏加德罗常数的值)。
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
(3)下列方法中,可用来区分NaNO2和NaCl的是 _______ (填序号)。
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_______ 。
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+。 |
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
| A.NaNO2被还原 |
| B.维生素C具有还原性 |
| C.还原性:维生素C>Fe2+ |
| D.NaNO2是还原剂 |
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式
您最近一年使用:0次
名校
解题方法
8 . 某研究小组欲探究 能否与
能否与 溶液反应。
溶液反应。
【查阅资料】
i. 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。
ii. 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。
【提出猜想】
(1)小组同学经过讨论后,认为 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:___________ 。
【设计实验】
(2)实验I:在试管中加入 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液_____ ,小组同学认为 和
和 溶液反应生成了
溶液反应生成了 。
。
(3)甲同学注意到盛放 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是______ 。
重新设计实验:
实验II:在试管中加入 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。
【获得结论】
(4)过氧化氢___________ (填“能”或者“不能”)氧化 。
。
【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。
(5)补全实验III的方案:在试管中加入 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入___________ ,产生___________ 。
【总结反思】
(6)小组同学经过讨论后,提出了 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中,___________ ,证明待测液含有 。
。
(7)从上述实验中可以得出结论,在物质性质的检验中,应注意___________ (至少写出两条)对实验结果的影响。
 能否与
能否与 溶液反应。
溶液反应。【查阅资料】
i.
 具有较强的还原性,
具有较强的还原性, 具有较强的氧化性。
具有较强的氧化性。ii.
 遇
遇 可生成
可生成 ,
, 溶液呈血红色,可用于
溶液呈血红色,可用于 的检验。
的检验。【提出猜想】
(1)小组同学经过讨论后,认为
 溶液可以与
溶液可以与 溶液反应,请从化合价的角度加以解释:
溶液反应,请从化合价的角度加以解释:【设计实验】
(2)实验I:在试管中加入
 溶液和
溶液和 溶液,再加入
溶液,再加入 溶液,发现溶液
溶液,发现溶液 和
和 溶液反应生成了
溶液反应生成了 。
。(3)甲同学注意到盛放
 溶液的试剂瓶中有空气,因此不同意该结论,他的理由是
溶液的试剂瓶中有空气,因此不同意该结论,他的理由是重新设计实验:
实验II:在试管中加入
 溶液,然后加入
溶液,然后加入 溶液,发现溶液无明显变化,再加入
溶液,发现溶液无明显变化,再加入 溶液,发现溶液变红。
溶液,发现溶液变红。【获得结论】
(4)过氧化氢
 。
。【发现异常】
乙同学继续向实验II所得溶液中滴加溶液,发现溶液褪色。
小组同学经过重新查阅资料后,发现可以将
 氧化为
氧化为 。乙同学设计实验III并证实了该资料中的说法。
。乙同学设计实验III并证实了该资料中的说法。(5)补全实验III的方案:在试管中加入
 溶液,加入
溶液,加入 溶液,再加入
溶液,再加入【总结反思】
(6)小组同学经过讨论后,提出了
 的检验方法:取待测液于试管中,
的检验方法:取待测液于试管中, 。
。(7)从上述实验中可以得出结论,在物质性质的检验中,应注意
您最近一年使用:0次
2021-11-07更新
|
1003次组卷
|
4卷引用:北京市一零一中2021-2022学年高一上学期期中考试化学试题
9 . 84消毒液是一种常见的含氯消毒剂。如图1为某品牌84消毒液的说明书中的部分内容。

(1)84消毒液的主要成分为 _______ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO﹣、Cl﹣、HClO;相同浓度时,HClO的氧化性强于ClO﹣;ORP是反映水溶液中所有物质表现出来的氧化﹣还原性,ORP值越大,氧化性越强。
Ⅰ.将2mL84消毒液中加2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
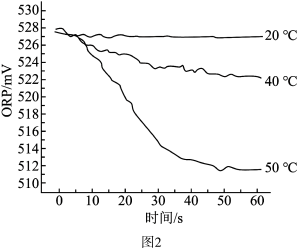
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如图2。
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______ 。
②实验表明,向84消毒液中加入较多硫酸时会产生氯气,生成氯气的离子方程式是_______ 。
③由实验Ⅲ可得出的结论是_______ 。ORP值不同的原因可能是 _______ 。

| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 (1)本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 (2)不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 (3)置于避光、阴凉处保存。 (4)需稀释后使用,勿口服。 |
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO﹣、Cl﹣、HClO;相同浓度时,HClO的氧化性强于ClO﹣;ORP是反映水溶液中所有物质表现出来的氧化﹣还原性,ORP值越大,氧化性越强。
Ⅰ.将2mL84消毒液中加2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如图2。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
您最近一年使用:0次
2022-12-05更新
|
176次组卷
|
2卷引用:北京市第五十七中学2021-2022学年高一上学期期中考试化学试题
10 . Ⅰ.某化学小组在学习元素周期律后,对卤素单质和拟卤素 的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
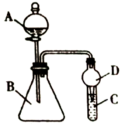
(1)仪器A的名称为______ ;干燥管D的作用为______ 。
(2)若A中加浓HSCN,B中加 ,已知
,已知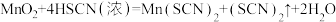 ,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性
,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性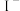
______  (填“
(填“ ”、“
”、“ ”、“
”、“ ”)。写出试管C中发生反应的离子方程式:
”)。写出试管C中发生反应的离子方程式:______ 。
Ⅱ.在探究 的性质实验时,做了以下3个实验:
的性质实验时,做了以下3个实验:
(3)试管1中反应的离子方程式为______ 。
(4)实验2前,小组同学预测经过步骤ii后溶液不应该呈现红色,依据是______ (结合方程式说明)。
(5)实验小组对白色沉淀的产生进行了深入探究,
查阅资料:i.CuSCN为难溶于水的白色固体;
ii. 被称为拟卤素离子,性质与卤素离子相似。
被称为拟卤素离子,性质与卤素离子相似。
经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能:
猜测①: 与KSCN发生了氧化还原反应,该反应的离子方程式
与KSCN发生了氧化还原反应,该反应的离子方程式______ ;
猜测②:亚铁离子将其还原 ,
,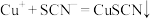
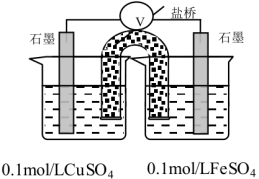
(6)根据实验3,得知猜测①是错误的。小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使 的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入______ 溶液,若电流计______ ,则可以证明以上分析正确。
 的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
的性质递变规律进行探究,利用如图装置可验证它们的性质规律。
(1)仪器A的名称为
(2)若A中加浓HSCN,B中加
 ,已知
,已知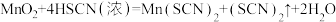 ,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性
,C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,即可证明还原性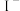
 (填“
(填“ ”、“
”、“ ”、“
”、“ ”)。写出试管C中发生反应的离子方程式:
”)。写出试管C中发生反应的离子方程式:Ⅱ.在探究
 的性质实验时,做了以下3个实验:
的性质实验时,做了以下3个实验:| 实验序号 | 试剂 | 实验步骤 | 实验现象 |
| 1 | 试管1中加2mL 0.05  溶液 溶液 | 加入1mL KSCN溶液 | 溶液变为血红色 |
| 2 | 试管2中加2mL 0.05  溶液 溶液 | I加入0.15g铜粉 | 黄色溶液变为澄清透明的浅蓝色 |
ii 再加入1滴0.1 KSCN溶液 KSCN溶液 | 液滴接触上方变为红色,下方有白色沉淀生成 | ||
| 3 | 试管3中加2mL 0.1  溶液 溶液 | 加入1mL KSCN溶液 | 溶液变成绿色 |
(4)实验2前,小组同学预测经过步骤ii后溶液不应该呈现红色,依据是
(5)实验小组对白色沉淀的产生进行了深入探究,
查阅资料:i.CuSCN为难溶于水的白色固体;
ii.
 被称为拟卤素离子,性质与卤素离子相似。
被称为拟卤素离子,性质与卤素离子相似。经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能:
猜测①:
 与KSCN发生了氧化还原反应,该反应的离子方程式
与KSCN发生了氧化还原反应,该反应的离子方程式猜测②:亚铁离子将其还原
 ,
,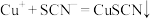
(6)根据实验3,得知猜测①是错误的。小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使
 的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
的氧化性增强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入
您最近一年使用:0次



