名校
1 . 现有含NaCl、Na2SO4和Na2CO3的固体混合物。某同学为测定各组分的含量,取5.0g样品溶于水,并设计了如下实验流程(所加试剂均过量)。
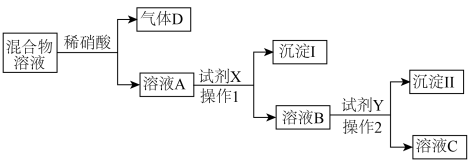
(1)生成气体D的离子方程式是___________ 。
(2)操作Ⅰ的名称是___________ 。
(3)试剂X是________ (填化学式),反应的离子方程式是________ 。
(4)检验试剂Y是否过量的方法是___________ 。
(5)将沉淀Ⅰ和沉淀Ⅱ洗涤、干燥、称量,沉淀Ⅰ的质量为2.33g,沉淀Ⅱ的质量为2.87g,则样品中Na2CO3的质量分数是___________ 。

(1)生成气体D的离子方程式是
(2)操作Ⅰ的名称是
(3)试剂X是
(4)检验试剂Y是否过量的方法是
(5)将沉淀Ⅰ和沉淀Ⅱ洗涤、干燥、称量,沉淀Ⅰ的质量为2.33g,沉淀Ⅱ的质量为2.87g,则样品中Na2CO3的质量分数是
您最近一年使用:0次
解题方法
2 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是“84”消毒液,可以说化学让生活更美好。图为“84”消毒液说明书。请回答下列问题:
(1)工业上常用氯气生产84消毒液,请写出反应的离子方程式___________ ,其有效成分为___________ (写化学式)。
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是___________ (用离子方程式表达)。
(3)游泳池水的消毒多用漂粉精,写出漂白精显效的化学方程式___________ 。
(4)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、“84”消毒液,主要目的___________。
 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g/L~60.00g/L | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物、浴缸等1:200水溶液;餐饮具、瓜果等1:100水溶液 |
(1)工业上常用氯气生产84消毒液,请写出反应的离子方程式
(2)家庭用“84”消毒液用法强调,做家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是
(3)游泳池水的消毒多用漂粉精,写出漂白精显效的化学方程式
(4)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、“84”消毒液,主要目的___________。
| A.增强漂白能力和消毒作用 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白、消毒 |
您最近一年使用:0次
21-22高一上·浙江·阶段练习
解题方法
3 . 海水中含有多种盐类物质,在一定温度下将海水不断浓缩,其间会不断有晶体析出,且海水的密度逐渐增大,表中为一定温度下不同密度的海水中几种盐类的含量(g/mL)。
回答下列问题:
(1)在海水晒盐的过程中,卤水的密度应该控制在什么范围内?_____
(2)恒温下,当蒸发1m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为_____ kg,析出NaCl的质量为_____ kg。
(3)请画出能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)(密度区间为1.13g/mL-1.31g/mL)的关系图_____ 。
| 海水密度(g/mL) | CaSO4(g/L) | NaCl(g/L) | MgCl2(g/L) | MgSO4(g/L) | NaBr(g/L) |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
回答下列问题:
(1)在海水晒盐的过程中,卤水的密度应该控制在什么范围内?
(2)恒温下,当蒸发1m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为
(3)请画出能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)(密度区间为1.13g/mL-1.31g/mL)的关系图
您最近一年使用:0次
4 . 下列关于钠及其化合物的叙述错误的是
| A.取用金属钠时,所需用品一般有小刀、镊子、滤纸、玻璃片 |
| B.金属钠与Ca(HCO3)2溶液反应时,既有白色沉淀又有气体逸出 |
| C.质量相同的两块钠,分别与氧气完全反应生成Na2O和Na2O2,生成Na2O的钠失去的电子更多 |
| D.生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl |
您最近一年使用:0次
名校
解题方法
5 . 海洋中蕴含着丰富的资源,我们通过“浓缩、氧化、提取”等步骤提取其中的溴、碘单质等资源。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤 含溴海水
含溴海水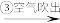 含溴空气
含溴空气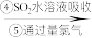 溴水混合物
溴水混合物 溴蒸气
溴蒸气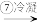 液溴
液溴
乙:苦卤 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴
(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的__________ 性。甲同学步骤④所发生反应的化学反应方程式为___________________ 。步骤④中SO2被氧化生成 ,写出检验
,写出检验 的方法
的方法___________________ 。
(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是_______ (填“甲”或“乙”),理由_____________________________________ 。
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)____________________ 。
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是_________ 。(选填编号)
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:
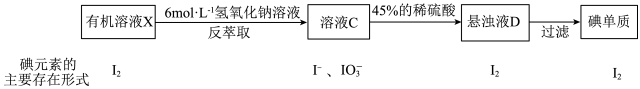
①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的_____________ 仪器(填名称)。
②相较于操作II,反萃取法的优点在于_______________ 。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤
 含溴海水
含溴海水 含溴空气
含溴空气 溴水混合物
溴水混合物 溴蒸气
溴蒸气 液溴
液溴乙:苦卤
 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的
 ,写出检验
,写出检验 的方法
的方法(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是
试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
相关性质 | 与水互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 与I2反应 |
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:

①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的
②相较于操作II,反萃取法的优点在于
您最近一年使用:0次
2022-12-14更新
|
806次组卷
|
2卷引用:上海市松江二中2021-2022学年高一上学期期末考试化学试题
解题方法
6 . 工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,利用0.1mol/LHCl溶液测定工业纯碱中Na2CO3的含量。

(1)若配制0.1mol/L稀盐酸480mL,需要的容量瓶规格为________ ,若在配制过程中仰视容量瓶刻度线,导致HCl物质的量浓度________ (填“偏高”“偏低”或“无影响”)。
(2)B中发生反应的离子方程式为________ 。
(3)装置E的作用为_______ 。实验结束后通入空气的目的为_______ 。
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_______ 。
(5)有同学认为该实验设计有较大缺陷,你认为要如何改进______________ 。

(1)若配制0.1mol/L稀盐酸480mL,需要的容量瓶规格为
(2)B中发生反应的离子方程式为
(3)装置E的作用为
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为
(5)有同学认为该实验设计有较大缺陷,你认为要如何改进
您最近一年使用:0次
名校
解题方法
7 . 工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。(碱石灰能吸收水和二氧化碳)
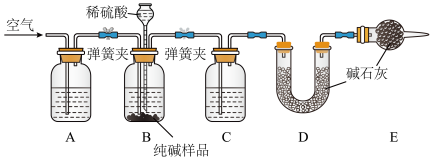
(1)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______ ,说明装置不漏气。
(2)装置A中的试剂为_______ ,装置C中的试剂为_______ 。
(3)实验结束后通入空气的目的:_______ 。
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_______ (保留小数点后一位);若缺少E装置,会使测定结果_______ (填“偏高”或“偏低”)。

(1)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(2)装置A中的试剂为
(3)实验结束后通入空气的目的:
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2022-11-20更新
|
92次组卷
|
2卷引用:湖南省长沙市明德中学2021-2022学年高一上学期12月第三次月考化学试题
名校
解题方法
8 . 以硅藻土为载体的五氧化二钒( )是接触法生成硫酸的催化剂。从废钒催化剂中回收
)是接触法生成硫酸的催化剂。从废钒催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
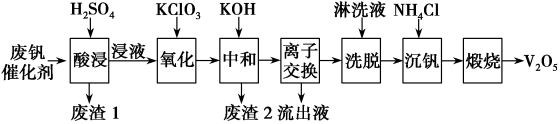
回答下列问题:
(1)“酸浸”时 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为_______ ,同时 转化为
转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是_______ 。
(2)“氧化”中使 变为
变为 ,则“氧化”环节中还原剂与氧化剂的物质的量之比为
,则“氧化”环节中还原剂与氧化剂的物质的量之比为_______ 。
(3)“离子交换”和“洗脱”可简单表示为: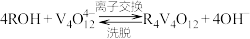 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_______ 性(填“酸”或“碱”)。
(4)检验“流出液”中含量最多的阳离子,其实验操作称为_______ 。
(5)“煅烧”中发生反应的化学方程式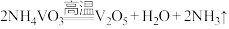 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式_______ 。
(6)若有1000kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到
_______ kg(保留小数点后一位)。
 )是接触法生成硫酸的催化剂。从废钒催化剂中回收
)是接触法生成硫酸的催化剂。从废钒催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:| 物质 |  |  |  |  |  |  |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为 转化为
转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是(2)“氧化”中使
 变为
变为 ,则“氧化”环节中还原剂与氧化剂的物质的量之比为
,则“氧化”环节中还原剂与氧化剂的物质的量之比为(3)“离子交换”和“洗脱”可简单表示为:
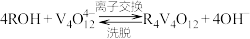 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(4)检验“流出液”中含量最多的阳离子,其实验操作称为
(5)“煅烧”中发生反应的化学方程式
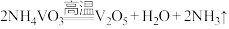 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式(6)若有1000kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到

您最近一年使用:0次
解题方法
9 . 日常生活中使用的牙膏里面都含有一定量的摩擦剂、增稠剂、保湿剂、活性添加物、色素与香精等。
(1)常见的摩擦剂有CaCO3、Al(OH)3、SiO2、CaHPO4、Ca2P2O7等。其中属于非电解质的是___________ ;CaHPO4微溶于水。请写出电离方程式___________ 。
(2)据调查,两面针牙膏使用的摩擦剂是氢氧化铝,治疗胃酸(主要是盐酸)过多的药物“胃舒平”的主要成分也是氢氧化铝。它是白色非晶形的粉末,难溶于水,抗酸持久、较强,有黏膜保护作用。请写出氢氧化铝治疗胃酸过多的离子方程式___________ 。
(3)同学丙设计了简单实验来测定牙膏中摩擦剂碳酸钙的含量。实验装置见下图,
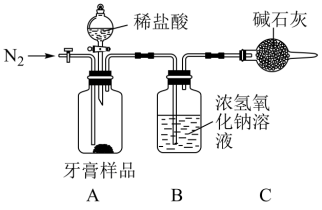
装稀盐酸仪器的名称为___________
有关实验数据如下:
则牙膏中碳酸钙的质量分数约为___________ 。(保留一位小数)
(1)常见的摩擦剂有CaCO3、Al(OH)3、SiO2、CaHPO4、Ca2P2O7等。其中属于非电解质的是
(2)据调查,两面针牙膏使用的摩擦剂是氢氧化铝,治疗胃酸(主要是盐酸)过多的药物“胃舒平”的主要成分也是氢氧化铝。它是白色非晶形的粉末,难溶于水,抗酸持久、较强,有黏膜保护作用。请写出氢氧化铝治疗胃酸过多的离子方程式
(3)同学丙设计了简单实验来测定牙膏中摩擦剂碳酸钙的含量。实验装置见下图,

装稀盐酸仪器的名称为
有关实验数据如下:
| 牙膏样品(g) | 反应前装置B(g) | 反应后装置B(g) |
| 8.0 | 94.7 | 96.5 |
您最近一年使用:0次
名校
10 . Na2CO3和NaHCO3是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组 对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I :
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡 试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10 mL水,充分振荡,最先溶解完全的是_______ ;再分别加入几滴酚猷试液,溶液变红,但颜色较浅的是_______ 。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后, 接下来的操作是_______ ,试管A中盛放的药品是_______ ,澄清石灰水变混浊的是_______ (填“a”或“b”),写出澄清石灰水变混浊的离子反应方程式_______ ,当实验结束时应当先 _______ (填操作)。
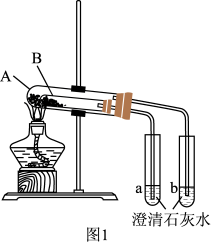
实验III:混合物中碳酸钠含量的测定
(4)按图2组装好仪器,检查装置气密性良好,称取3.00 g碳酸钠和碳酸氢钠的混合物,充分加热反应至恒重,称量剩余固体质量为2.38 g,则该混合物中碳酸钠的质量分数为_______ 。有同学提出:也可以利用澄清石灰水中生成的沉淀质量计算碳酸钠的含量,但是计算发现测量值明显偏大,可能的原因是_______ 。

实验I :
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡 试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10 mL水,充分振荡,最先溶解完全的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后, 接下来的操作是

实验III:混合物中碳酸钠含量的测定
(4)按图2组装好仪器,检查装置气密性良好,称取3.00 g碳酸钠和碳酸氢钠的混合物,充分加热反应至恒重,称量剩余固体质量为2.38 g,则该混合物中碳酸钠的质量分数为

您最近一年使用:0次



