1 . 1909年,德国化学家哈伯经过反复实验研究发现工业合成氨的可能性。1913年,在德国工程师博施努力下,一个年产7000吨的合成氨工厂建成并投产,合成氨的工业化生产终于实现。因此,哈伯和博施都获得了诺贝尔化学奖。
键能:常温常压下,将1 mol理想气体分子AB拆开为中性气态原子A和B所需要的能量。请回答下列问题:
(1)根据上表中所给数据判断:N2(g)+3H2(g) 2NH3(g)为
2NH3(g)为___________ 热反应(填“放”或“吸”);
(2)下列措施中能加快合成氨反应速率的是___________ ;
A.升高温度 B.使用合适的催化剂 C.分离出生成的氨气
D.增大氮气的浓度 E.扩大容器体积
(3)在一个恒温恒容的密闭容器中,发生可逆反应N2(g)+3H2(g) 2NH3(g),下列情况能说明反应已达到化学平衡状态的是
2NH3(g),下列情况能说明反应已达到化学平衡状态的是___________ ;
A.混合气体的总质量不再改变 B.氨气的质量分数不再改变
C.N2、H2和NH3的物质的量之比为1:3:2 D.容器内压强保持不变
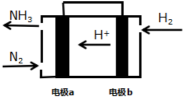
(4)为了提高合成氨的物料利用率和工作效率,科学家们正在制作合成氨原电池。右图为合成氨原电池的原理图,则电极a为___________ 极(填“正”或“负”)。
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
键能:常温常压下,将1 mol理想气体分子AB拆开为中性气态原子A和B所需要的能量。请回答下列问题:
(1)根据上表中所给数据判断:N2(g)+3H2(g)
 2NH3(g)为
2NH3(g)为(2)下列措施中能加快合成氨反应速率的是
A.升高温度 B.使用合适的催化剂 C.分离出生成的氨气
D.增大氮气的浓度 E.扩大容器体积
(3)在一个恒温恒容的密闭容器中,发生可逆反应N2(g)+3H2(g)
 2NH3(g),下列情况能说明反应已达到化学平衡状态的是
2NH3(g),下列情况能说明反应已达到化学平衡状态的是A.混合气体的总质量不再改变 B.氨气的质量分数不再改变
C.N2、H2和NH3的物质的量之比为1:3:2 D.容器内压强保持不变
(4)为了提高合成氨的物料利用率和工作效率,科学家们正在制作合成氨原电池。右图为合成氨原电池的原理图,则电极a为

您最近一年使用:0次
2021-05-13更新
|
263次组卷
|
3卷引用:浙江省七彩阳光新高考研究联盟2020-2021学年高一下学期期中联考化学试题
浙江省七彩阳光新高考研究联盟2020-2021学年高一下学期期中联考化学试题(已下线)专题06 化学反应速率和限度【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)浙江省舟山市南海实验高中2021-2022学年高一下学期4月月考化学试题
名校
解题方法
2 . 科研人员设想利用如图所示的装置生产硫酸,下列有关说法正确的是
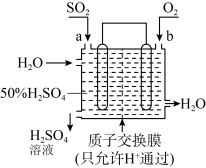

| A.a 为正极,b 为负极 |
| B.生产过程中氢离子由右移向左 |
| C.从左下口流出的硫酸的质量分数一定大于 50% |
| D.负极反应式为 SO2+2H2O-2e-=SO42-+4H+ |
您最近一年使用:0次
2020-04-21更新
|
290次组卷
|
13卷引用:河南省郑州市中牟县2020-2021学年高一下学期期中考试化学试题
河南省郑州市中牟县2020-2021学年高一下学期期中考试化学试题河南省实验中学2018-2019学年高一下学期期中考试化学试题江西省贵溪市实验中学2020-2021学年高二下学期第一次月考化学试题2016-2017学年浙江省温州市“十五校联合体”高二下学期期中联考化学试卷河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题浙江省2018版考前特训(2017年10月):选考仿真测试卷(三)重庆市綦江中学2018届高三高考适应性考试化学试题(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(押题专练)福建省三明第一中学2020届高三上学期期中考试化学试题四川省宜宾市叙州区第二中学2020届高三一诊模拟理综化学试题浙江省温州市龙湾中学2019-2020学年高二下学期第1次居家月考化学试题江西省景德镇一中2021届高三8月月考化学试题(已下线)第04章 电化学基础(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)
名校
3 . 一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色) N2O4(g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
N2O4(g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:

(1)曲线___ (填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)在0~3min内,用NO2表示的反应速率为___ 。
(3)若在一保温容器中加入一定量NO2,反应一段时间后,混合气体温度升高,说明2molNO2(g)的能量比1mol N2O4(g)的能量___ (填“高”或“低”)。
(4)反应达到平衡后,若降低温度,混合气体的颜色变浅,相对于降温前v(正)___ (填“增大”“减小”或“不变”,下同),v(逆)___ 。
(5)氮氧化物是重要的大气污染物,如图是监测NO含量的传感器工作原理示意图。NiO电极发生___ (填“氧化”或“还原”)反应,Pt电极是电池___ (填“正极”或“负极”)。

 N2O4(g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
N2O4(g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
(1)曲线
(2)在0~3min内,用NO2表示的反应速率为
(3)若在一保温容器中加入一定量NO2,反应一段时间后,混合气体温度升高,说明2molNO2(g)的能量比1mol N2O4(g)的能量
(4)反应达到平衡后,若降低温度,混合气体的颜色变浅,相对于降温前v(正)
(5)氮氧化物是重要的大气污染物,如图是监测NO含量的传感器工作原理示意图。NiO电极发生

您最近一年使用:0次
2021-10-10更新
|
328次组卷
|
2卷引用:广东省茂名高州市2020-2021学年高一下学期期末考试化学试题
名校
解题方法
4 . 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
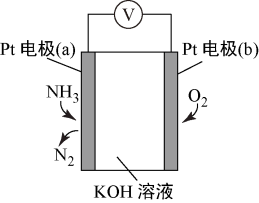
| A.O2在电极b上发生还原反应 |
| B.溶液中OH-向电极a移动 |
| C.反应消耗的NH3与O2的物质的量之比为4:5 |
| D.负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O |
您最近一年使用:0次
2021-08-06更新
|
1368次组卷
|
44卷引用:高中化学苏教2019版必修第二册-专题6 第三单元 第2课时 化学电源
高中化学苏教2019版必修第二册-专题6 第三单元 第2课时 化学电源湖南师范大学附属中学2020-2021学年高一下学期第一次月考化学试题陕西省黄陵中学2020-2021学年高一下学期期中考试化学试题河北省衡水中学2016-2017学年高一下学期期中考试化学试题湖北省荆州中学2016-2017学年高一下学期5月阶段测化学试题山西省祁县中学2017-2018学年高一下学期第一次月考化学试题【市级联考】湖北省天门市、潜江市、应城市2018-2019学年高一下学期期中联考化学试题山西省应县第一中学校2018-2019学年高一月考八(6月月考)化学试题山东省滕州市第一中学2019-2020学年高一下学期第一次月考化学试题甘肃省静宁县第一中学2019-2020学年高一下学期期中考试(第二次月考)化学试题选择性必修1(SJ)专题1第二单元课时2 化学电源广东省惠州市惠城区2021--2022学年高三上学期8月开学摸底化学试题(已下线)课时30 新型原电池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题19 原电池 化学电源(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练广西罗城仫佬族自治县高级中学2021-2022学年高二上学期开学检测化学试题内蒙古呼伦贝尔市满洲里市第一中学2021-2022学年高一下学期期末考试化学试题2015届北京市西城区高三二模理综化学试卷2016届广西柳铁一中高三上学期第一次月考理综化学试卷2015-2016学年北京市东城区高二下学期期末化学试卷2017届四川省射洪中学高三上学期入学考试化学试卷2017届广东省华侨中学高三上学期摸底考试理综化学试卷2017届湖北省荆、荆、襄、宜四地七校高三上联考一化学卷2016-2017学年安徽省合肥一中等名校高二上期末化学卷2017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷22016-2017学年湖北省鄂东南省级示范高中高二下学期期中联考化学试卷安徽省无为县2018届高三上学期第一次月考化学试题辽宁省营口中学2017-2018学年高二上学期期末考试化学试题河南省三门峡市2018届高三上学期期末考试化学试题【全国百强校】河北省武邑中学2019届高三上学期第三次调研考试化学试题【全国百强校】黑龙江省大庆实验中学2017-2018学年高二上学期期末考试化学试题【全国百强校】湖北省武汉市华中师范大学第一附属中学2018-2019学年高二上学期期末考试化学试题江苏省沭阳县修远中学、泗洪县淮北中学、洪翔中学2019-2020学年高二下学期联考化学试题天津市和平区2018-2019高二期末考试化学试题福建省连城县第一中学2020-2021学年高二上学期第一次月考化学试题北京市北大附中实验学校2020-2021学年高二上学期10月月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第2节 化学能转化为电能——电池 课时2 化学电源北京市理工大学附属中学2020-2021学年高二上学期10月月考化学试题广东省广州市执信中学2020-2021学年高二上学期9月月考化学试题青海省西宁市海湖中学2021届高三上学期第二阶段考试化学试题湖南省长沙市南雅中学2020-2021学年高二上学期第三次月考化学试题2017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷1四川省内江市第六中学2022-2023学年高三上学期入学考试化学试题 1.2.2化学电源 课中广东省湛江市第二中学2023届高三上学期第一次月考化学试题
名校
解题方法
5 . 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法正确的是( )
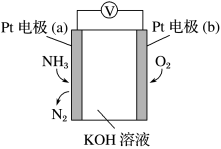

| A.O2在电极b上发生氧化反应 |
| B.溶液中OH-向电极b移动 |
| C.反应消耗的NH3与O2的物质的量之比为4:3 |
| D.正极的电极反应式为2NH3-6e-+6OH-=N2+6H2O |
您最近一年使用:0次
2020-05-28更新
|
666次组卷
|
11卷引用:吉林江城中学2020-2021学年高一下学期期末考试化学试题
吉林江城中学2020-2021学年高一下学期期末考试化学试题广东省广州市玉岩中学2020-2021学年高一下学期期中考试化学试题江苏省泰州中学2019-2020学年高一下学期期中考试化学试题山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题安徽省滁州市定远县民族中学2021-2022学年高二上学期9月质量检测化学试题江西省赣州市信丰县第一中学2021-2022学年高一下学期期中考试化学试题(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)山西省实验中学2021-2022学年高二上学期开学考试化学试题广东省茂名市第一中学2022-2023学年高一下学期期中考试化学试题(已下线)第05练 化学能与热能-2020年【衔接教材·暑假作业】新高二化学(人教版)江苏省扬州中学2020-2021学年高二上学期开学检测化学试题
解题方法
6 . 固体电解质可以通过离子迁移传递电荷,利用固体电解质RbAg4I5可以制成电化学气敏传感器,其中迁移的物种全是Ag+。下图是一种测定O2含量的气体传感器示意图,O2可以透过聚四氟乙烯薄膜,根据电池电动势变化可以测得O2的含量。在气体传感器工作过程中,下列有关说法正确的是
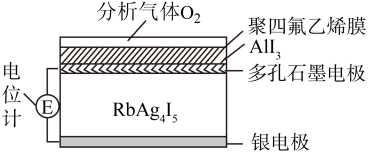

| A.银电极被消耗,RbAg4I5的量增多 |
| B.电位计读数越大,O2含量越高 |
| C.负极反应为Ag+I--e-= AgI |
| D.部分A1I3同体变为Al和AgI |
您最近一年使用:0次
2020-04-22更新
|
427次组卷
|
2卷引用:人教版2019必修第二册 第六章 第一节综合拔高练



