解题方法
1 . 下列说法错误的是
| A.原电池是利用氧化还原反应将化学能转化成电能的装置 |
| B.金属A与B用导线连接后插入稀硫酸中组成原电池时,A是正极,则B的金属性强于A |
| C.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
| D.对于反应N2(g)+3H2(g)⇌2NH3(g),单位时间里每增加1 mol N2,同时增加3 mol H2,说明反应达到化学平衡状态 |
您最近一年使用:0次
解题方法
2 . (1)如图是银锌原电池装置的示意图,请回答:
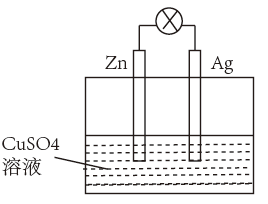
锌为___________ 极,该电极上发生___________ 反应(填“氧化”或“还原”),该电极的电极反应式为___________ ,总反应离子方程式为___________ 。
(2)如图为某原电池装置示意图,若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=FeCl2+CuCl2。
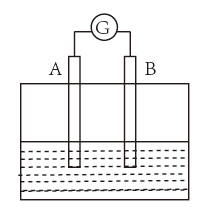
写出B的电极反应式___________ ;该电池在工作时,A电极的质量将___________ (填“增加”或“减少”或“不变”)。
(3)如图是一种氢气燃料电池的原理图:
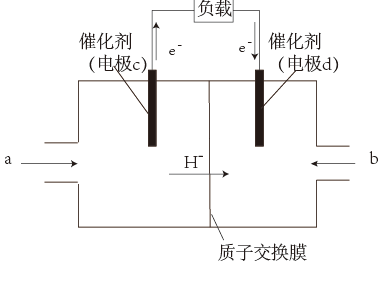
a极通入的气体是___________ ,正极的电极反应式为___________ 。

锌为
(2)如图为某原电池装置示意图,若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=FeCl2+CuCl2。

写出B的电极反应式
(3)如图是一种氢气燃料电池的原理图:

a极通入的气体是
您最近一年使用:0次
3 . 1909年,德国化学家哈伯经过反复实验研究发现工业合成氨的可能性。1913年,在德国工程师博施努力下,一个年产7000吨的合成氨工厂建成并投产,合成氨的工业化生产终于实现。因此,哈伯和博施都获得了诺贝尔化学奖。
键能:常温常压下,将1 mol理想气体分子AB拆开为中性气态原子A和B所需要的能量。请回答下列问题:
(1)根据上表中所给数据判断:N2(g)+3H2(g) 2NH3(g)为
2NH3(g)为___________ 热反应(填“放”或“吸”);
(2)下列措施中能加快合成氨反应速率的是___________ ;
A.升高温度 B.使用合适的催化剂 C.分离出生成的氨气
D.增大氮气的浓度 E.扩大容器体积
(3)在一个恒温恒容的密闭容器中,发生可逆反应N2(g)+3H2(g) 2NH3(g),下列情况能说明反应已达到化学平衡状态的是
2NH3(g),下列情况能说明反应已达到化学平衡状态的是___________ ;
A.混合气体的总质量不再改变 B.氨气的质量分数不再改变
C.N2、H2和NH3的物质的量之比为1:3:2 D.容器内压强保持不变
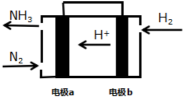
(4)为了提高合成氨的物料利用率和工作效率,科学家们正在制作合成氨原电池。右图为合成氨原电池的原理图,则电极a为___________ 极(填“正”或“负”)。
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
键能:常温常压下,将1 mol理想气体分子AB拆开为中性气态原子A和B所需要的能量。请回答下列问题:
(1)根据上表中所给数据判断:N2(g)+3H2(g)
 2NH3(g)为
2NH3(g)为(2)下列措施中能加快合成氨反应速率的是
A.升高温度 B.使用合适的催化剂 C.分离出生成的氨气
D.增大氮气的浓度 E.扩大容器体积
(3)在一个恒温恒容的密闭容器中,发生可逆反应N2(g)+3H2(g)
 2NH3(g),下列情况能说明反应已达到化学平衡状态的是
2NH3(g),下列情况能说明反应已达到化学平衡状态的是A.混合气体的总质量不再改变 B.氨气的质量分数不再改变
C.N2、H2和NH3的物质的量之比为1:3:2 D.容器内压强保持不变
(4)为了提高合成氨的物料利用率和工作效率,科学家们正在制作合成氨原电池。右图为合成氨原电池的原理图,则电极a为

您最近一年使用:0次
2021-05-13更新
|
264次组卷
|
3卷引用:浙江省七彩阳光新高考研究联盟2020-2021学年高一下学期期中联考化学试题
浙江省七彩阳光新高考研究联盟2020-2021学年高一下学期期中联考化学试题(已下线)专题06 化学反应速率和限度【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)浙江省舟山市南海实验高中2021-2022学年高一下学期4月月考化学试题
名校
解题方法
4 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___ (填字母)。
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2=2CO2(l)
(2)如图为原电池装置示意图:___ ,反应过程中溶液的酸性___ (填“变大”变小“或”不变“)。一段时间后,当在电池中放出1.68L(标准状况)气体时,电路中有___ 个电子通过了导线(设NA为阿伏加德罗常数的值)。
②若电池的总反应为2Fe3++Cu=2Fe2++Cu2+,负极材料是___ ,负极的电极反应式为___ 。
③若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为___ 极(填正或负);写出该电极电极反应式:__ 。
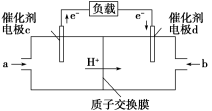
④燃料电池是一种具有应用前景的绿色电源,H2和O2组合形成的燃料电池的结构如图(电解液是稀硫酸):___ (填“正极”或“负极”),电极d的电极反应式为_____ 。若线路中转移2mol电子,则该燃科电池理论上消耗的O2在标准状况下的体积为___ L。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2=2CO2(l)
(2)如图为原电池装置示意图:
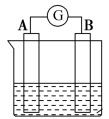
②若电池的总反应为2Fe3++Cu=2Fe2++Cu2+,负极材料是
③若A为镁片,B为铝片,电解质为NaOH溶液,则铝片为
④燃料电池是一种具有应用前景的绿色电源,H2和O2组合形成的燃料电池的结构如图(电解液是稀硫酸):
您最近一年使用:0次
2021-05-13更新
|
457次组卷
|
2卷引用:山东省实验中学2020~2021学年高一下学期期中考试化学试题
解题方法
5 . 近年来,有科学家在研究利用发电厂产生的SO2制成原电池,其电池反应方程式为2SO2+O2+2H2O=2H2SO4,
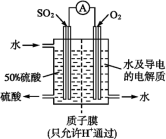
(1)O2是该电池的_______ 极(填“正”或“负”),其电极反应式为_______ ;
(2)电解质溶液中的H+通过质子膜_______ (填“向左”“向右”或“不”)移动;
(3)通入SO2的电极,其电极反应式为_______ 。

(1)O2是该电池的
(2)电解质溶液中的H+通过质子膜
(3)通入SO2的电极,其电极反应式为
您最近一年使用:0次
解题方法
6 . 铜锌原电池的简易装置如图所示

(1)该电池的负极材料是_______ ,发生_______ 反应(填“氧化”或“还原”);
(2)正极上出现的现象是_______ ,负极反应式:_______ ,正极反应式:_______ ;
(3)在外电路中,电子从_______ 极流向_______ 极,当导线有1mol电子通过时,理论上可收集标况下的H2 _______ L。

(1)该电池的负极材料是
(2)正极上出现的现象是
(3)在外电路中,电子从
您最近一年使用:0次
名校
解题方法
7 . 如下两个装置,一段时间后,下列叙述正确的是
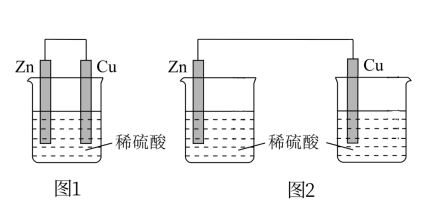

| A.图1装置中铜作原电池的正极,氢离子在铜表面被还原 |
| B.图2装置中电子由锌片经导线流向铜片 |
| C.图1装置中锌的质量减少,图2装置中锌的质量不变 |
| D.图1装置和图2装置均可以实现化学能转化为电能 |
您最近一年使用:0次
2021-05-06更新
|
288次组卷
|
2卷引用:天津市部分区2020-2021学年高一下学期期中考试化学试题
解题方法
8 . 氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上。其中一种氟离子电池的工作原理如下:3Mg+2BiF3 3MgF2+2Bi (
3MgF2+2Bi ( 为难溶盐),放电过程为原电池工作原理,电解质为熔融氟化物。下列说法正确的是
为难溶盐),放电过程为原电池工作原理,电解质为熔融氟化物。下列说法正确的是
 3MgF2+2Bi (
3MgF2+2Bi ( 为难溶盐),放电过程为原电池工作原理,电解质为熔融氟化物。下列说法正确的是
为难溶盐),放电过程为原电池工作原理,电解质为熔融氟化物。下列说法正确的是A.电池的负极反应式为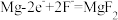 |
| B.放电时,电子从镁极流出,经电解质流向正极 |
| C.放电时,化学能完全转化为电能 |
| D.放电时,F-向正极移动 |
您最近一年使用:0次
9 . 研究化学反应中的能量变化,能更好地利用化学反应为生产和生活服务。
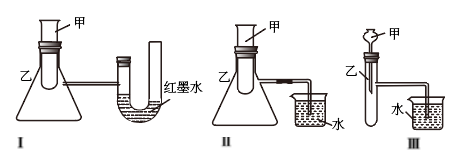
Ⅰ.反应Zn+H2SO4(稀)=ZnSO4+H2↑的能量变化如图所示。
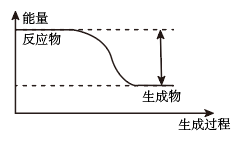
(1)该反应为___________ (填“吸热”或“放热”)反应。
(2)如图三个装置中,不能证明“锌与稀硫酸反应是吸热反应还是放热反应”的是_____ (填序号)
Ⅱ.图是某兴趣小组设计的原电池示意图
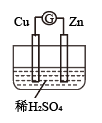
(3)下列实验叙述合理的是_______ (填序号)
A.Cu极有H2产生 B.锌作负极,发生还原反应
C.H+向Zn极移动 D.电子由Zn经导线流向Cu
(4)请写出该电池的正极反应式_________
(5)若有1mol电子流过导线,则理论上在标准状况下,产生H2的体积为______ L
(6)将稀H2SO4换成CuSO4溶液,电极质量增加的是______ (填“锌极”或“铜极”)。
Ⅰ.反应Zn+H2SO4(稀)=ZnSO4+H2↑的能量变化如图所示。

(1)该反应为
(2)如图三个装置中,不能证明“锌与稀硫酸反应是吸热反应还是放热反应”的是

Ⅱ.图是某兴趣小组设计的原电池示意图

(3)下列实验叙述合理的是
A.Cu极有H2产生 B.锌作负极,发生还原反应
C.H+向Zn极移动 D.电子由Zn经导线流向Cu
(4)请写出该电池的正极反应式
(5)若有1mol电子流过导线,则理论上在标准状况下,产生H2的体积为
(6)将稀H2SO4换成CuSO4溶液,电极质量增加的是
您最近一年使用:0次
10 . 原电池是直接把化学能转化为电能的装置。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)____ ;稀硫酸的作用是________ 。
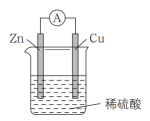
a.负极反应物 b.负极材料 c.正极反应物
d.正极材料 e.离子导体 f.电子导体
(2) ①在Cu-Zn原电池中,Zn片上发生________ 反应(填“氧化”或“还原”)。Cu片上发生的电极反应为________ 。
②外电路中电子流向_____ 极;内电路溶液中SO 移向
移向___ 极。
③能证明化学能转化为电能的实验现象为________ 。
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是__ 。

(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将________ ,并通过能导电的物质形成闭合回路,产生电流。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)

a.负极反应物 b.负极材料 c.正极反应物
d.正极材料 e.离子导体 f.电子导体
(2) ①在Cu-Zn原电池中,Zn片上发生
②外电路中电子流向
 移向
移向③能证明化学能转化为电能的实验现象为
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是

(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将
您最近一年使用:0次



