名校
1 . 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol·L-1的H2SO4溶液中,乙同学将电极放入6mol·L-1的NaOH溶液中,如图所示。
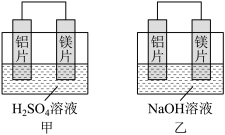
(1)写出甲中正极的电极反应式___ 。
(2)乙中负极的电极反应式为___ ,总反应的离子方程式:___ 。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则负极材料的金属应比正极材料的金属活泼”,则甲会判断出___ 金属活动性更强,而乙会判断出___ 金属活动性更强(填写元素符号)。
(4)由此实验得出的下列结论中,正确的有___ 。

(1)写出甲中正极的电极反应式
(2)乙中负极的电极反应式为
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则负极材料的金属应比正极材料的金属活泼”,则甲会判断出
(4)由此实验得出的下列结论中,正确的有
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
您最近一年使用:0次
名校
解题方法
2 . 某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转,请回答以下问题:
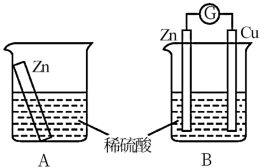
(1)装置B中Zn电极是___________ (填“正”或“负”)极,Zn电极上的电极反应式为___________ ,Cu电极上的现象是___________ 。
(2)从能量转化的角度来看,装置A中反应物的总能量___________ (填“大于”,“小于”或“等于”)生成物的总能量。
(3)装置B中稀硫酸用足量硫酸铜溶液代替,溶液中Cu2+向___________ (填“左”或“右”)移动,起始时锌电极和铜电极的质量相等,当导线中有0.2mol电子转移时,铜电极和锌电极的质量差为___________ 。
(4)该小组同学由此得到的结论正确的是___________(填标号)。

(1)装置B中Zn电极是
(2)从能量转化的角度来看,装置A中反应物的总能量
(3)装置B中稀硫酸用足量硫酸铜溶液代替,溶液中Cu2+向
(4)该小组同学由此得到的结论正确的是___________(填标号)。
| A.原电池反应的过程中一定有电子转移 |
| B.原电池装置中2个电极的电极材料一定不同 |
| C.电极一定不能参加反应 |
| D.氧化反应和还原反应可以拆开在两极发生 |
您最近一年使用:0次
3 . 回答下列问题
I.某温度下,在2L容器中三种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。
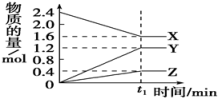
(1)该反应的化学方程式是___________
(2)在t1min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___________。
(3)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1mol氨气分解成氮气和氢气要吸收46kJ的热量,则至t1min时,该反应吸收的热量为___________ ;用N2表示这段时间内该反应的平均速率v=___________ 。(用含t1的式子表示)
II.如图所示,组成一个原电池。
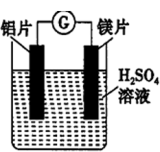
(4)当电解质溶液为稀硫酸时,镁片的电极是___________ 极(填“正”或“负”),其中铝片上电极反应式___________ ,外电路中的电子是___________ 极流向___________ 极。(填“铝片”或“镁片”)
(5)当电解质溶液为氢氧化钠溶液时,镁片电极是___________ 极(填“正”或“负”),该反应是___________ (填“氧化”或“还原”)反应。
I.某温度下,在2L容器中三种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。

(1)该反应的化学方程式是
(2)在t1min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___________。
| A.X、Y、Z的反应速率相等 |
| B.X、Y的反应速率比为2∶3 |
| C.Z的物质的量不在变化 |
| D.生成3molY的同时生成1molZ |
II.如图所示,组成一个原电池。

(4)当电解质溶液为稀硫酸时,镁片的电极是
(5)当电解质溶液为氢氧化钠溶液时,镁片电极是
您最近一年使用:0次
2021-08-31更新
|
238次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2020-2021学年高一下期期末测试理科化学试题
解题方法
4 . 如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是
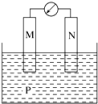

| 选项 | M | N | P |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铜 | 铁 | 浓硝酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 铝 | 铁 | 硝酸铁溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 汽车的启动电源常用铅酸蓄电池,该电池在放电时的总反应方程式为:PbO2(s)+Pb(s)+ 2H2SO4(aq)=2PbSO4(s)+2H2O(l),根据此反应判断下列叙述正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为Pb −2e- =Pb2+ |
| C.铅酸蓄电池放电时,每转移2 mol电子消耗1 mol H2SO4 |
| D.电池放电时,两电极质量均增加,且每转移1 mol电子正极质量增加32g |
您最近一年使用:0次
2021-08-26更新
|
235次组卷
|
2卷引用:黑龙江省齐齐哈尔市2020-2021学年高一下学期期末考试化学试题
解题方法
6 . 探究原电池原理并应用原电池原理制作多种电池,对现实生活具有重要的意义。
(1)某化学兴趣小组为了探究铝电极在原电池中的作用时,设计了如下实验:
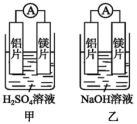
①甲、乙两装置工作时,电流计指针的偏转方向是否相同?_______ 。乙装置中负极的电极反应式是_______ 。
②根据上述实验结果分析,下列说法正确的是__________
a.构成原电池负极的金属总是比正极活泼
b.镁的金属活泼性不一定比铝的强
c.金属在原电池中作正极还是负极,既与金属活泼性有关,还与电解质溶液的成分有关
(2)铅酸蓄电池是常见的二次电池,放电时发生反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。该电池的负极材料为_______ ;该电池充电时,其能量转化形式为_______ 。
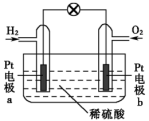
(3)氢氧燃料电池具有清洁、安全、高效的特点,其简易装置如图所示:铂电极b上的电极反应式为_______ ,室温下,若该电池消耗1molH2时可提供电能257.4kJ的能量,则该燃料电池的能量转化率为_______ 。(已知:室温下,1molH2完全燃烧生成液态水时,释放286.0kJ的能量。)
(1)某化学兴趣小组为了探究铝电极在原电池中的作用时,设计了如下实验:

①甲、乙两装置工作时,电流计指针的偏转方向是否相同?
②根据上述实验结果分析,下列说法正确的是
a.构成原电池负极的金属总是比正极活泼
b.镁的金属活泼性不一定比铝的强
c.金属在原电池中作正极还是负极,既与金属活泼性有关,还与电解质溶液的成分有关
(2)铅酸蓄电池是常见的二次电池,放电时发生反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。该电池的负极材料为
(3)氢氧燃料电池具有清洁、安全、高效的特点,其简易装置如图所示:铂电极b上的电极反应式为

您最近一年使用:0次
名校
解题方法
7 . 质量相同的铁棒、碳棒和足量CuCl2溶液组成的装置如图所示,下列说法正确的是
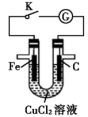

| A.闭合K,电子通过CuCl2溶液移到碳棒上 |
| B.闭合K,铁棒表面发生的电极反应为Cu2++2e-=Cu |
| C.闭合K,转移电子0.2mol时,理论上碳棒与铁棒的质量差为12g |
| D.打开K,与闭合K时发生的总反应相同 |
您最近一年使用:0次
2021-08-23更新
|
399次组卷
|
3卷引用:山东省聊城市2020-2021学年高一下学期期末考试化学试题
解题方法
8 . 下列关于下图所示的装置的叙述,错误的是


| A.铜是正极,其质量不变 |
| B.电子从锌极沿导线流向铜极 |
| C.铜极上发生氧化反应 |
| D.铜极的电极反应式为2H++2e-=H2↑ |
您最近一年使用:0次
2021-08-17更新
|
248次组卷
|
2卷引用:广东省惠州市2020-2021学年高一下学期期末考试化学试题
名校
解题方法
9 . 一种肼(N2H4)—空气碱性燃料电池工作原理如图所示。下列说法错误的是
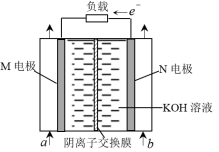

| A.a为空气,b为N2H4 |
| B.M为正极,电极反应为O2+4e-+4H+=2H2O |
| C.电路中通过1mole-时,同时有1molOH-从左室通过阴离子交换膜移到右室 |
| D.当有16gN2H4完全反应生成N2,消耗标准状况下11.2LO2 |
您最近一年使用:0次
2021-08-03更新
|
558次组卷
|
4卷引用:山东省威海市2020-2021学年高一下学期期末考试化学试题
山东省威海市2020-2021学年高一下学期期末考试化学试题(已下线)单科化学-2021年秋季高三开学摸底考试卷03(课标全国专用)(已下线)专题19 原电池 化学电源(限时精练)-2022年高三毕业班化学常考点归纳与变式演练广东省珠海市斗门区第一中学2023-2024学年高三上学期11月阶段性考试化学试卷
名校
解题方法
10 . 银锌纽扣电池的电池反应式为:Zn+ Ag2O+H2O =Zn(OH)2+2Ag,据此判断氧化银是
| A.负极,并被氧化 |
| B.正极,并被氧化 |
| C.负极,并被还原 |
| D.正极,并被还原 |
您最近一年使用:0次



