名校
1 . 我国科研人员将单独脱除SO2的反应与H2O2的制备反应相结合,实现协同转化。
①单独制备H2O2:2H2O+O2=2H2O2,不能自发进行
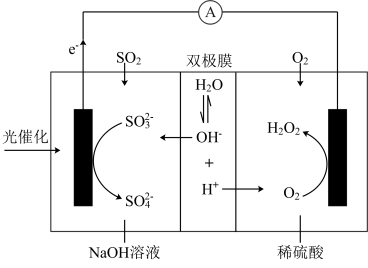
②单独脱除SO2:4OH-+2SO2+O2=2SO +2H2O,能自发进行协同转化装置如图所示,在电场作用下,双极膜中间层的H2O解离为OH-和H+,并向两极迁移。下列叙述错误的是
+2H2O,能自发进行协同转化装置如图所示,在电场作用下,双极膜中间层的H2O解离为OH-和H+,并向两极迁移。下列叙述错误的是
①单独制备H2O2:2H2O+O2=2H2O2,不能自发进行
②单独脱除SO2:4OH-+2SO2+O2=2SO
 +2H2O,能自发进行协同转化装置如图所示,在电场作用下,双极膜中间层的H2O解离为OH-和H+,并向两极迁移。下列叙述错误的是
+2H2O,能自发进行协同转化装置如图所示,在电场作用下,双极膜中间层的H2O解离为OH-和H+,并向两极迁移。下列叙述错误的是
A.负极区域存在反应为SO2+2OH-= +H2O +H2O |
| B.双极膜中间层的H2O的解离可不断提供OH-和H+,故不需要补加H2SO4 |
| C.协同转化总反应为SO2+O2+2NaOH=H2O2+Na2SO4 |
| D.当正极生成1molH2O2时,负极区域的溶液质量增重64g |
您最近一年使用:0次
2022-09-30更新
|
332次组卷
|
3卷引用:角度3 有机电化学装置
名校
解题方法
2 . 有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,所用装置如图所示,下列说法正确的是
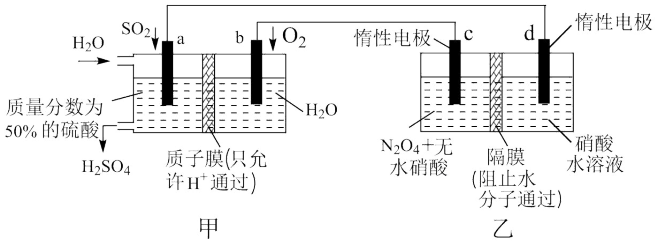

| A.图中的甲池为电解池,乙池为原电池 |
| B.N2O5在c极上产生,c极的电极反应为N2O4-2e-+H2O=N2O5+2H+ |
C.a极发生的电极反应为SO2-2e-+2H2O= +4H+ +4H+ |
| D.每转移2mol电子,生成1molN2O5和1molH2SO4 |
您最近一年使用:0次
2022-02-13更新
|
1219次组卷
|
3卷引用:江西省宜春市丰城中学2023-2024学年高二上学期10月月考化学试题
解题方法
3 . 物质的化学能可以在不同的条件下转化为热能、电能被人类利用。按要求回答下列问题。
(1)微生物电池是指在微生物作用下将化学能转化为电能的装置。其工作原理如下图所示。
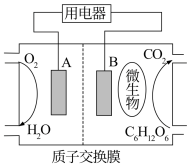
①A为生物燃料电池的_______ (填“正”或“负”)极。
②负极的电极反应式为_______ 。
③放电过程中, 由
由_______ 极区向_______ 极区迁移(填“正”或“负”)。
(2)用阴离子交换膜控制电解液中 的浓度制备纳米
的浓度制备纳米 。反应为
。反应为 ,装置如图。
,装置如图。
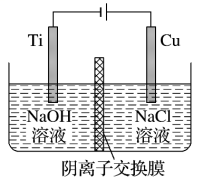
①电解时_______ 通过阴离子交换膜向_______ 极移动。
②阳极电极反应式为_______ 。
③阴极电极反应式为_______ 。
(3)我国科研人员研制出的可充电“ ”电池,以钠箔和多壁碳纳米管(
”电池,以钠箔和多壁碳纳米管(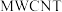 )为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为
)为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为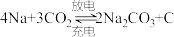 。放电时该电池“吸入”
。放电时该电池“吸入” 。
。
①放电时,正极的电极反应式为_______ 。
②可选用高氯酸钠-四甘醇二甲醚作电解液的理由是_______ 。
(1)微生物电池是指在微生物作用下将化学能转化为电能的装置。其工作原理如下图所示。

①A为生物燃料电池的
②负极的电极反应式为
③放电过程中,
 由
由(2)用阴离子交换膜控制电解液中
 的浓度制备纳米
的浓度制备纳米 。反应为
。反应为 ,装置如图。
,装置如图。
①电解时
②阳极电极反应式为
③阴极电极反应式为
(3)我国科研人员研制出的可充电“
 ”电池,以钠箔和多壁碳纳米管(
”电池,以钠箔和多壁碳纳米管(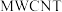 )为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为
)为电极材料,可选用高氯酸钠-四甘醇二甲醚作电解液。总反应方程式为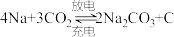 。放电时该电池“吸入”
。放电时该电池“吸入” 。
。①放电时,正极的电极反应式为
②可选用高氯酸钠-四甘醇二甲醚作电解液的理由是
您最近一年使用:0次
名校
解题方法
4 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积变化,下列说法正确的是
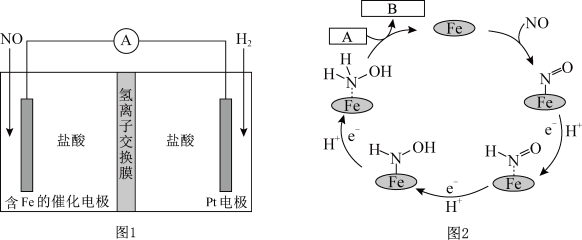

| A.电池工作时,Pt电极是正极 |
| B.图2中,A为H+和e-,B为NH3OH+ |
| C.电池工作时,每消耗2.24LNO(标准状况下),左室溶液质量增加3.3g |
| D.电池工作一段时间后,正、负极区溶液的pH均下降 |
您最近一年使用:0次
2022-04-20更新
|
2116次组卷
|
14卷引用:湖南省郴州市2023届高三下学期第三次教学质量监测化学试题
湖南省郴州市2023届高三下学期第三次教学质量监测化学试题江苏省镇江中学2022-2023学年高一下学期期中考试化学试题湖南省常德市第一中学2022-2023学年高三下学期5月月考化学试题江苏省常州市第一中学2022-2023学年高一下学期期末测试化学试题福建省漳州第一中学2023届高三下学期毕业班质检考化学试题福建省南平第一中学2023-2024学年高三上学期第二次阶段考化学试题江苏省前黄高级中学2023-2024学年高三上学期期中适应性考试化学试题福建省厦门第一中学2023-2024学年高二上学期10月月考试化学试题福建省福州市2022届高中毕业班(3月)第二次质量检测化学试题湖南省大联考雅礼十六校2021-2022学年高三第二次联考化学试题(已下线)秘籍12 原电池原理及应用-备战2022年高考化学抢分秘籍(全国通用)河北省石家庄市第二中学2022届高三下学期5月模拟考试化学试题江苏省南京市第十三中学2022届高三下学期适应性考试化学试题江苏省南京市雨花台中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
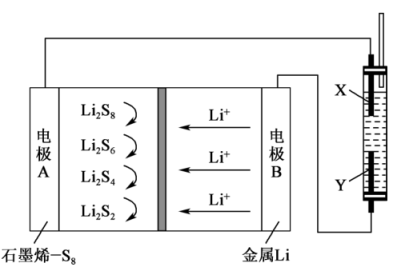
5 . 用石墨烯锂硫电池电解制备 的装置如图所示。电池放电时的反应为
的装置如图所示。电池放电时的反应为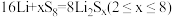 ,电解池两极材料分别为
,电解池两极材料分别为 和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是
和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是
 的装置如图所示。电池放电时的反应为
的装置如图所示。电池放电时的反应为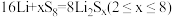 ,电解池两极材料分别为
,电解池两极材料分别为 和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是
和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是
| A.Y是铁电极,发生氧化反应 |
B.电子流动的方向: |
C.正极可发生反应: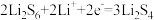 |
D.锂电极减重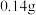 时,则电路中转移 时,则电路中转移 电子 电子 |
您最近一年使用:0次
2021-12-30更新
|
429次组卷
|
3卷引用:辽宁省锦州市渤海大学附属高级中学2022-2023学年高二上学期期末考试化学试题
6 . 氧化还原反应可拆分为氧化和还原两个“半反应”。某小组同学从“半反应”的角度探究反应规律。
(1)已知:IO +I-→I2的转化在酸性条件下才能发生。
+I-→I2的转化在酸性条件下才能发生。
①该转化的还原半反应是2IO +10e-+12H+=I2+6H2O,则相应的氧化半反应是
+10e-+12H+=I2+6H2O,则相应的氧化半反应是_______ 。
②分析上述还原半反应可知:增大c(H+)可促进IO 得到电子,使其
得到电子,使其_______ 性增强,进而与I-发生反应
(2)探究Cu与浓盐酸能否发生反应。
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是_______ 。
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
②甲是对比实验,目的是排除_______ 的干扰。
③a.丙中气球变鼓是因为生成了_______ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在[CuCl4]3-。从氧化还原性的角度分析丙中反应能够发生的原因:_______ 。
(3)探究以下原电池的工作原理。
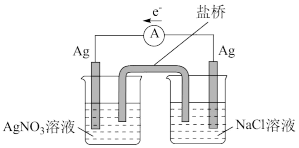
实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作_______ (填“正”或“负”)极。
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:_______ 。
(1)已知:IO
 +I-→I2的转化在酸性条件下才能发生。
+I-→I2的转化在酸性条件下才能发生。①该转化的还原半反应是2IO
 +10e-+12H+=I2+6H2O,则相应的氧化半反应是
+10e-+12H+=I2+6H2O,则相应的氧化半反应是②分析上述还原半反应可知:增大c(H+)可促进IO
 得到电子,使其
得到电子,使其(2)探究Cu与浓盐酸能否发生反应。
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 | Cu粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 | Cu粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在[CuCl4]3-。从氧化还原性的角度分析丙中反应能够发生的原因:
(3)探究以下原电池的工作原理。

实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:
您最近一年使用:0次



