名校
解题方法
1 . 如图所示,是原电池的装置图。请回答:___________ ; 在反应中溶液中的阴离子移向___________ (填“A”或“B”),反应进行一段时间后溶液C的pH___________ (填“升高”“降低”或“基本不变”)
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为___________ , B极电极反应式为___________ 。
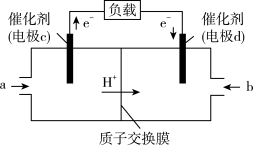
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:___________ (填“正极”或“负极”),若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为___________ L。
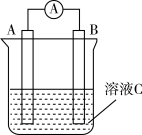
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
您最近一年使用:0次
2023-08-31更新
|
663次组卷
|
2卷引用:陕西省商洛市洛南中学2022-2023学年高一下学期4月期中考试化学试题
2 . 工业电解食盐水制备烧碱的装置如图所示(PR电极均为惰性电极),下列说法错误的是
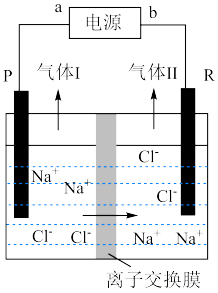

| A.该离子交换膜为阳离子交换膜 | B.b为电源的正极 |
| C.气体Ⅰ为Cl2 | D.R电极上发生还原反应 |
您最近一年使用:0次
2023-10-03更新
|
112次组卷
|
2卷引用:【定心卷】4.2.2 电解原理的应用随堂练习 -人教版2023-2024学年选择性必修1
3 . 原电池是利用氧化还原反应设计的装置,该装置的特点是使氧化反应和还原反应在两个电极进行,“迫使”电子沿着特定的路线移动,从而产生电能。甲、乙两个原电池装置如图所示:
(1)若装置甲的溶液M为稀硫酸,两个电极采用镁棒和铝棒。
①电极X为_______ (填“正极”或“负极”),该电极反应式为_______ 。
②该电池的正极是_______ (填“镁棒”或“铝棒”),该电极产物W是_______ (填化学式)。
③该原电池总反应的化学方程式是_______ 。
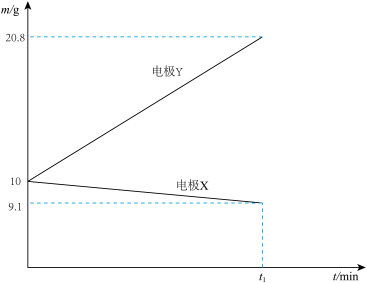
(2)若装置甲中两电极质量变化与时间的关系如图所示,其中一个电极为Ag电极,则该电池的电解质溶液为_______ (填化学式)溶液,电极X为_______ (填字母)
(3)将(1)中原电池生成的气体产物W通入装置乙中可制备燃料电池。
①正极为_______ (填“电极甲”或“电极乙”),该电极发生_______ (填“氧化反应”或“还原反应”)。
②该电池工作时,外电路中电子由_______ (填“电极甲”或“电极乙”,下同)流出;电解质溶液中的 移向
移向_______ 。
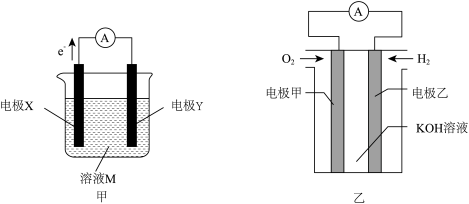
(1)若装置甲的溶液M为稀硫酸,两个电极采用镁棒和铝棒。
①电极X为
②该电池的正极是
③该原电池总反应的化学方程式是
(2)若装置甲中两电极质量变化与时间的关系如图所示,其中一个电极为Ag电极,则该电池的电解质溶液为
(3)将(1)中原电池生成的气体产物W通入装置乙中可制备燃料电池。
①正极为
②该电池工作时,外电路中电子由
 移向
移向
您最近一年使用:0次
2023-08-20更新
|
266次组卷
|
5卷引用:海南省部分学校2022-2023学年高一下学期7月期末考试化学试题
海南省部分学校2022-2023学年高一下学期7月期末考试化学试题(已下线)猜想04 化学反应与热能、电能(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)清单03 化学反应与能量(考点清单)(讲+练)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)专题02 化学反应与能量变化-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)(已下线)重难点03 原电池的工作原理与相关判断-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
2023高三·全国·专题练习
解题方法
4 . 回答下列问题:
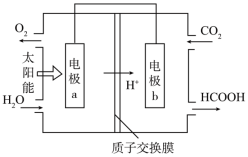
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b表面发生的电极反应为______ 。
(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。
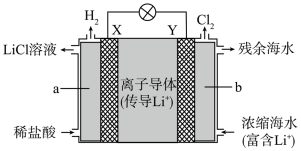
Y电极反应式为______ 。
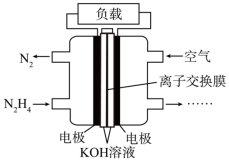
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为______ ;正极反应式为______ 。
(1)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极b表面发生的电极反应为

(2)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能。

Y电极反应式为
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为

您最近一年使用:0次
名校
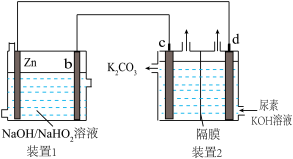
5 . 目前研究较多的Zn-H2O2电池,其电池总反应为Zn+OH-+HO =ZnO
=ZnO +H2O。现以Zn-H2O2电池电解尿素[CO(NH2)2]碱性溶液制备氢气,同时获得N2及极少量O2(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法错误的是
+H2O。现以Zn-H2O2电池电解尿素[CO(NH2)2]碱性溶液制备氢气,同时获得N2及极少量O2(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法错误的是
 =ZnO
=ZnO +H2O。现以Zn-H2O2电池电解尿素[CO(NH2)2]碱性溶液制备氢气,同时获得N2及极少量O2(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法错误的是
+H2O。现以Zn-H2O2电池电解尿素[CO(NH2)2]碱性溶液制备氢气,同时获得N2及极少量O2(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法错误的是
| A.装置1中OH-移向Zn电极 |
| B.反应过程中,d极附近的pH增大 |
C.电极c的主要反应式为CO(NH2)2-6e-+8OH-=CO +N2+6H2O +N2+6H2O |
| D.通电一段时间后,若Zn电极的质量减轻19.5g,则c电极产生N22.24L(标准状况) |
您最近一年使用:0次
22-23高一下·广东深圳·期中
名校
6 . 电池是人类生产和生活中的重要能量来源。人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。
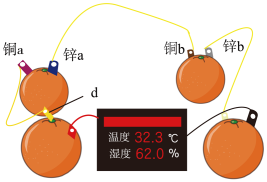
(1)知识源于实践。学习原电池知识后,某学习小组以 和
和 为电极材料,制作了如图所示的水果电池(水果果汁中含游离的
为电极材料,制作了如图所示的水果电池(水果果汁中含游离的 )。该组电池放电时,下列说法正确的是_______(填字母)。
)。该组电池放电时,下列说法正确的是_______(填字母)。
(2)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是_______(填字母)。
(3)将 设计成燃料电池,共利用率更高,装置如图所示(
设计成燃料电池,共利用率更高,装置如图所示( 、
、 为多孔碳棒)
为多孔碳棒)
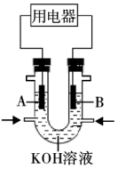
实验测得电子定向移向 电极,则
电极,则_______ (填“ ”或“
”或“ ”)电极入口通甲烷,其电极反应式为
”)电极入口通甲烷,其电极反应式为_______ 。
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为: ,请回答下列问题:
,请回答下列问题:
①放电时,正极反应式为_______ 。
②放电时,负极附近溶液的碱性_______ 。(填“增强”或“减弱”)
(5) 与
与 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如图:
组合形成的质子交换膜燃料电池的结构示意图如图:
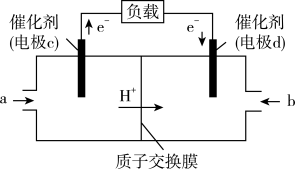
电池总反应为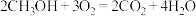 ,则
,则 电极反应式为
电极反应式为_______ ,若线路中转移 电子,则上述
电子,则上述 燃料电池,消耗的
燃料电池,消耗的 的质量为
的质量为_______  。
。
(1)知识源于实践。学习原电池知识后,某学习小组以
 和
和 为电极材料,制作了如图所示的水果电池(水果果汁中含游离的
为电极材料,制作了如图所示的水果电池(水果果汁中含游离的 )。该组电池放电时,下列说法正确的是_______(填字母)。
)。该组电池放电时,下列说法正确的是_______(填字母)。
A.每个水果果汁中的 移向正极 移向正极 |
B.锌 、 、 发生的电极反应式为 发生的电极反应式为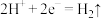 |
C.四个水果电池串联,则电极 为铜片 为铜片 |
D.铜 为电池正极,发生氧化反应 为电池正极,发生氧化反应 |
| A.锌锰电池工作一段时间后碳棒会变细 |
| B.氢氧燃料电池具有高效的特点,能量转化率可达100% |
| C.太阳能电池的主要材料是高纯度的二氧化硅 |
D.铅蓄电池负极是 ,正极是 ,正极是 |
 设计成燃料电池,共利用率更高,装置如图所示(
设计成燃料电池,共利用率更高,装置如图所示( 、
、 为多孔碳棒)
为多孔碳棒)
实验测得电子定向移向
 电极,则
电极,则 ”或“
”或“ ”)电极入口通甲烷,其电极反应式为
”)电极入口通甲烷,其电极反应式为(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为:
 ,请回答下列问题:
,请回答下列问题:①放电时,正极反应式为
②放电时,负极附近溶液的碱性
(5)
 与
与 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如图:
组合形成的质子交换膜燃料电池的结构示意图如图:
电池总反应为
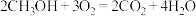 ,则
,则 电极反应式为
电极反应式为 电子,则上述
电子,则上述 燃料电池,消耗的
燃料电池,消耗的 的质量为
的质量为 。
。
您最近一年使用:0次
名校
7 . 按要求回答问题:
(1)由SiO2制备高纯度硅的工业流程如图所示:
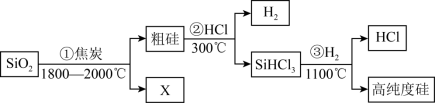
①写出SiO2转化为Si(粗)的化学方程式:____________________________________________ 。
②可以循环使用的物质为_________________________ 。
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
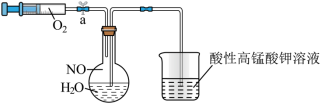
①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是____________ ,产生此现象的化学方程式为______________________________________________ 。
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式________________________________ 。
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向________ 极移动(填“正”或“负”)。
②若有 1 mol e- 流过导线,则理论上负极质量减少________ g。
③若将稀硫酸换成浓硝酸,正极电极方程式为:______________________ 。
(1)由SiO2制备高纯度硅的工业流程如图所示:

①写出SiO2转化为Si(粗)的化学方程式:
②可以循环使用的物质为
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。

①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向
②若有 1 mol e- 流过导线,则理论上负极质量减少
③若将稀硫酸换成浓硝酸,正极电极方程式为:
您最近一年使用:0次
2023-05-18更新
|
326次组卷
|
2卷引用:陕西延安中学2022-2023学年高一下学期期中考试化学试题
解题方法
8 . 化学反应在发生物质变化的同时伴随有能量的变化,是人类获取能量的重要途径。
Ⅰ.氢能是理想的能源之一。回答下列问题:
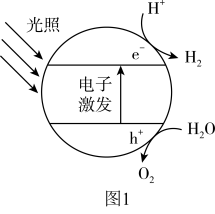
(1)利用太阳能催化光解水是制备 的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为_______ 。
(2)在高温时,水蒸气与灼热的炭反应也能制得 。该反应的能量变化如图2所示。
。该反应的能量变化如图2所示。
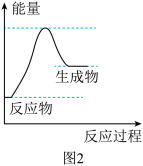
①该反应为_______ (填“吸热”或“放热”)反应。下列有关该反应的说法正确的是_______ (填字母)。
a.反应物的总能量高于产物的总能量
b.该反应过程中化学能全部转化为热能
c.该反应属于氧化还原反应
d.反应过程中,化学键的断裂与形成是化学反应中能量变化的主要原因
② 、
、 、C都是常用的燃料。
、C都是常用的燃料。 、
、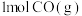 、
、 完全燃烧生成
完全燃烧生成 或
或 时,放出的热量分别为
时,放出的热量分别为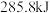 、
、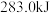 、
、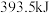 。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为
。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为_______ (用化学式表示)。
Ⅱ.原电池是将化学能转化为电能的一种装置。
常温下,将除去表面氧化膜的铝片、铜片插入浓 中组成原电池,装置如图甲所示,测得原电池的电流强度
中组成原电池,装置如图甲所示,测得原电池的电流强度 随时间
随时间 的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。

(3)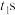 后,原电池的铜片是
后,原电池的铜片是_______ (填“正”或“负”)极,其电极反应式为_______ ,溶液中的 向
向_______ (填“正”或“负”)极移动。
Ⅰ.氢能是理想的能源之一。回答下列问题:
(1)利用太阳能催化光解水是制备
 的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
的方法之一,其原理如图1所示,光解水中能量的转化形式为光能转化为
(2)在高温时,水蒸气与灼热的炭反应也能制得
 。该反应的能量变化如图2所示。
。该反应的能量变化如图2所示。
①该反应为
a.反应物的总能量高于产物的总能量
b.该反应过程中化学能全部转化为热能
c.该反应属于氧化还原反应
d.反应过程中,化学键的断裂与形成是化学反应中能量变化的主要原因
②
 、
、 、C都是常用的燃料。
、C都是常用的燃料。 、
、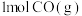 、
、 完全燃烧生成
完全燃烧生成 或
或 时,放出的热量分别为
时,放出的热量分别为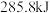 、
、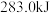 、
、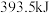 。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为
。相同质量的这三种燃料完全燃烧时放出的热量由大到小的顺序为Ⅱ.原电池是将化学能转化为电能的一种装置。
常温下,将除去表面氧化膜的铝片、铜片插入浓
 中组成原电池,装置如图甲所示,测得原电池的电流强度
中组成原电池,装置如图甲所示,测得原电池的电流强度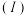 随时间
随时间 的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
的变化如图乙所示,反应过程中有红棕色气体产生。后,外电路中电子的流动方向发生改变。
(3)
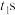 后,原电池的铜片是
后,原电池的铜片是 向
向
您最近一年使用:0次
名校
9 .  是一种黄色黏稠的油状液体(其中N显负价),可利用惰性电极电解制备,装置如图所示,其原理是
是一种黄色黏稠的油状液体(其中N显负价),可利用惰性电极电解制备,装置如图所示,其原理是 ,下列说法错误的是
,下列说法错误的是
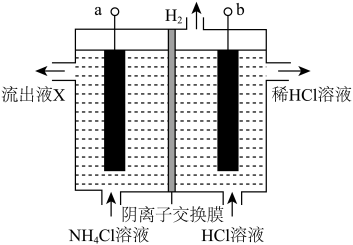
 是一种黄色黏稠的油状液体(其中N显负价),可利用惰性电极电解制备,装置如图所示,其原理是
是一种黄色黏稠的油状液体(其中N显负价),可利用惰性电极电解制备,装置如图所示,其原理是 ,下列说法错误的是
,下列说法错误的是
| A.b电极接电源的负极 | B.阳极区被氧化的元素为 |
C.流出液X中不含 | D.每生成 ,约有 ,约有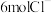 通过阴离子交换膜 通过阴离子交换膜 |
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题
(1)如图所示是一种原电池的装置图。请回答:
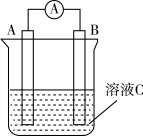
若溶液C为氯化铁溶液,电流表指针发生偏转,A、B电极材料分别为铜和银,则A、B电极上发生的电极反应分别为___________ 、___________
(2) 与
与 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如图所示:
组合形成的质子交换膜燃料电池的结构示意图如图所示:

电池总反应为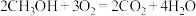 ,a口通入的物质是
,a口通入的物质是___________ ,若线路中转移 电子,则消耗的
电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为___________ L。
(3)家用液化气中主要成分之一是丁烷。当 丁烷气体完全燃烧并生成
丁烷气体完全燃烧并生成 和气态水时,放出热量
和气态水时,放出热量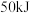 。每摩尔水气化时吸收
。每摩尔水气化时吸收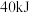 的热量,试写表示丁烷燃烧热的热化学方程式:
的热量,试写表示丁烷燃烧热的热化学方程式:___________ 。
(1)如图所示是一种原电池的装置图。请回答:

若溶液C为氯化铁溶液,电流表指针发生偏转,A、B电极材料分别为铜和银,则A、B电极上发生的电极反应分别为
(2)
 与
与 反应还可制备
反应还可制备 ,
, 可作为燃料使用,用
可作为燃料使用,用 和
和 组合形成的质子交换膜燃料电池的结构示意图如图所示:
组合形成的质子交换膜燃料电池的结构示意图如图所示:
电池总反应为
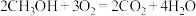 ,a口通入的物质是
,a口通入的物质是 电子,则消耗的
电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为(3)家用液化气中主要成分之一是丁烷。当
 丁烷气体完全燃烧并生成
丁烷气体完全燃烧并生成 和气态水时,放出热量
和气态水时,放出热量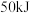 。每摩尔水气化时吸收
。每摩尔水气化时吸收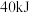 的热量,试写表示丁烷燃烧热的热化学方程式:
的热量,试写表示丁烷燃烧热的热化学方程式:
您最近一年使用:0次



