名校
解题方法
1 .  是一种绿色能源,一种
是一种绿色能源,一种 燃料电池工作原理如图所示。下列说法正确的是
燃料电池工作原理如图所示。下列说法正确的是
 是一种绿色能源,一种
是一种绿色能源,一种 燃料电池工作原理如图所示。下列说法正确的是
燃料电池工作原理如图所示。下列说法正确的是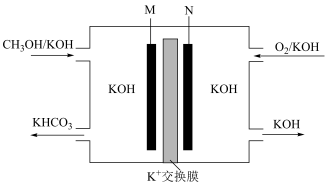
A.放电时, 从交换膜右侧向左侧移动 从交换膜右侧向左侧移动 |
B.放电过程中右侧溶液的 减小 减小 |
C.每生成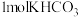 ,理论上消耗 ,理论上消耗 |
D.负极电极反应式为 |
您最近一年使用:0次
2024-04-19更新
|
286次组卷
|
2卷引用:甘肃省2024届高三普通高中三模化学试卷
名校
2 . 氢气不仅是新能源,也是重要的化工原料。
(1)氢气可由甲烷制备: 。已知
。已知 时,
时,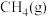 、
、 的燃烧热分别为
的燃烧热分别为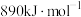 、
、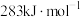 。写出氢气燃烧热的热化学方程式:
。写出氢气燃烧热的热化学方程式:_______ 。
(2)利用反应 合成清洁能源
合成清洁能源 ,CO的平衡转化率与温度的关系如图所示:
,CO的平衡转化率与温度的关系如图所示:

①该可逆反应的正反应
_______ 0;压强
_______  (均填“>”“<”或“=”)。
(均填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_______ (填字母)。
a. 物质的量保持不变
物质的量保持不变
b.单位时间内消耗 的浓度和生成甲醇的浓度相等
的浓度和生成甲醇的浓度相等
c.混合气体的压强不再变化
d.混合气体的密度不再变化
③在 恒容密闭容器中充入
恒容密闭容器中充入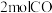 和
和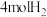 ,在
,在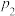 和
和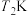 条件下经
条件下经 达到平衡状态C点,在该条件下,平衡常数
达到平衡状态C点,在该条件下,平衡常数 为
为_______ 。
(3)电池的比能量与消耗单位质量还原剂时转移的电子数成正比。理论上,H2、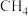 、
、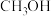 的酸性燃料电池的比能量由大到小排序为
的酸性燃料电池的比能量由大到小排序为_______ ,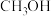 的酸性燃料电池的负极电极反应式为
的酸性燃料电池的负极电极反应式为_______ 。
(1)氢气可由甲烷制备:
 。已知
。已知 时,
时,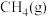 、
、 的燃烧热分别为
的燃烧热分别为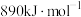 、
、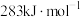 。写出氢气燃烧热的热化学方程式:
。写出氢气燃烧热的热化学方程式:(2)利用反应
 合成清洁能源
合成清洁能源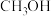 ,CO的平衡转化率与温度的关系如图所示:
,CO的平衡转化率与温度的关系如图所示:
①该可逆反应的正反应

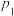
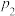 (均填“>”“<”或“=”)。
(均填“>”“<”或“=”)。②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是
a.
 物质的量保持不变
物质的量保持不变b.单位时间内消耗
 的浓度和生成甲醇的浓度相等
的浓度和生成甲醇的浓度相等c.混合气体的压强不再变化
d.混合气体的密度不再变化
③在
 恒容密闭容器中充入
恒容密闭容器中充入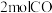 和
和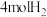 ,在
,在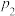 和
和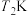 条件下经
条件下经 达到平衡状态C点,在该条件下,平衡常数
达到平衡状态C点,在该条件下,平衡常数 为
为(3)电池的比能量与消耗单位质量还原剂时转移的电子数成正比。理论上,H2、
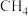 、
、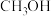 的酸性燃料电池的比能量由大到小排序为
的酸性燃料电池的比能量由大到小排序为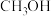 的酸性燃料电池的负极电极反应式为
的酸性燃料电池的负极电极反应式为
您最近一年使用:0次
名校
解题方法
3 . 某科研小组模拟“人工树叶”电化学装置如图所示,甲装置能将H2O和CO2转化为C6H12O6和O2,X、Y是特殊催化剂型电极,乙装置为甲醇—空气燃料电池。下列说法不正确的是


| A.b口通入空气,c口通入甲醇 |
| B.甲装置中H+向X极移动,乙装置中H+向M极移动 |
| C.理论上,每生成22.4LO2(标况下),必有4mol电子由N极移向X极 |
| D.阳极上的电极反应式为6CO2 + 24H+ + 24e- = C6H12O6 + 6H2O |
您最近一年使用:0次
解题方法
4 . 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。
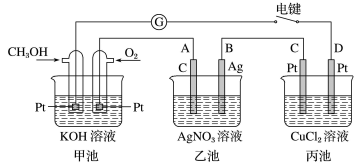
请回答下列问题:
 甲池为
甲池为________  填“原电池”“电解池”或“电镀池”
填“原电池”“电解池”或“电镀池” ,通入
,通入 电极的电极反应式为
电极的电极反应式为__________ 。
 乙池中
乙池中 石墨
石墨 电极的名称为
电极的名称为________  填“正极”“负极”“阴极”或“阳极”
填“正极”“负极”“阴极”或“阳极” ,总反应式为
,总反应式为_______ 。
 当乙池中B极质量增加
当乙池中B极质量增加 时,甲池中理论上消耗
时,甲池中理论上消耗 的体积为
的体积为________  标准状况下
标准状况下 ,丙池中
,丙池中________ 极析出________ g铜。电键闭合一段时间后,甲中溶液的pH将________  填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。

请回答下列问题:
 甲池为
甲池为 填“原电池”“电解池”或“电镀池”
填“原电池”“电解池”或“电镀池” ,通入
,通入 电极的电极反应式为
电极的电极反应式为 乙池中
乙池中 石墨
石墨 电极的名称为
电极的名称为 填“正极”“负极”“阴极”或“阳极”
填“正极”“负极”“阴极”或“阳极” ,总反应式为
,总反应式为 当乙池中B极质量增加
当乙池中B极质量增加 时,甲池中理论上消耗
时,甲池中理论上消耗 的体积为
的体积为 标准状况下
标准状况下 ,丙池中
,丙池中 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。
您最近一年使用:0次
2020-02-04更新
|
76次组卷
|
2卷引用:甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题
5 . 减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求。
(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式___ 。
(2)以甲醇做燃料的电池,如图所示,其负极是___ (填a或b),负极的反应式为___ ,正极的反应式为___ 。该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为___ 。

(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式
(2)以甲醇做燃料的电池,如图所示,其负极是

您最近一年使用:0次
10-11高三·甘肃·阶段练习
6 . 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
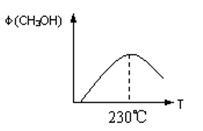
(1)合成甲醇的反应为:CO(g)+2H2(g)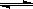 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H__________ 0。(填“>、<或=”下同)
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的__________ 倍。
(3)利用甲醇燃料电池设计如图所示的装置:
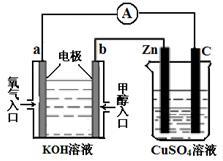
①则该装置中b为____________ 极,写出装置中电解池内发生反应的离子方程式_______________________ 。
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为___________ L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式____________________________________ 。
(1)合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的
(3)利用甲醇燃料电池设计如图所示的装置:

①则该装置中b为
②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)= C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)= C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式
您最近一年使用:0次
名校
7 . 回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mol,则CO的燃烧热的热化学方程式为___________________________________ 。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g) CH3OH(g) ΔH=-116kJ/mol
CH3OH(g) ΔH=-116kJ/mol
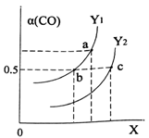
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________ ,Y1_____ Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
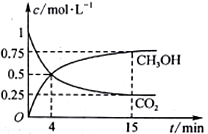
①反应进行到4min时,v(正)____ v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________ mol·L−1·min−1。
②该温度下平衡常数为_____________ 。
③下列能说明该反应已达到平衡状态的是______________ 。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________ 。
(1)已知室温下CO的燃烧热为283 kJ/mol,则CO的燃烧热的热化学方程式为
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)
 CH3OH(g) ΔH=-116kJ/mol
CH3OH(g) ΔH=-116kJ/mol如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是

(3)合成甲醇的反应原理为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①反应进行到4min时,v(正)
②该温度下平衡常数为
③下列能说明该反应已达到平衡状态的是
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:
您最近一年使用:0次
2018-12-29更新
|
1246次组卷
|
4卷引用:甘肃省静宁县第一中学2021届高三上学期第四次模拟考试化学试题
甘肃省静宁县第一中学2021届高三上学期第四次模拟考试化学试题【全国百强校】青海省西宁市第四高级中学2019届高三上学期第四次模拟考试理科综合化学试题【市级联考】陕西省榆林市2019届高三下学期模拟考试化学试题(已下线)【南昌新东方】2019 南大附中 高二上 期中
8 . CH4、CH3OH既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0 mol CH4和2.0 mol H2O(g) 通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g) CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为
CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________ 。
(2)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g) CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________ (填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________ (填选项序号)。
a.消耗1 mol CO2同时生成1 mol CH3OH b.容器内压强保持不变
c.混合气体的密度保持不变 d.CH3OH(g)的浓度保持不变
(4)以KOH为电解质的甲醇-空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。 回答下列问题:

①该原电池的正极是____ (填“甲”或“乙”),电解过程中乙电极附近pH____ (填“增大”或“减小”);
②负极的电极反应式________________________________ 。
(1)将1.0 mol CH4和2.0 mol H2O(g) 通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为
CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为(2)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g)
 CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是a.消耗1 mol CO2同时生成1 mol CH3OH b.容器内压强保持不变
c.混合气体的密度保持不变 d.CH3OH(g)的浓度保持不变
(4)以KOH为电解质的甲醇-空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。 回答下列问题:

①该原电池的正极是
②负极的电极反应式
您最近一年使用:0次
2018-07-18更新
|
498次组卷
|
3卷引用:【全国百强校】甘肃省天水市第一中学2019届高三下学期一轮复习第六次质量检测理综化学试题
9 . 如图为甲醇燃料电池的工作原理示意图,下列有关说法正确的是( )


| A.该燃料电池工作过程中电流方向从a极流向b极 |
| B.该燃料电池工作时电路中通过1 mol电子时,消耗的O2的体积为5.6 L |
| C.Pt(a)电极的反应式为CH3OH-6e-+H2O=CO2↑+6H+ |
| D.该燃料电池工作时H+由b极室向a极室移动,电解质溶液的pH增大 |
您最近一年使用:0次
2018-03-12更新
|
432次组卷
|
2卷引用:甘肃省兰州市2018届高三一诊理综化学试题
名校
10 . 如图1为甲烷和O2 构成的燃料电池示意图,电解质溶液为KOH溶液;图2 为电解AlCl3 溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是


| A.b电极为负极 |
| B.图1中电解质溶液的pH增大 |
| C.a 电极反应式为CH4-8e- +8OH-=CO2+6H2O |
D.图2 中电解AlCl3溶液的总反应式为: 2AlCl3 +6H2O  2Al(OH)3 ↓+3Cl 2↑+3H2 ↑ 2Al(OH)3 ↓+3Cl 2↑+3H2 ↑ |
您最近一年使用:0次
2017-12-09更新
|
754次组卷
|
4卷引用:甘肃省张掖市第二中学2021届高三上学期9月月考化学试题
甘肃省张掖市第二中学2021届高三上学期9月月考化学试题湖南省长沙市长郡中学2018届高三月考 (四)化学试题(B卷)(已下线)广东省深圳中学2019届高三5月适应性考试理综化学试题上海市南汇第一中学2021-2022学年高三下学期模拟化学试题



