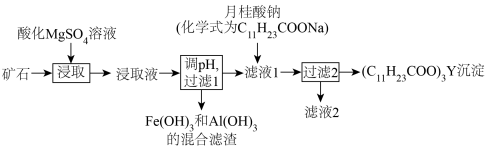
1 . 元素钇(Y)是制备航空航天设备所需的特殊材料的关键成分。一种从某矿石(含钇、铁、铝等元素)中提取Y元素的工艺流程如下:
回答下列问题。
(1)钇位于第5周期第IIIB族,钇的价电子排布式为___________ 。
(2)Mg的第一电离能___________ Al(填“>”或“<”),原因是___________ 。
(3)“过滤1”操作中需将所得混合滤渣洗涤2~3次,并将洗涤液与“滤液1”合并。
①验证混合滤渣已经洗涤干净的操作与现象是___________ 。
②洗涤液与“滤液1”合并的目的是___________ 。
(4)“过滤2”后,滤渣中无Mg元素,“滤液2”中 浓度为0.8
浓度为0.8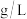 。为尽可能多的提取
。为尽可能多的提取 ,可提高
,可提高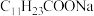 的加入量,但应确保“过滤2”前的溶液中
的加入量,但应确保“过滤2”前的溶液中 )低于
)低于___________ mol/L。
(5)钇可用于制备高活性的合金类催化剂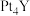 。
。
①还原YCl3和PtCl4混合熔融盐制备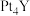 ,生成0.1
,生成0.1 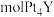 时转移的电子的物质的量为
时转移的电子的物质的量为___________ mol。
②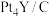 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化电极反应,则
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化电极反应,则  发生的电极反应式为
发生的电极反应式为___________ 。

回答下列问题。
(1)钇位于第5周期第IIIB族,钇的价电子排布式为
(2)Mg的第一电离能
(3)“过滤1”操作中需将所得混合滤渣洗涤2~3次,并将洗涤液与“滤液1”合并。
①验证混合滤渣已经洗涤干净的操作与现象是
②洗涤液与“滤液1”合并的目的是
(4)“过滤2”后,滤渣中无Mg元素,“滤液2”中
 浓度为0.8
浓度为0.8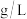 。为尽可能多的提取
。为尽可能多的提取 ,可提高
,可提高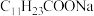 的加入量,但应确保“过滤2”前的溶液中
的加入量,但应确保“过滤2”前的溶液中 )低于
)低于(5)钇可用于制备高活性的合金类催化剂
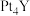 。
。①还原YCl3和PtCl4混合熔融盐制备
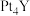 ,生成0.1
,生成0.1 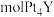 时转移的电子的物质的量为
时转移的电子的物质的量为②
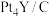 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化电极反应,则
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化电极反应,则  发生的电极反应式为
发生的电极反应式为
您最近半年使用:0次
2 . 下列用来表示物质变化的化学用语中,正确的是
A.在碱性介质中,氢氧燃料电池的负极反应式: |
B.钢铁发生电化学腐蚀的负极反应式: |
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为: |
D.电解饱和食盐水时,阴极的电极反应式为: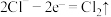 |
您最近半年使用:0次
名校
3 . 元素周期表中VIA族元素单质及其化合物有着广泛应用。O2可用作氢氧燃料电池的氧化剂;O3具有杀菌、消毒、漂白等作用。硫有多种单质,如 2
2 4
4 S6
S6 S8等,用硫黄熏蒸中药材的传统由来已久。硫与氧气反应制得的SO2可用来生产H2SO4,硫酸及硫酸盐是重要化工原料;H2S是一种易燃的有毒气体(燃烧热为
S8等,用硫黄熏蒸中药材的传统由来已久。硫与氧气反应制得的SO2可用来生产H2SO4,硫酸及硫酸盐是重要化工原料;H2S是一种易燃的有毒气体(燃烧热为 -1
-1 是制取多种硫化物的原料;用SO2与SeO2(白色晶体)的水溶液反应可制备硒,硒(34Se)是一种半导体材料。碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以电解强碱性Na2TeO3溶液制备Te。下列化学反应表示正确的是
是制取多种硫化物的原料;用SO2与SeO2(白色晶体)的水溶液反应可制备硒,硒(34Se)是一种半导体材料。碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以电解强碱性Na2TeO3溶液制备Te。下列化学反应表示正确的是
 2
2 4
4 S6
S6 S8等,用硫黄熏蒸中药材的传统由来已久。硫与氧气反应制得的SO2可用来生产H2SO4,硫酸及硫酸盐是重要化工原料;H2S是一种易燃的有毒气体(燃烧热为
S8等,用硫黄熏蒸中药材的传统由来已久。硫与氧气反应制得的SO2可用来生产H2SO4,硫酸及硫酸盐是重要化工原料;H2S是一种易燃的有毒气体(燃烧热为 -1
-1 是制取多种硫化物的原料;用SO2与SeO2(白色晶体)的水溶液反应可制备硒,硒(34Se)是一种半导体材料。碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以电解强碱性Na2TeO3溶液制备Te。下列化学反应表示正确的是
是制取多种硫化物的原料;用SO2与SeO2(白色晶体)的水溶液反应可制备硒,硒(34Se)是一种半导体材料。碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以电解强碱性Na2TeO3溶液制备Te。下列化学反应表示正确的是A.H2S燃烧的热化学方程式: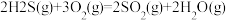  |
B.电解强碱性Na2TeO3溶液的阴极反应: |
C.SO2和SeO2的水溶液反应制备硒: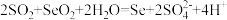 |
D.氢氧燃料电池(H2SO4为电解质溶液)负极反应为: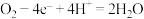 |
您最近半年使用:0次
2023-12-06更新
|
509次组卷
|
2卷引用:江苏省徐州市第一中学、淮阴中学、姜堰中学2023-2024学年高三上学期联考化学试题
4 . Ⅰ.如图是氢气分子的形成过程示意图,请回答下列问题:

(1)H-H键的键长为___________ ,①—⑤中,体系能量由高到低的顺序是___________ 。
(2)下列说法中正确的是___________。
(3)下列与氢原子有关的说法中,错误的是___________。
(4)已知几种常见化学键的键能如下表所示。
①比较Si-Si键与Si-C键的键能大小(填“>”“<”或“=”):X___________ 176kJ 。
。
② 被誉为21世纪人类最理想的燃料。试计算:每千克
被誉为21世纪人类最理想的燃料。试计算:每千克 燃烧(生成水蒸气)放出的热量约为
燃烧(生成水蒸气)放出的热量约为___________ kJ。
Ⅱ.科学家已研制出利用太阳能产生激光,并在二氧化钛( )表面作用使海水分解得到氢气激光的新技术:
)表面作用使海水分解得到氢气激光的新技术: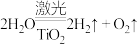 。试回答下列问题:
。试回答下列问题:
(5)分解海水时,实现了从光能转化为___________ 能。分解海水的反应属于反应___________ (填“放热”或“吸热”)。
(6)氢气可用于燃料电池。燃料电池使用气体燃料和氧气直接反应产生电能,是一种很有前途的能源利用方式。某种培根型碱性氢氧燃料电池原理如图所示,下列有关该电池的说法正确的是___________。

(7)储氢是氢能利用的关键技术。科学家最近研究出一种环保,安全的储氢方法,其原理可表示为: 下列有关说法正确的是___________。
下列有关说法正确的是___________。
(8)工业合成氨中也会用到氢气。 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别表示
分别表示 、
、 、
、 ,已知:
,已知: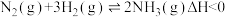 ,下列说法不正确的是___________。
,下列说法不正确的是___________。
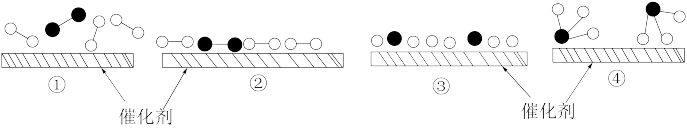

(1)H-H键的键长为
(2)下列说法中正确的是___________。
| A.氢气分子的能量高于氢原子 |
| B.由①到④,电子在核间出现的概率增加 |
| C.由④到⑤,必须消耗外界的能量 |
| D.氢气分子之间存在共价键 |
| A.在氢原子的电子云图中,小黑点的疏密程度表示电子在该区域出现的概率密度 |
| B.霓虹灯能够发出五颜六色的光,其发光机理与氢原子光谱形成机理基本相同 |
| C.利用玻尔原子结构模型可以较好地解释氢原子光谱为线状光谱 |
| D.氢原子核外只有一个电子,它产生的原子光谱中只有一根或明或暗的线 |
| 化学键 | Si—O | H—O |  | Si—Si | Si—C |
键能/kJ | 460 | 467 | 498 | 176 | X |
①比较Si-Si键与Si-C键的键能大小(填“>”“<”或“=”):X
 。
。②
 被誉为21世纪人类最理想的燃料。试计算:每千克
被誉为21世纪人类最理想的燃料。试计算:每千克 燃烧(生成水蒸气)放出的热量约为
燃烧(生成水蒸气)放出的热量约为Ⅱ.科学家已研制出利用太阳能产生激光,并在二氧化钛(
 )表面作用使海水分解得到氢气激光的新技术:
)表面作用使海水分解得到氢气激光的新技术: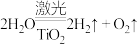 。试回答下列问题:
。试回答下列问题:(5)分解海水时,实现了从光能转化为
(6)氢气可用于燃料电池。燃料电池使用气体燃料和氧气直接反应产生电能,是一种很有前途的能源利用方式。某种培根型碱性氢氧燃料电池原理如图所示,下列有关该电池的说法正确的是___________。

| A.出口I处有KOH生成 |
| B.循环泵可使电解质溶液不断浓缩、循环 |
C.电池放电时, 向镍电极I的方向迁移 向镍电极I的方向迁移 |
D.正极电极反应为: |
 下列有关说法正确的是___________。
下列有关说法正确的是___________。| A.储氢、释氢过程均无能量变化 |
B. 具有离子键和共价键 具有离子键和共价键 |
C.储氢过程中, 被氧化 被氧化 |
D.释氢过程中,每消耗0.1mol 放出2.24L的 放出2.24L的 |
 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别表示
分别表示 、
、 、
、 ,已知:
,已知: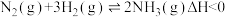 ,下列说法不正确的是___________。
,下列说法不正确的是___________。
| A.该催化剂既能吸附氢气分子,也能吸附氮气分子 |
| B.②→③过程是吸热过程,③→④过程是放热过程 |
| C.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量 |
| D.使用催化剂,合成氨反应放出的热量减少 |
您最近半年使用:0次
名校
解题方法
5 . 载人航天工程对科学研究及太空资源开发具有重要意义,其发展水平是衡量一个国家综合国力的重要指标。中国正在逐步建立自己的载人空间站“天宫”,神舟十三号载人飞船在北京时间10月16日0时23分点火发射,又一次正式踏上飞向浩渺星辰的征途。
(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的_______ 极,OH-向_______ (填“正”或“负”)极作定向移动,Y极的电极反应式为_______ 。
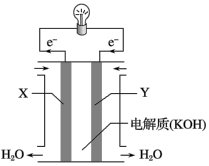
(2)在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲得常温下1L水,则电池内电子转移的物质的量约为_______ mol(保留整数)
(3)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
①飞船在光照区运行时,太阳能电池帆板将_______ 能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为
Cd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为_______ ;当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性_______ (填“增大”“减小”或“不变”)。
②紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O 2Ag+Zn(OH)2,其负极的电极反应式为
2Ag+Zn(OH)2,其负极的电极反应式为_______ 。
(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的

(2)在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲得常温下1L水,则电池内电子转移的物质的量约为
(3)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
①飞船在光照区运行时,太阳能电池帆板将
 Cd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为
Cd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为②紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O
 2Ag+Zn(OH)2,其负极的电极反应式为
2Ag+Zn(OH)2,其负极的电极反应式为
您最近半年使用:0次
6 . 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
I.空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x为电解水,装置y为燃料电池
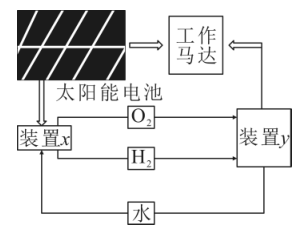
(1)太阳能电池的能量转化形式为___________
A.化学能转化为电能 B.电能转化为化学能 C.光能转化为电能
(2)x工作时,产生O2的电极为___________ 极;
(3)y工作时,若电解质溶液为稀硫酸,则正极反应式为___________ 。
II.氢能的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(4)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:___________ 。
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气: ,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的
,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后, 降低的区域在
降低的区域在___________ (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是___________ 。
③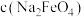 随初始
随初始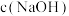 的变化如图2,任选M、N两点中的一点,分析
的变化如图2,任选M、N两点中的一点,分析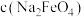 低于最高值的原因:
低于最高值的原因:___________ 。
I.空间站以水为介质将不同形式的能量相互转化,原理如图所示,装置x为电解水,装置y为燃料电池

(1)太阳能电池的能量转化形式为
A.化学能转化为电能 B.电能转化为化学能 C.光能转化为电能
(2)x工作时,产生O2的电极为
(3)y工作时,若电解质溶液为稀硫酸,则正极反应式为
II.氢能的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(4)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:
 ,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的
,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,
 降低的区域在
降低的区域在②电解过程中,须将阴极产生的气体及时排出,其原因是
③
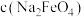 随初始
随初始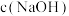 的变化如图2,任选M、N两点中的一点,分析
的变化如图2,任选M、N两点中的一点,分析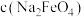 低于最高值的原因:
低于最高值的原因:
您最近半年使用:0次
解题方法
7 . 人们应用原电池原理制作了多种电池,以满足不同的需要,广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。正极电极反应式为___________ 。电池工作一段时间后需要充电,充电过程中H2SO4的浓度___________ (填“增大”、“减小”或“不变”)。
(2)某学习小组依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计成原电池,则负极发生的电极反应式为___________ ;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应转移的电子数目是___________ 。
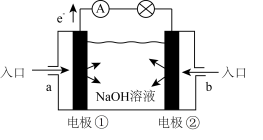
(3)燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:

若该燃料电池为氢氧燃料电池。
①a极通入的物质为___________ (填物质名称),电解质溶液中的OH-移向___________ 极(填”负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:___________ 。
若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO +3H2O。
+3H2O。
③下列有关说法正确的是___________ (填字母代号)。
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO +7H2O
+7H2O
C.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
④当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为___________ mol。
(1)铅蓄电池在放电时发生的电池反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。正极电极反应式为
(2)某学习小组依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计成原电池,则负极发生的电极反应式为
(3)燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:

若该燃料电池为氢氧燃料电池。
①a极通入的物质为
②写出此氢氧燃料电池工作时,负极的电极反应式:
若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO
 +3H2O。
+3H2O。③下列有关说法正确的是
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO
 +7H2O
+7H2OC.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
④当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为
您最近半年使用:0次
解题方法
8 . 化学电池在通讯、交通及日常生活中有着广泛的应用。
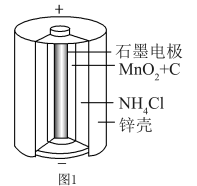
(1)锌锰干电池是应用最普遍的电池之一,图1为锌锰干电池的构造示意图,锌锰干电池的负极材料是___ (填物质名称),负极发生的电极反应为___ 。若反应消耗32.5g负极材料,则电池中转移电子的数目为___ 。
(2)目前常用的镍-镉(Ni—Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___ (填序号)。
①该电池可以在酸性条件下进行充、放电。
②该电池放电时,负极的电极反应式为Cd+2OH--2e-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能。
(3)图2为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的__ (填“正”或“负”)极,X极的电极反应式为___ 。

(1)锌锰干电池是应用最普遍的电池之一,图1为锌锰干电池的构造示意图,锌锰干电池的负极材料是

(2)目前常用的镍-镉(Ni—Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是①该电池可以在酸性条件下进行充、放电。
②该电池放电时,负极的电极反应式为Cd+2OH--2e-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能。
(3)图2为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的

您最近半年使用:0次
2020-04-14更新
|
595次组卷
|
5卷引用:课时2 发展中的化学电源——A学习区 夯实基础(人教版必修2)
9 . 氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为___________________________________ 。
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法能说明上述反应达到平衡的是
2NH3(g),下列说法能说明上述反应达到平衡的是___________ (填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
①升高温度时,气体颜色加深,则正反应是_________ (填“放热”或“吸热”)反应。
②该温度下反应的化学平衡常数数值为_____________ 。
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2)______ 0.60mol·L-1(填“>”、 “=”或“<”)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
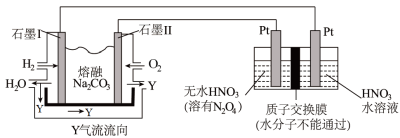
①写出石墨I电极上发生反应的电极反应式_______________________________________ ;
②在电解池中生成N2O5的电极反应式为_______________________________________
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)
 2NH3(g),下列说法能说明上述反应达到平衡的是
2NH3(g),下列说法能说明上述反应达到平衡的是①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g)
 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:| 时间/s | 20 | 40 | 60 | 80 | 100 |
| C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
②该温度下反应的化学平衡常数数值为
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。

①写出石墨I电极上发生反应的电极反应式
②在电解池中生成N2O5的电极反应式为
您最近半年使用:0次
名校
10 . 燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:
(1)若该燃料电池为氢氧燃料电池。
①a极通入的物质为_____ (填物质名称),电解质溶液中的OH—移向______ 极(填”负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:______________ 。
(2)若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO32-+3H2O
①下列有关说法正确的是___________ (填字母代号)。
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O
C.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
②当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为______ mol.

(1)若该燃料电池为氢氧燃料电池。
①a极通入的物质为
②写出此氢氧燃料电池工作时,负极的电极反应式:
(2)若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO32-+3H2O
①下列有关说法正确的是
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O
C.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
②当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为
您最近半年使用:0次
2019-08-02更新
|
1236次组卷
|
7卷引用:湖南省长郡中学2018-2019学年高一下学期期末考试化学试题
湖南省长郡中学2018-2019学年高一下学期期末考试化学试题宁夏回族自治区银川一中2019-2020学年高一下学期期中考试化学试题(已下线)第05练 化学能与热能-2020年【衔接教材·暑假作业】新高二化学(人教版)湖北省随州市曾都一中2019-2020学年高一下学期期末考试化学试题(已下线)第04章 电化学基础(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)安徽省安庆桐城市第八中学2020-2021学年高二上学期期初检测化学试题湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题



