1 . Ⅰ.如图是氢气分子的形成过程示意图,请回答下列问题:

(1)H-H键的键长为___________ ,①—⑤中,体系能量由高到低的顺序是___________ 。
(2)下列说法中正确的是___________。
(3)下列与氢原子有关的说法中,错误的是___________。
(4)已知几种常见化学键的键能如下表所示。
①比较Si-Si键与Si-C键的键能大小(填“>”“<”或“=”):X___________ 176kJ 。
。
② 被誉为21世纪人类最理想的燃料。试计算:每千克
被誉为21世纪人类最理想的燃料。试计算:每千克 燃烧(生成水蒸气)放出的热量约为
燃烧(生成水蒸气)放出的热量约为___________ kJ。
Ⅱ.科学家已研制出利用太阳能产生激光,并在二氧化钛( )表面作用使海水分解得到氢气激光的新技术:
)表面作用使海水分解得到氢气激光的新技术: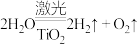 。试回答下列问题:
。试回答下列问题:
(5)分解海水时,实现了从光能转化为___________ 能。分解海水的反应属于反应___________ (填“放热”或“吸热”)。
(6)氢气可用于燃料电池。燃料电池使用气体燃料和氧气直接反应产生电能,是一种很有前途的能源利用方式。某种培根型碱性氢氧燃料电池原理如图所示,下列有关该电池的说法正确的是___________。

(7)储氢是氢能利用的关键技术。科学家最近研究出一种环保,安全的储氢方法,其原理可表示为: 下列有关说法正确的是___________。
下列有关说法正确的是___________。
(8)工业合成氨中也会用到氢气。 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、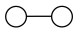 、
、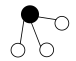 分别表示
分别表示 、
、 、
、 ,已知:
,已知: ,下列说法不正确的是___________。
,下列说法不正确的是___________。
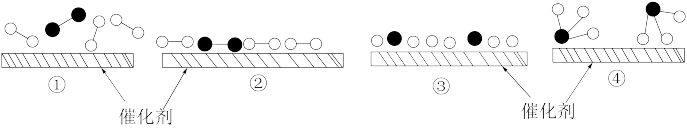

(1)H-H键的键长为
(2)下列说法中正确的是___________。
| A.氢气分子的能量高于氢原子 |
| B.由①到④,电子在核间出现的概率增加 |
| C.由④到⑤,必须消耗外界的能量 |
| D.氢气分子之间存在共价键 |
| A.在氢原子的电子云图中,小黑点的疏密程度表示电子在该区域出现的概率密度 |
| B.霓虹灯能够发出五颜六色的光,其发光机理与氢原子光谱形成机理基本相同 |
| C.利用玻尔原子结构模型可以较好地解释氢原子光谱为线状光谱 |
| D.氢原子核外只有一个电子,它产生的原子光谱中只有一根或明或暗的线 |
| 化学键 | Si—O | H—O |  | Si—Si | Si—C |
键能/kJ | 460 | 467 | 498 | 176 | X |
①比较Si-Si键与Si-C键的键能大小(填“>”“<”或“=”):X
 。
。②
 被誉为21世纪人类最理想的燃料。试计算:每千克
被誉为21世纪人类最理想的燃料。试计算:每千克 燃烧(生成水蒸气)放出的热量约为
燃烧(生成水蒸气)放出的热量约为Ⅱ.科学家已研制出利用太阳能产生激光,并在二氧化钛(
 )表面作用使海水分解得到氢气激光的新技术:
)表面作用使海水分解得到氢气激光的新技术: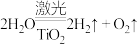 。试回答下列问题:
。试回答下列问题:(5)分解海水时,实现了从光能转化为
(6)氢气可用于燃料电池。燃料电池使用气体燃料和氧气直接反应产生电能,是一种很有前途的能源利用方式。某种培根型碱性氢氧燃料电池原理如图所示,下列有关该电池的说法正确的是___________。

| A.出口I处有KOH生成 |
| B.循环泵可使电解质溶液不断浓缩、循环 |
C.电池放电时, 向镍电极I的方向迁移 向镍电极I的方向迁移 |
D.正极电极反应为: |
 下列有关说法正确的是___________。
下列有关说法正确的是___________。| A.储氢、释氢过程均无能量变化 |
B. 具有离子键和共价键 具有离子键和共价键 |
C.储氢过程中, 被氧化 被氧化 |
D.释氢过程中,每消耗0.1mol 放出2.24L的 放出2.24L的 |
 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别表示
分别表示 、
、 、
、 ,已知:
,已知: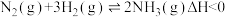 ,下列说法不正确的是___________。
,下列说法不正确的是___________。
| A.该催化剂既能吸附氢气分子,也能吸附氮气分子 |
| B.②→③过程是吸热过程,③→④过程是放热过程 |
| C.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量 |
| D.使用催化剂,合成氨反应放出的热量减少 |
您最近一年使用:0次
解题方法
2 . 人们应用原电池原理制作了多种电池,以满足不同的需要,广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。正极电极反应式为___________ 。电池工作一段时间后需要充电,充电过程中H2SO4的浓度___________ (填“增大”、“减小”或“不变”)。
(2)某学习小组依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计成原电池,则负极发生的电极反应式为___________ ;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应转移的电子数目是___________ 。
(3)燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:

若该燃料电池为氢氧燃料电池。
①a极通入的物质为___________ (填物质名称),电解质溶液中的OH-移向___________ 极(填”负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:___________ 。
若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO +3H2O。
+3H2O。
③下列有关说法正确的是___________ (填字母代号)。
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO +7H2O
+7H2O
C.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
④当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为___________ mol。
(1)铅蓄电池在放电时发生的电池反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。正极电极反应式为
(2)某学习小组依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计成原电池,则负极发生的电极反应式为
(3)燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:

若该燃料电池为氢氧燃料电池。
①a极通入的物质为
②写出此氢氧燃料电池工作时,负极的电极反应式:
若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO
 +3H2O。
+3H2O。③下列有关说法正确的是
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO
 +7H2O
+7H2OC.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
④当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为
您最近一年使用:0次
3 . 氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为___________________________________ 。
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法能说明上述反应达到平衡的是
2NH3(g),下列说法能说明上述反应达到平衡的是___________ (填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
①升高温度时,气体颜色加深,则正反应是_________ (填“放热”或“吸热”)反应。
②该温度下反应的化学平衡常数数值为_____________ 。
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2)______ 0.60mol·L-1(填“>”、 “=”或“<”)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
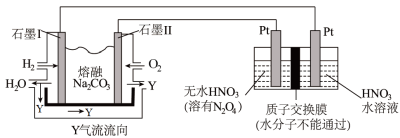
①写出石墨I电极上发生反应的电极反应式_______________________________________ ;
②在电解池中生成N2O5的电极反应式为_______________________________________
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为
(2)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)
 2NH3(g),下列说法能说明上述反应达到平衡的是
2NH3(g),下列说法能说明上述反应达到平衡的是①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成n mol N≡N键
③N2、H2、NH3的物质的量浓度之比为1∶3∶2
④混合气体的平均摩尔质量不变。
⑤容器内的气体密度不变
(3)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g)
 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:| 时间/s | 20 | 40 | 60 | 80 | 100 |
| C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
②该温度下反应的化学平衡常数数值为
③相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后: c(NO2)
(4)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。

①写出石墨I电极上发生反应的电极反应式
②在电解池中生成N2O5的电极反应式为
您最近一年使用:0次
名校
4 . 燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:
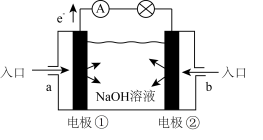
(1)若该燃料电池为氢氧燃料电池。
①a极通入的物质为_____ (填物质名称),电解质溶液中的OH—移向______ 极(填”负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:______________ 。
(2)若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO32-+3H2O
①下列有关说法正确的是___________ (填字母代号)。
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O
C.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
②当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为______ mol.

(1)若该燃料电池为氢氧燃料电池。
①a极通入的物质为
②写出此氢氧燃料电池工作时,负极的电极反应式:
(2)若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-=CO32-+3H2O
①下列有关说法正确的是
A.燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O
C.正极的电极反应式为O2+4H++4e-=2H2O
D.通入甲烷的电极发生还原反应
②当消耗甲烷33.6L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为
您最近一年使用:0次
2019-08-02更新
|
1237次组卷
|
7卷引用:湖南省长郡中学2018-2019学年高一下学期期末考试化学试题
湖南省长郡中学2018-2019学年高一下学期期末考试化学试题宁夏回族自治区银川一中2019-2020学年高一下学期期中考试化学试题(已下线)第05练 化学能与热能-2020年【衔接教材·暑假作业】新高二化学(人教版)湖北省随州市曾都一中2019-2020学年高一下学期期末考试化学试题(已下线)第04章 电化学基础(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)安徽省安庆桐城市第八中学2020-2021学年高二上学期期初检测化学试题湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题
5 . 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是


| A.当有0.2 mol电子转移时,a极产生3.2g O2 |
| B.b极上发生的电极反应是:2 H+ +2e- = H2↑ |
| C.c极上进行还原反应,B中的H+可以通过隔膜进入A |
| D.d极上发生的电极反应是:O2+2H2O + 4e- = 4OH- |
您最近一年使用:0次
名校
6 . 燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置,电解质溶液是强碱溶液。下列关于CH4燃料电池的说法正确的是
| A.负极反应式为:CH4+10OH- -8e-=CO32-+7H2O |
| B.正极反应式为:O2+2H++4e- =2H2O |
| C.随着放电的进行,溶液的碱性不变 |
| D.放电时溶液中阴离子向正极移动 |
您最近一年使用:0次
名校
解题方法
7 . 化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳。而氢气和氮气都被认为是无碳无污染的清洁能源。
I. “氢能”将是未来最理想的新能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2=MH2x △H<0 (M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。
则下列说法中,正确的是_______ 。
a. T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M做还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气。其中C(s)+H2O(g)=CO(g)+H2(g),在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.OmolH2O。
①850℃ 时反应达到平衡,x应满足的条件是____________ 。
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是_______ 。
a.选用更高效的催化剂 b.升高温度
c.及时分离出氢气 d.增加氢气的浓度
II. CO2是合成尿素的原料
现在以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。
工作过程中,甲装置中d电极的电极反应式是___________ ,乙装置中电极a为_____ 极(填电极名称)。
(2)若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH =_______ (忽略电解前后溶液体积变化)
III.氨是制备尿素的原料,NH3、N2O4等在工农业生产,航天航空等领域有广泛应用。
(1)氨在氧气中燃烧,生成水和一种空气组成成分的单质。已知:N2(g)+3H2(g) 2NH3(g)△H =-92.4kJ/mol及H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:
2NH3(g)△H =-92.4kJ/mol及H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:__________________ 。
(2)氨气溶于水得到氨水,在25℃ 下,将a mol·L-1的氨水和b mol·L-1的硫酸以3:2的体积比混合,反应后溶液呈中性。用含a和b的代数式表示出NH3 H2O的电离平衡常数________ 。
I. “氢能”将是未来最理想的新能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M+xH2=MH2x △H<0 (M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。

则下列说法中,正确的是
a. T1>T2
b.增大M的量,上述平衡向右移动
c.增大氢气压强,加快氢气的吸收速率
d.金属储氢过程中M做还原剂,价态升高
(2)工业上通常用生产水煤气的方法制得氢气。其中C(s)+H2O(g)=CO(g)+H2(g),在850℃时平衡常数K=1。若向1L的恒容密闭真空容器中同时加入xmolC和6.OmolH2O。
①850℃ 时反应达到平衡,x应满足的条件是
②对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度
c.及时分离出氢气 d.增加氢气的浓度
II. CO2是合成尿素的原料
现在以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨,电解一段时间后,b电极附近滴入酚酞溶液变红,NaCl溶液的体积为100mL。

工作过程中,甲装置中d电极的电极反应式是
(2)若在a极产生112mL(标准状况)气体,25℃时乙装置中所得溶液pH =
III.氨是制备尿素的原料,NH3、N2O4等在工农业生产,航天航空等领域有广泛应用。
(1)氨在氧气中燃烧,生成水和一种空气组成成分的单质。已知:N2(g)+3H2(g)
 2NH3(g)△H =-92.4kJ/mol及H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:
2NH3(g)△H =-92.4kJ/mol及H2的燃烧热为286kJ/mol。试写出氨在氧气中燃烧生成液态水的热化学方程式:(2)氨气溶于水得到氨水,在25℃ 下,将a mol·L-1的氨水和b mol·L-1的硫酸以3:2的体积比混合,反应后溶液呈中性。用含a和b的代数式表示出NH3 H2O的电离平衡常数
您最近一年使用:0次
名校
8 . 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法不正确的是


| A.该装置将化学能转化为电能 |
| B.为了增加灯泡亮度,可以将电极碳棒变得粗糙多孔 |
| C.电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a |
| D.该电池的总反应:2H2+O2=2H2O |
您最近一年使用:0次
2017-04-06更新
|
1086次组卷
|
4卷引用:2017届浙江省杭州市学军中学高三选考模拟化学试卷
名校
9 . 一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是


| A.电极A上H2和CO都发生了氧化反应 |
B.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol电子 3H2+CO,每消耗1molCH4转移12mol电子 |
| C.电池工作时,电能转变为化学能 |
| D.电极B上发生的电极反应为:O2+2H2O+4e-=4OH- |
您最近一年使用:0次
2017-08-31更新
|
1363次组卷
|
2卷引用:北京市清华大学附属中学2016-2017学年高一下学期期中考试化学试题
10 . MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的总反应为2H2+O2===2H2O,下列有关该电池的说法正确的是( )
| A.该电池的正极反应式为4OH-+4e-===O2↑+2H2O |
| B.该电池的负极反应式为H2-2e-===2H+ |
| C.放电时OH-向负极移动 |
| D.当生成1 mol H2O时,转移2 mol电子 |
您最近一年使用:0次



