名校
1 . 回答下列问题:
Ⅰ.某小组研究 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。
资料:单质硫可溶于过量硫化钠溶液形成淡黄色的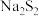 溶液。
溶液。
(1)根据实验可知, 具有
具有___________ 性。
(2)甲同学预测实验Ⅰ中 被氧化成
被氧化成 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是___________ 。
②乙同学取实验Ⅰ中少量溶液进行实验,检测到有 ,得出
,得出 被氧化成
被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是___________ 。
③同学们经讨论后,设计了如下实验,证实该条件下 的确可以将
的确可以将 氧化成
氧化成 。右侧烧杯中的溶液是
。右侧烧杯中的溶液是___________ ;连通后电流计指针偏转,一段时间后,取左侧烧杯中的溶液,用盐酸酸化后,滴加 溶液,观察到有白色沉淀生成,证明
溶液,观察到有白色沉淀生成,证明 氧化成了
氧化成了 。
。

Ⅱ.甲烷和甲醇的燃料电池具有广阔的开发和应用前景。
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

通入a物质的电极是原电池的___________ (填“正”或“负”)极,其电极反应式为___________ 。
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验:如图所示U形管中氯化钠溶液的体积为800mL。闭合K后,若每个电池中甲烷通入量为0.224L(标准状况),且反应完全,则理论上通过电解池的电量为___________ C(法拉第常数 ),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的氢氧根离子浓度为
),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的氢氧根离子浓度为___________ (假设反应后溶液体积不变)。

Ⅰ.某小组研究
 溶液与
溶液与 溶液反应,探究过程如下。
溶液反应,探究过程如下。| 实验序号 | Ⅰ | Ⅱ |
| 实验过程 |  |  |
| 实验现象 | 紫色变浅(pH>1),生成棕褐色沉淀( ) ) | 溶液呈淡黄色(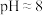 ),生成浅粉色沉淀(MnS) ),生成浅粉色沉淀(MnS) |
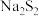 溶液。
溶液。(1)根据实验可知,
 具有
具有(2)甲同学预测实验Ⅰ中
 被氧化成
被氧化成 。
。①根据实验现象,乙同学认为甲的预测不合理,理由是
②乙同学取实验Ⅰ中少量溶液进行实验,检测到有
 ,得出
,得出 被氧化成
被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是③同学们经讨论后,设计了如下实验,证实该条件下
 的确可以将
的确可以将 氧化成
氧化成 。右侧烧杯中的溶液是
。右侧烧杯中的溶液是 溶液,观察到有白色沉淀生成,证明
溶液,观察到有白色沉淀生成,证明 氧化成了
氧化成了 。
。
Ⅱ.甲烷和甲醇的燃料电池具有广阔的开发和应用前景。
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:

通入a物质的电极是原电池的
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验:如图所示U形管中氯化钠溶液的体积为800mL。闭合K后,若每个电池中甲烷通入量为0.224L(标准状况),且反应完全,则理论上通过电解池的电量为
 ),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的氢氧根离子浓度为
),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的氢氧根离子浓度为
您最近一年使用:0次
名校
解题方法
2 . 某化学兴趣小组在实验室中以烧杯为容器,用饱和 溶液制备
溶液制备 胶体,并对其性质做了如下探究:
胶体,并对其性质做了如下探究:
(1)将饱和 溶液加到
溶液加到___________ 中,可制得 胶体。制备过程中,发生化学反应的方程式为
胶体。制备过程中,发生化学反应的方程式为___________ 。
(2)小米同学在制备时,加热时间过久,结果未能得到胶体。那么小米同学得到的物质应该是:_______ (填化学式),该物质属于_______ (请从下面选择)。
A.酸 B.碱 C.盐
(3)小庄同学想证明 胶体已经制备成功,她可以利用
胶体已经制备成功,她可以利用___________ (最简单的方法,请写出方法的名称)进行鉴别。
(4)小静同学利用___________ (填方法名称)方法对 胶体提纯。
胶体提纯。
(5)小邱同学将提纯后的 胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知
胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知 胶粒带
胶粒带___________ 电荷(填“正”、“负”或者“不带”)。化学上把这种现象称为___________ 。
 溶液制备
溶液制备 胶体,并对其性质做了如下探究:
胶体,并对其性质做了如下探究:(1)将饱和
 溶液加到
溶液加到 胶体。制备过程中,发生化学反应的方程式为
胶体。制备过程中,发生化学反应的方程式为(2)小米同学在制备时,加热时间过久,结果未能得到胶体。那么小米同学得到的物质应该是:
A.酸 B.碱 C.盐
(3)小庄同学想证明
 胶体已经制备成功,她可以利用
胶体已经制备成功,她可以利用(4)小静同学利用
 胶体提纯。
胶体提纯。(5)小邱同学将提纯后的
 胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知
胶体置于U型管中,通入直流电一段时间后,观察到与电源负极相连的那个电极附近的颜色变深,说明可知 胶粒带
胶粒带
您最近一年使用:0次
2023-11-02更新
|
18次组卷
|
2卷引用:福建省厦门市第十中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
3 . 下列电化学装置能达到目的的是
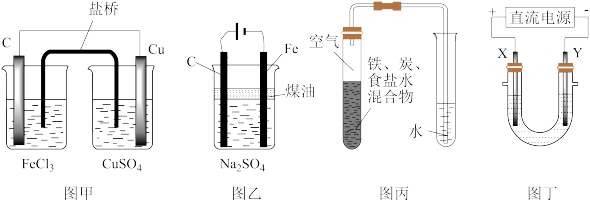

| A.图甲:实现原电池反应Cu+2Fe3+=Cu2++2Fe2+ | B.图乙:制取少量Fe(OH)2 |
| C.图丙:证明铁发生了析氢腐蚀 | D.图丁:电镀工业中,X是待镀金属 |
您最近一年使用:0次
2022-11-05更新
|
238次组卷
|
3卷引用:福建省莆田第二十五中学2023-2024学年高二上学期期中考试化学试题
解题方法
4 . 铝(熔点660℃)是一种应用广泛的金属,镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业上以铝土矿(含有Al2O3、Ga2O3、SiO2等物质)为原料提取Al2O3(熔点2045℃),并将Al2O3和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
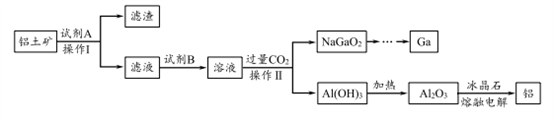
(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式___________________ 。
(2)操作I得到滤渣的主要成分有________________ 。
(3)将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为________________ ;该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质,原因是 _________________________ 。
(4)饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________ ,此方法的缺点是处理后的水中生成了AlO2-,仍然可能对人类健康产生危害,还需对该饮用水进行一系列后续处理。已知:25℃时,Ksp[Al(OH)3]=1.3×10-33,Al(OH)3 AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=
AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=____ ,此时水中 =
=__________ 。
(5)工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。
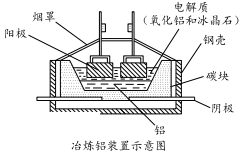
①阴极电极反应式为________________________ 。
②工业生产中,阳极材料要定期补充,其原因是:____________________ 。
(6)下列有关推理不合理的是______ 。
a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性

(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式
(2)操作I得到滤渣的主要成分有
(3)将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为
(4)饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为
 AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=
AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH= =
=(5)工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。

①阴极电极反应式为
②工业生产中,阳极材料要定期补充,其原因是:
(6)下列有关推理不合理的是
a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性
您最近一年使用:0次
2018-04-28更新
|
334次组卷
|
2卷引用:福建2020届高三化学大题练——无机工业流程题
解题方法
5 . 一种自生酸和碱的电化学回收体系,原理如图所示。在Ⅲ室中将 等含磷微粒转化为羟基磷灰石
等含磷微粒转化为羟基磷灰石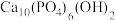 (
(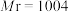 ),同时将
),同时将 转化为
转化为 ,实现废水中的
,实现废水中的 等含磷微粒和
等含磷微粒和 的回收。下列说法
的回收。下列说法不正确 的是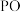 表示
表示 等含磷微粒,
等含磷微粒, 为羟基磷灰石)
为羟基磷灰石)
 等含磷微粒转化为羟基磷灰石
等含磷微粒转化为羟基磷灰石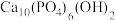 (
(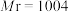 ),同时将
),同时将 转化为
转化为 ,实现废水中的
,实现废水中的 等含磷微粒和
等含磷微粒和 的回收。下列说法
的回收。下列说法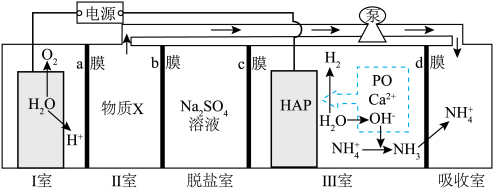
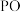 表示
表示 等含磷微粒,
等含磷微粒, 为羟基磷灰石)
为羟基磷灰石)| A.a、c为阳离子交换膜,b为阴离子交换膜 |
B.Ⅲ室可发生反应: |
C.当电路中通过 电子,阴极增重10.04g 电子,阴极增重10.04g |
D.物质X为硫酸溶液,将其泵入吸收室用于吸收 |
您最近一年使用:0次
解题方法
6 . 2023年,我国科学家利用铜催化剂催化电解碱性甲醛溶液实现阴阳两极同时制氢,其原理如图所示。电解过程中,电极 b上同时产生 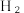 与
与 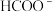 的物质的量之比为1∶2。下列说法错误的是
的物质的量之比为1∶2。下列说法错误的是
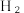 与
与 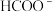 的物质的量之比为1∶2。下列说法错误的是
的物质的量之比为1∶2。下列说法错误的是
| A.电极a连接电源的负极 |
| B.电极b上的电极反应式为2HCHO+4OH⁻-2e⁻=2HCOO⁻+H2↑+2H2O(1) |
| C.电解过程中a、b两极产生H2的体积比为1:1 |
| D.电解过程共收集到 H2 22.4L(标准状况),则通过阴离子交换膜的OH⁻为2mol |
您最近一年使用:0次
名校
7 . 复旦大学科研人员采用金属碳酸盐和固-固转换反应,设计出 石墨烯(ZZG)电极的概念电池,该电池原料利用率高,寿命长.其充电原理如图所示:
石墨烯(ZZG)电极的概念电池,该电池原料利用率高,寿命长.其充电原理如图所示:
 石墨烯(ZZG)电极的概念电池,该电池原料利用率高,寿命长.其充电原理如图所示:
石墨烯(ZZG)电极的概念电池,该电池原料利用率高,寿命长.其充电原理如图所示:
A.充电时, 移向镍基电极 移向镍基电极 |
| B.充电时,阴极附近电解液中pH增大 |
| C.放电时,镍基电极为电源正极 |
| D.放电时,当外电路中有2mol电子转移时,ZZG电极析出1mol固体 |
您最近一年使用:0次
2024-02-24更新
|
549次组卷
|
5卷引用:福建省福州市福建师范大学附属中学2024届高三一模化学试题
名校
解题方法
8 . 有一种清洁、无膜的氯碱工艺,它利用含有保护层的电极( )中的
)中的 的嵌入和脱嵌机理,分两步得到相关产品,其原理如图所示。下列说法错误的是
的嵌入和脱嵌机理,分两步得到相关产品,其原理如图所示。下列说法错误的是

 )中的
)中的 的嵌入和脱嵌机理,分两步得到相关产品,其原理如图所示。下列说法错误的是
的嵌入和脱嵌机理,分两步得到相关产品,其原理如图所示。下列说法错误的是
| A.b是直流电源的正极,c是直流电源的负极 |
| B.钠离子的嵌入时发生了还原反应 |
C.第1步结束后, 电极必须用水洗涤后,再用于第2步 电极必须用水洗涤后,再用于第2步 |
| D.每生成lmolX气体理论上可以产生0.5molY气体 |
您最近一年使用:0次
名校
解题方法
9 . 为了减少对环境的污染,在煤直接燃烧前要进行脱硫处理。应用电解法对煤进行脱硫处理具有脱硫效率高、经济效益好等优点。电解脱硫的基本原理如图所示,利用电极反应将Mn2+转化为Mn3+,Mn3+再将煤中的含硫物质(主要是FeS2)氧化为:Fe3+和 ,反应原理:FeS2+15Mn3++8H2O=Fe3++15Mn2++2
,反应原理:FeS2+15Mn3++8H2O=Fe3++15Mn2++2 +16H+。下列说法
+16H+。下列说法不正确 的是

 ,反应原理:FeS2+15Mn3++8H2O=Fe3++15Mn2++2
,反应原理:FeS2+15Mn3++8H2O=Fe3++15Mn2++2 +16H+。下列说法
+16H+。下列说法
| A.b为电源的负极 |
| B.阳极的电极反应为:Mn2+-e-=Mn3+ |
| C.电解刚刚开始时,观察到阴极石墨棒上有无色气体产生:2H++2e-=H2↑ |
| D.电解过程中,混合溶液中H+的物质的量浓度将减小 |
您最近一年使用:0次
2023-11-11更新
|
286次组卷
|
2卷引用:福建省福州市八县一中2023-2024学年高三上学期11月期中化学试题
解题方法
10 . 下列装置图是电解制备金属锂的一种新方法,有关说法错误的是


A.电极 为负极 为负极 | B.离子交换膜为阳离子交换膜 |
C.理论上每生成 ,同时生成 ,同时生成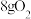 | D.电极 上的电极反应式为 上的电极反应式为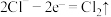 |
您最近一年使用:0次



