解题方法
1 . 消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
则常温常压下,NH3与NO2反应生成无污染物质的热化学方程式_____________ 。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示:
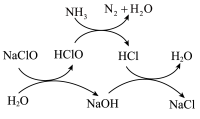
写出该图示的总反应化学方程式:__________________ 。该反应需控制温度,温度过高时氨氮去除率降低的主要原因是______________ 。
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图所示:

当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是___ 。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图所示:
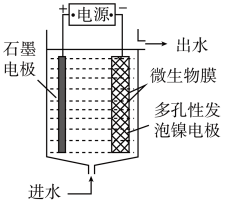
①写出该活性原子与NO3-反应的离子方程式:________________ 。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____ mol。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
则常温常压下,NH3与NO2反应生成无污染物质的热化学方程式
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示:

写出该图示的总反应化学方程式:
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图所示:

当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图所示:

①写出该活性原子与NO3-反应的离子方程式:
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为
您最近一年使用:0次
2020-01-29更新
|
171次组卷
|
2卷引用:辽宁葫芦岛市普通高中2020届高三上学期期末学业质量监测化学试题
名校
解题方法
2 . 以K2CrO4为原料,电化学法制备K2Cr2O7的实验装置示意图如图,下列说法正确的是


| A.在阴极室,发生的电极反应为2H2O-2e-=2OH-+H2↑ |
| B.在阳极室,通电后溶液逐渐由橙色(Cr2O72-)变为黄色(CrO42-) |
| C.该制备过程中,阴极室中的K+透过阳离子交换膜向阳极室移动 |
| D.测定阳极液中K和Cr的含量,若某时刻K与Cr的物质的量之比(nK/nCr)为x,则此时K2CrO4的转化率为2-x |
您最近一年使用:0次
名校
3 . 某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是

| 离子 | Na+ | K+ | Ca2+ | Mg2+ | Cl- |  | 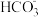 |
| 含量/mg·L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

| A.甲室的电极反应式为:2Cl--2e-= Cl2↑ |
| B.淡化过程中易在戊室形成水垢 |
| C.乙室和丁室中部分离子的浓度增大,淡水的出口为 b |
| D.当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol |
您最近一年使用:0次
2019-02-14更新
|
808次组卷
|
5卷引用:【校级联考】湖北省荆州中学、宜昌一中等“荆、荆、襄、宜四地七校考试联盟”2019届高三上学期期末考试理科综合化学试题
名校
解题方法
4 . 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。

(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:__________________________________ 。
②若在标准状况下有2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__ mol。
(2)某小组在右室装有10 L 0.2 mol·L−1硝酸溶液,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2 mol·L−1硝酸溶液需量取____ mL、密度为1.4 g·mL−1、质量分数为63%的浓硝酸。
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比___ (假设尾气不含氮氧化物,写出计算过程)。

(1)若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:
②若在标准状况下有2.24 L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为
(2)某小组在右室装有10 L 0.2 mol·L−1硝酸溶液,用含NO和NO2(不考虑NO2转化为N2O4)的废气进行模拟电解法吸收实验。
①实验前,配制10 L 0.2 mol·L−1硝酸溶液需量取
②电解过程中,有部分NO转化为HNO2。实验结束时,测得右室溶液中含3 mol HNO3、0.1 mol HNO2,同时左室收集到标准状况下28 L H2。计算原气体中NO和NO2的体积比
您最近一年使用:0次
2016-12-09更新
|
353次组卷
|
6卷引用:辽宁省 丹东市第二中学、大石桥第三高级中学2023-2024学年高二上学期期末化学模拟试卷
辽宁省 丹东市第二中学、大石桥第三高级中学2023-2024学年高二上学期期末化学模拟试卷2016届江苏省苏中三市高三第二次调研测试化学试卷2015-2016学年江苏省扬州中学高二下期中化学试卷2016届江苏省南通市高三下学期第三次教学调研化学试卷2015-2016学年河北省定州中学高二下期中化学试卷(已下线)考点10 电解原理 金属的腐蚀与防护——备战2019年浙江新高考化学考点
名校
解题方法
5 . 知识的梳理和感悟是有效学习的方法之一。某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)。
(1)图中,电解一段时间后,气球b中的气体是_____ (填化学式),U形管_____ (填“左”或“右”)边的溶液变红。
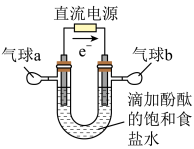
(2)利用图制作一种环保型消毒液发生器,可制备“84”消毒液的有效成分,则c为电源的_____ 极;该发生器中反应的总离子方程式为_____ 。
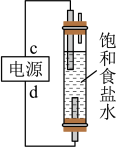
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

①燃料电池B中的电极反应式分别为
负极:_____ ,
正极:_____ 。
②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_____ 。
(1)图中,电解一段时间后,气球b中的气体是

(2)利用图制作一种环保型消毒液发生器,可制备“84”消毒液的有效成分,则c为电源的

(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

①燃料电池B中的电极反应式分别为
负极:
正极:
②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次
2016-12-09更新
|
532次组卷
|
6卷引用:2016届北京市石景山区高三上学期期末考试化学试卷
2016届北京市石景山区高三上学期期末考试化学试卷甘肃省武威市第十八中学2019届高三上学期期末考试化学试题步步为赢 高二化学暑假作业:作业八 电化学基础广东省徐闻县徐闻中学2022-2023学年高二上学期开学测试化学试题(已下线)专题六 化学反应与能量 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第4讲 电解池 金属的电化学腐蚀与防护
名校
解题方法
6 . 碳和氮是地球上含量丰富的两种元素。其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
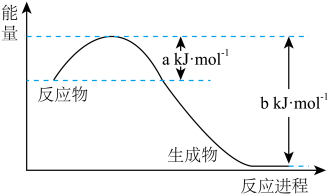
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式____________________________________ 。
(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:
请回答下列问题:
①T1℃时,该反应的平衡常数K=___________ 。
②T2℃时,下列能判断该反应达到平衡状态的是___________ (填序号)。
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向___________ (填“正向”“逆向“或“不”)移动。
④若△H<O,则T1___________ T2(填“>”或“<”)。
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:

①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式________________ 。
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为___________ mol。
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式

(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)
 N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:| 温度 | n(C)/mol | n(CO2)/mol |
| T1 | 0.3 | |
| T2 | 0.6 |
①T1℃时,该反应的平衡常数K=
②T2℃时,下列能判断该反应达到平衡状态的是
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向
④若△H<O,则T1
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:

①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为
您最近一年使用:0次
10-11高三上·江西南昌·阶段练习
名校
7 . 将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是
质量分数 | NaOH的 | 阳极析出物的质量/g | 阴极析出物的质量/g |
A | 6.2% | 19 | 152 |
B | 6.2% | 152 | 19 |
C | 4.2% | 1.2 | 9.4 |
D | 4.2% | 9.4 | 1.2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2010-12-20更新
|
223次组卷
|
5卷引用:2015-2016学年吉林省松原高中、白城一中高二上期末联考化学试卷



