22-23高二上·江苏南通·期末
1 .  能有效杀灭包含新冠病毒在内的多种病毒,可用于环境消毒。实验室可以通过多种方法进行制取。
能有效杀灭包含新冠病毒在内的多种病毒,可用于环境消毒。实验室可以通过多种方法进行制取。
(1)一种制取 的方法如下图甲所示,已知温度高于
的方法如下图甲所示,已知温度高于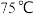 时,
时, 会分解生成
会分解生成 和
和 。装置A中反应的化学方程式为
。装置A中反应的化学方程式为_______ 。
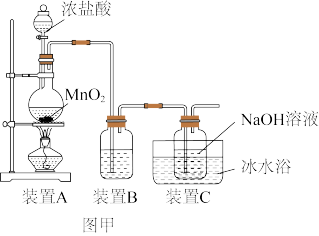
(2)图乙所示装置也可用于制取 。
。
①图乙装置中所发生总反应的化学方程式为_______ 。
②与图甲所示方法相比,图乙所示方法的优点除装置简单外,还有:_______ 。
(3) 中含有
中含有 会影响产品的品质。测定
会影响产品的品质。测定 样品中
样品中 的质量分数的方法如下:取
的质量分数的方法如下:取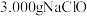 样品,加水溶解,加入过量
样品,加水溶解,加入过量 ,充分反应后,将溶液加热煮沸除去剩余的
,充分反应后,将溶液加热煮沸除去剩余的 ,冷却至室温,加入硫酸酸化,再加入
,冷却至室温,加入硫酸酸化,再加入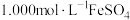 标准溶液
标准溶液 ,充分反应后,用
,充分反应后,用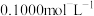 酸性
酸性 溶液滴定过量的
溶液滴定过量的 溶液至终点,到达滴定终点时消耗
溶液至终点,到达滴定终点时消耗 溶液的体积为
溶液的体积为 。
。
已知:酸性条件下 与
与 和
和 反应的离子方程式如下:
反应的离子方程式如下:

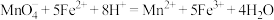
①加入 的目的是除去
的目的是除去 ,已知
,已知 反应后生成
反应后生成 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
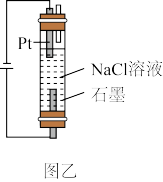
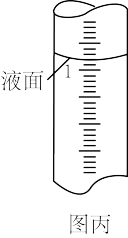
②滴定过程中,滴定管中液面如图丙所示。此时读数为_______ 。
③滴定终点的实验现象是_______ 。
④计算样品中 的质量分数
的质量分数________ (写出计算过程)。
 能有效杀灭包含新冠病毒在内的多种病毒,可用于环境消毒。实验室可以通过多种方法进行制取。
能有效杀灭包含新冠病毒在内的多种病毒,可用于环境消毒。实验室可以通过多种方法进行制取。(1)一种制取
 的方法如下图甲所示,已知温度高于
的方法如下图甲所示,已知温度高于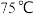 时,
时, 会分解生成
会分解生成 和
和 。装置A中反应的化学方程式为
。装置A中反应的化学方程式为
(2)图乙所示装置也可用于制取
 。
。
①图乙装置中所发生总反应的化学方程式为
②与图甲所示方法相比,图乙所示方法的优点除装置简单外,还有:
(3)
 中含有
中含有 会影响产品的品质。测定
会影响产品的品质。测定 样品中
样品中 的质量分数的方法如下:取
的质量分数的方法如下:取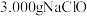 样品,加水溶解,加入过量
样品,加水溶解,加入过量 ,充分反应后,将溶液加热煮沸除去剩余的
,充分反应后,将溶液加热煮沸除去剩余的 ,冷却至室温,加入硫酸酸化,再加入
,冷却至室温,加入硫酸酸化,再加入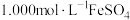 标准溶液
标准溶液 ,充分反应后,用
,充分反应后,用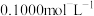 酸性
酸性 溶液滴定过量的
溶液滴定过量的 溶液至终点,到达滴定终点时消耗
溶液至终点,到达滴定终点时消耗 溶液的体积为
溶液的体积为 。
。已知:酸性条件下
 与
与 和
和 反应的离子方程式如下:
反应的离子方程式如下:
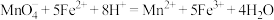
①加入
 的目的是除去
的目的是除去 ,已知
,已知 反应后生成
反应后生成 ,写出该反应的化学方程式:
,写出该反应的化学方程式:②滴定过程中,滴定管中液面如图丙所示。此时读数为

③滴定终点的实验现象是
④计算样品中
 的质量分数
的质量分数
您最近一年使用:0次
解题方法
2 . 如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_______ (填“正极”或“负极”),负极的电极反应式为_______ 。
(2)铁电极为_______ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______ (填“增大”“减小”或“不变”)
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_______ (用 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
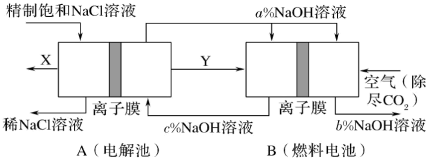
分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_______ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次
名校
解题方法
3 . 氢气是一种清洁高效的新型能源,如何经济实用的制取氢气成为重要课题。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气:
方法一:氨热分解法制氢气。
相关化学键的键能数据
(1)反应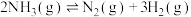

___________  。
。
方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:

(2)电解过程中 的移动方向为
的移动方向为___________ (填“从左往右”或“从右往左)。
(3)阳极的电极反应式为___________ 。
II. 可用于高效制取氢气,发生的反应
可用于高效制取氢气,发生的反应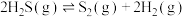 。若起始时容器中只有
。若起始时容器中只有 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
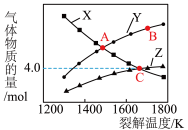
(4)图中曲线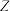 表示的物质是
表示的物质是___________ (填化学式)。
(5) 点时
点时 的转化率为
的转化率为___________  (保留一位小数)。
(保留一位小数)。
(6) 点时,设容器内的总压为
点时,设容器内的总压为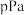 ,则平衡常数
,则平衡常数
___________  (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
I.氨气中氢含量高,是一种优质的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气:
方法一:氨热分解法制氢气。
相关化学键的键能数据
| 化学键 |  |  |  |
键能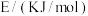 | 946 | 436 | 391 |
(1)反应
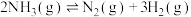

 。
。方法二:氨电解法制氢气。
利用电解原理,将氨转化为高纯氢气,其装置如图所示:

(2)电解过程中
 的移动方向为
的移动方向为(3)阳极的电极反应式为
II.
 可用于高效制取氢气,发生的反应
可用于高效制取氢气,发生的反应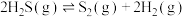 。若起始时容器中只有
。若起始时容器中只有 ,平衡时三种物质的物质的量与裂解温度的关系如图。
,平衡时三种物质的物质的量与裂解温度的关系如图。
(4)图中曲线
 表示的物质是
表示的物质是(5)
 点时
点时 的转化率为
的转化率为 (保留一位小数)。
(保留一位小数)。(6)
 点时,设容器内的总压为
点时,设容器内的总压为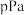 ,则平衡常数
,则平衡常数
 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
名校
4 . 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。图是海水综合利用的部分流程图,据图回答问题:
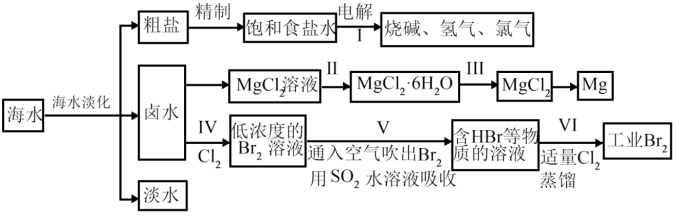
已知:Br2的化学性质与Cl2的性质相似
(1)第II步由MgCl2溶液制备MgCl2•6H2O的操作为____ 、过滤、洗涤、干燥。
(2)步骤V为用SO2水溶液吸收溴蒸气,该反应的离子方程式是____ 。
(3)电解饱和食盐水是氯碱工业基础。
①写出电解饱和氯化钠溶液时的总反应的离子方程式:____ 。
②当阴极产生标况下33.6LH2时,通过阳离子交换膜的Na+有____ mol。
③氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
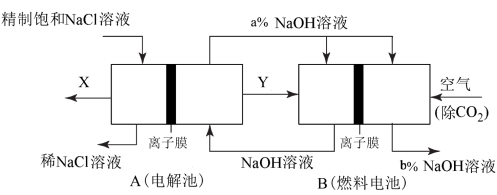
a.图中Y是____ (填化学式);
b.比较图示中氢氧化钠溶液质量分数的大小:a%____ b%(填>、=或<)
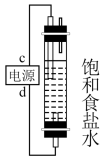
(4)利用如图制作一种环保型消毒液发生器,可制备“84”消毒液(有效成分为次氯酸钠)的有效成分,则c为电源的____ 极;该发生器中反应的总离子方程式____ 。

已知:Br2的化学性质与Cl2的性质相似
(1)第II步由MgCl2溶液制备MgCl2•6H2O的操作为
(2)步骤V为用SO2水溶液吸收溴蒸气,该反应的离子方程式是
(3)电解饱和食盐水是氯碱工业基础。
①写出电解饱和氯化钠溶液时的总反应的离子方程式:
②当阴极产生标况下33.6LH2时,通过阳离子交换膜的Na+有
③氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

a.图中Y是
b.比较图示中氢氧化钠溶液质量分数的大小:a%
(4)利用如图制作一种环保型消毒液发生器,可制备“84”消毒液(有效成分为次氯酸钠)的有效成分,则c为电源的

您最近一年使用:0次
名校
5 . 研究 在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的 主要以4种无机碳形式存在,其中
主要以4种无机碳形式存在,其中 占95%。结合化学用语解释
占95%。结合化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因___________ 。
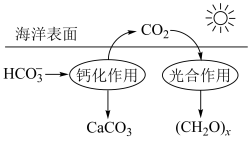
(2)在海洋碳循环中,通过右图所示的途径固碳。写出钙化作用的离子方程式:___________ 。
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法:
①气提、吸收 。用
。用 从酸化后的海水中吹出
从酸化后的海水中吹出 并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
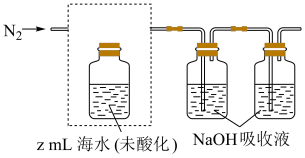
②滴定。将吸收液吸收的无机碳转化为 ,再用
,再用 HCl溶液滴定,消耗ymLHCl溶液。海水中溶解无机碳的浓度=
HCl溶液滴定,消耗ymLHCl溶液。海水中溶解无机碳的浓度=___________  。
。
(4)利用如图所示装置从海水中提取 ,有利于减少环境温室气体含量。
,有利于减少环境温室气体含量。
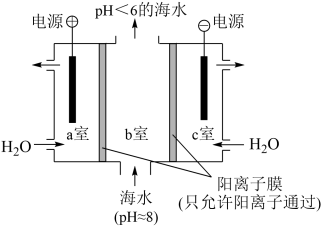
①结合方程式简述提取 的原理:
的原理:___________ 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是___________ 。
 在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的
 主要以4种无机碳形式存在,其中
主要以4种无机碳形式存在,其中 占95%。结合化学用语解释
占95%。结合化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因(2)在海洋碳循环中,通过右图所示的途径固碳。写出钙化作用的离子方程式:
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法:
①气提、吸收
 。用
。用 从酸化后的海水中吹出
从酸化后的海水中吹出 并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液吸收的无机碳转化为
 ,再用
,再用 HCl溶液滴定,消耗ymLHCl溶液。海水中溶解无机碳的浓度=
HCl溶液滴定,消耗ymLHCl溶液。海水中溶解无机碳的浓度= 。
。(4)利用如图所示装置从海水中提取
 ,有利于减少环境温室气体含量。
,有利于减少环境温室气体含量。
①结合方程式简述提取
 的原理:
的原理:②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是
您最近一年使用:0次
解题方法
6 . 镓( )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
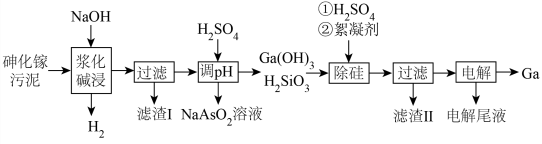
已知:Ⅰ.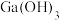 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;
Ⅱ. 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。
回答下列问题:
(1)“浆化碱浸”过程中 反应的离子方程式为
反应的离子方程式为________ ;“滤渣Ⅰ”的成分为______ (填化学式)。
(2)中和“调 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是_______ 。
(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的 调节至
调节至______ 范围内,沉淀效果最好;此过程中,加入絮凝剂的目的是_______ 。
(4) 溶液经
溶液经_________ 、______ 、抽滤、洗涤、干燥得 晶体。
晶体。
(5)用惰性电极电解得到电解尾液和 ,电解尾液可在
,电解尾液可在______ (填操作单元名称)过程中循环使用,提高经济效益。
(6) 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
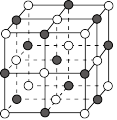
① 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为_____ 。
②距离最近的两个 原子之间的距离为
原子之间的距离为_______  (用含
(用含 的代数式表示)。
的代数式表示)。
 )是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为
)是重要的稀有金属之一,主要应用于半导体行业。一种从砷化镓污泥(主要成分为 )中回收镓的工艺流程如图所示:
)中回收镓的工艺流程如图所示:
已知:Ⅰ.
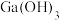 是两性氢氧化物,既能溶于强酸又能溶于强碱;
是两性氢氧化物,既能溶于强酸又能溶于强碱;Ⅱ.
 为灰白色固体,易溶于水,具有还原性。
为灰白色固体,易溶于水,具有还原性。回答下列问题:
(1)“浆化碱浸”过程中
 反应的离子方程式为
反应的离子方程式为(2)中和“调
 ”沉镓和硅的过程中,保持
”沉镓和硅的过程中,保持 约为6,若
约为6,若 过低镓的回收率将降低,其原因是
过低镓的回收率将降低,其原因是(3)“除硅”时,镓和硅在溶液中的含量如表所示,由表可知,“除硅”的
 调节至
调节至 |  |  |
| 0.0 | 2500 | 1345 |
| 0.5 | 2456 | 1267 |
| 1.0 | 2438 | 81 |
| 1.5 | 2420 | 103 |
| 2.0 | 2200 | 804 |
| 2.5 | 1879 | 952 |
(4)
 溶液经
溶液经 晶体。
晶体。(5)用惰性电极电解得到电解尾液和
 ,电解尾液可在
,电解尾液可在(6)
 可生成
可生成 氮化镓等半导体材料,
氮化镓等半导体材料, 氮化镓晶胞结构如图,黑球代表
氮化镓晶胞结构如图,黑球代表 ,白球代表
,白球代表 ,晶胞参数为
,晶胞参数为 。
。
①
 氮化镓晶体中每个
氮化镓晶体中每个 原子周围最近的
原子周围最近的 原子的个数为
原子的个数为②距离最近的两个
 原子之间的距离为
原子之间的距离为 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
7 . 利用电沉积法制备纳米级金属镍,具有制备晶体性能独特操作方法简便等优点,电解装置如图所示,下列说法错误的是
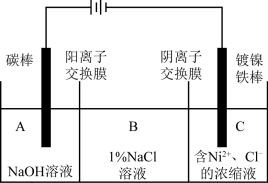

A.电解时,C室发生的电极反应为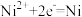 |
| B.电解一段时间后,B室中氯化钠溶液的质量分数增大 |
C.为了提高电沉积效率,一段时间后,可向C室中补充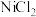 溶液 溶液 |
D.电解时,B室中的 经过阳离子交换膜进入A室 经过阳离子交换膜进入A室 |
您最近一年使用:0次
2022-01-21更新
|
114次组卷
|
2卷引用:山西省吕梁市2021-2022学年高二上学期期末考试化学试题
8 . 电化学原理被广泛应用于生产、生活的许多方面,利用电解法脱除煤中的含硫物质(主要是FeS2)的原理如图所示。
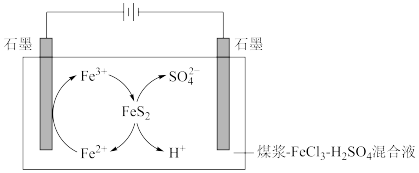
(1)阴极石墨棒上有无色气体产生,该气体是_______ 。
(2)阳极的电极反应式为_______ 。
(3)补全脱硫反应方程式:_______ 。
FeS2+_______+_______=SO +_______+_______
+_______+_______
(4)相同反应时间,FeCl3对脱硫率的影响如图所示。

①电解脱硫过程中,FeCl3的作用是催化剂,结合简单碰撞理论说明使用FeCl3能加快反应速率的原因_______ 。
②FeCl3的质量分数大于1.5%时,脱硫率随FeCl3浓度的增大而下降,解释原因_______ 。
(5)研究发现,电解时若电压过高,阳极有副反应发生,造成电解效率降低。电解效率η的定义: 。某电压下电解100mL煤浆-FeCl3-H2SO4混合液,煤浆中除FeS2外不含其它含硫物质,混合液中H2SO4浓度为0.01mol·L−1,FeCl3的质量分数为1.5%。当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c(SO
。某电压下电解100mL煤浆-FeCl3-H2SO4混合液,煤浆中除FeS2外不含其它含硫物质,混合液中H2SO4浓度为0.01mol·L−1,FeCl3的质量分数为1.5%。当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c(SO )=0.02mol·L−1,η(SO
)=0.02mol·L−1,η(SO )=
)=_______ (忽略电解前后溶液的体积变化)。
(6)综上,电解法脱硫的优点有_______ (写出两点)。

(1)阴极石墨棒上有无色气体产生,该气体是
(2)阳极的电极反应式为
(3)补全脱硫反应方程式:
FeS2+_______+_______=SO
 +_______+_______
+_______+_______(4)相同反应时间,FeCl3对脱硫率的影响如图所示。

①电解脱硫过程中,FeCl3的作用是催化剂,结合简单碰撞理论说明使用FeCl3能加快反应速率的原因
②FeCl3的质量分数大于1.5%时,脱硫率随FeCl3浓度的增大而下降,解释原因
(5)研究发现,电解时若电压过高,阳极有副反应发生,造成电解效率降低。电解效率η的定义:
 。某电压下电解100mL煤浆-FeCl3-H2SO4混合液,煤浆中除FeS2外不含其它含硫物质,混合液中H2SO4浓度为0.01mol·L−1,FeCl3的质量分数为1.5%。当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c(SO
。某电压下电解100mL煤浆-FeCl3-H2SO4混合液,煤浆中除FeS2外不含其它含硫物质,混合液中H2SO4浓度为0.01mol·L−1,FeCl3的质量分数为1.5%。当阴极收集到224mL(标准状况)气体时(阴极无副反应发生),测得溶液中c(SO )=0.02mol·L−1,η(SO
)=0.02mol·L−1,η(SO )=
)=(6)综上,电解法脱硫的优点有
您最近一年使用:0次
2022-01-19更新
|
244次组卷
|
3卷引用:北京市朝阳区2021-2022学年高二上学期期末考试化学试题
名校
解题方法
9 . I.亚砷酸(H3AsO3)可以用作防腐剂、杀虫剂和除草剂,H3AsO3是三元弱酸,在溶液中存在多种含砷微粒。25℃时各种微粒物质的量分数与溶液pH的关系如图所示,其中a点横坐标值为9.3。回答下列问题。
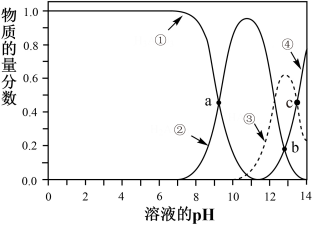
(1)曲线②代表的含砷微粒是________ 。
(2)将NaOH溶液滴加到H3AsO3溶液中,当pH从12调至13时,发生的主要反应的离子方程式是_________________________ 。
(3)将Na3AsO3和NaH2AsO3固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足3c(Na+)=7[c(AsO )+c(HAsO
)+c(HAsO )+c(H2AsO
)+c(H2AsO )+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为
)+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为_______________ 。
(4)25℃,当c(H3AsO3)=c(HAsO )时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为
)时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为_____________ 。
Ⅱ.用NaOH溶液吸收烟气中的SO2气体,将所得的Na2SO3溶液进行电解,可实现NaOH溶液的循环再生,同时得到H2SO4,以石墨为电极的电解装置如图。
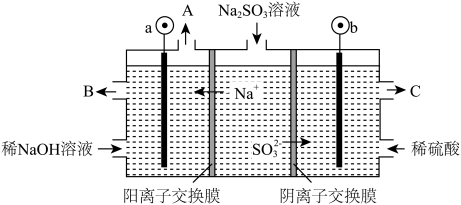
(5)Na2SO3溶液所有阴离子浓度由大到小的顺序为_____________ 。
(6)图中a极连接电源的__________ 极。
(7)b电极电极反应式为_________________ 。
Ⅲ.
(8)含铬废水中的CrO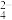 可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于
可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于_______ mol/L。

(1)曲线②代表的含砷微粒是
(2)将NaOH溶液滴加到H3AsO3溶液中,当pH从12调至13时,发生的主要反应的离子方程式是
(3)将Na3AsO3和NaH2AsO3固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足3c(Na+)=7[c(AsO
 )+c(HAsO
)+c(HAsO )+c(H2AsO
)+c(H2AsO )+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为
)+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为(4)25℃,当c(H3AsO3)=c(HAsO
 )时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为
)时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为Ⅱ.用NaOH溶液吸收烟气中的SO2气体,将所得的Na2SO3溶液进行电解,可实现NaOH溶液的循环再生,同时得到H2SO4,以石墨为电极的电解装置如图。

(5)Na2SO3溶液所有阴离子浓度由大到小的顺序为
(6)图中a极连接电源的
(7)b电极电极反应式为
Ⅲ.
(8)含铬废水中的CrO
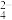 可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于
可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于
您最近一年使用:0次
2023-02-15更新
|
254次组卷
|
2卷引用:广东省深圳市深圳实验学校高中部2022-2023学年高二上学期第三阶段考试化学试题
名校
解题方法
10 . 化学反应是人类获得能量的重要途径。请结合所学知识解决以下问题。
I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
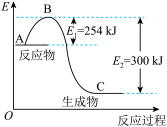
(1)如图是 和
和 反应生成
反应生成 的过程中能量变化示意图,请写出
的过程中能量变化示意图,请写出 和
和 反应的热化学方程式
反应的热化学方程式_______ 。
(2)用 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知:
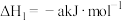 ①
①
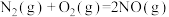
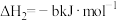 ②
②
若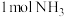 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热
____ kJ/mol(用含a、b的式子表示)。
II.某科研单位利用电化学原理用来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
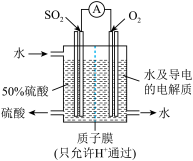
(3)通入 的电极为
的电极为_______ 极,其电极反应式为_______ 。
(4)电解质溶液中的 通过质子膜
通过质子膜_______ 移动(填“向左”、“向右”或“不”)。
III.用石墨棒作电极,在 、
、 、
、 、
、 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(5)当阴极放出 ,阳极放出
,阳极放出 时,电解质是
时,电解质是_______ (写化学式,下同)。
(6)当阴极放出 ,阳极放出
,阳极放出 时,电解质是
时,电解质是_______ 。
(7)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是_______ 。
I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是
 和
和 反应生成
反应生成 的过程中能量变化示意图,请写出
的过程中能量变化示意图,请写出 和
和 反应的热化学方程式
反应的热化学方程式
(2)用
 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知: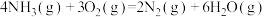
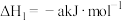 ①
①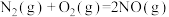
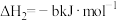 ②
②若
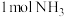 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热
II.某科研单位利用电化学原理用来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

(3)通入
 的电极为
的电极为(4)电解质溶液中的
 通过质子膜
通过质子膜III.用石墨棒作电极,在
 、
、 、
、 、
、 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:(5)当阴极放出
 ,阳极放出
,阳极放出 时,电解质是
时,电解质是(6)当阴极放出
 ,阳极放出
,阳极放出 时,电解质是
时,电解质是(7)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是
您最近一年使用:0次



