名校
解题方法
1 . 国家规定生产生活用水中镉的含量必须严格控制。
(1)湿法炼锌产生的铜镉渣(主要含锌、铜、铁、镉、钴等单质)用于生产金属镉的工艺流程如图:

相关金属离子生成氢氧化物沉淀的pH如下表:
①酸浸时粉碎铜镉渣的目的是_______ 。
②过滤Ⅲ中加入试剂Zn,其作用是调节滤液的pH范围为_______ 。
③电解过程中,镉在_______ 极析出,该电极材料是_______ ,电解废液中可循环利用的溶质是_______ 。
(2)处理含镉废水常采用化学沉淀法,已知常温下, 、
、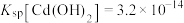 、
、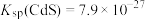 、
、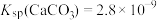 。
。
①沉淀Cd2+效果最佳的试剂是_______ 。
a. Na2CO3 b. CaO c. Na2S
②若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_______ 。
③常加入CaCO3实现沉淀转化,反应前溶液中的c(Cd2+)为0.05mol/L,反应后溶液中c(Ca2+)为0.5mol/L,则原溶液中Cd2+的去除率为_______ 。
(1)湿法炼锌产生的铜镉渣(主要含锌、铜、铁、镉、钴等单质)用于生产金属镉的工艺流程如图:

相关金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 | Fe3+ | Cd2+ | Fe2+ |
| 开始沉淀的pH | 1.1 | 7.2 | 5.8 |
| 沉淀完全的pH | 3.2 | 9.5 | 8.8 |
②过滤Ⅲ中加入试剂Zn,其作用是调节滤液的pH范围为
③电解过程中,镉在
(2)处理含镉废水常采用化学沉淀法,已知常温下,
 、
、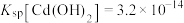 、
、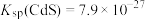 、
、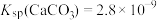 。
。①沉淀Cd2+效果最佳的试剂是
a. Na2CO3 b. CaO c. Na2S
②若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=
③常加入CaCO3实现沉淀转化,反应前溶液中的c(Cd2+)为0.05mol/L,反应后溶液中c(Ca2+)为0.5mol/L,则原溶液中Cd2+的去除率为
您最近一年使用:0次
2 . 2020年9月中国明确提出“双碳”目标。因此,研发 资源化利用技术、降低空气中
资源化利用技术、降低空气中 含量成为科学家的研究热点。图1为我国科学家利用
含量成为科学家的研究热点。图1为我国科学家利用 和金属
和金属 成功发明的
成功发明的 电池的工作示意图。通入
电池的工作示意图。通入 一极的反应产物为
一极的反应产物为 和单质碳;图2为采用“两室”膜电解法将
和单质碳;图2为采用“两室”膜电解法将 转化为
转化为 的示意图。请回答下列问题:
的示意图。请回答下列问题: 电池中:
电池中:
(1) Li为______ (填“正”或“负”)极,正极的电极反应为____________ 。
(2)研究表明, 电还原后与
电还原后与 结合形成
结合形成 的反应历程如下,反应II的离子方程式为
的反应历程如下,反应II的离子方程式为____________
I.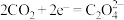
II._________________
III.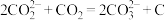
IV.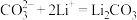
II、利用 电池作为图2装置的中源。
电池作为图2装置的中源。
(3) 片连接
片连接 电池的
电池的_______ (填“ ”或“
”或“ ”)电极,电解过程中,
”)电极,电解过程中,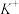 通过阳离子交换膜由
通过阳离子交换膜由_______ (填“左室移向右室”或“右室移向左室”),阴极发生的电极反应为_______ 。
(4)电解一段时间后, 电池中生成
电池中生成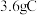 时,图2中阳极区产生气体的体积(标准状况)为
时,图2中阳极区产生气体的体积(标准状况)为_______ L。
 资源化利用技术、降低空气中
资源化利用技术、降低空气中 含量成为科学家的研究热点。图1为我国科学家利用
含量成为科学家的研究热点。图1为我国科学家利用 和金属
和金属 成功发明的
成功发明的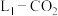 电池的工作示意图。通入
电池的工作示意图。通入 一极的反应产物为
一极的反应产物为 和单质碳;图2为采用“两室”膜电解法将
和单质碳;图2为采用“两室”膜电解法将 转化为
转化为 的示意图。请回答下列问题:
的示意图。请回答下列问题: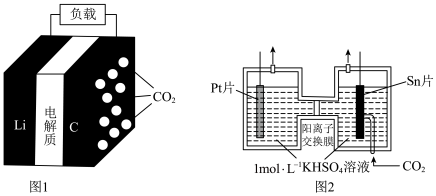
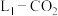 电池中:
电池中:(1) Li为
(2)研究表明,
 电还原后与
电还原后与 结合形成
结合形成 的反应历程如下,反应II的离子方程式为
的反应历程如下,反应II的离子方程式为I.
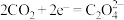
II._________________
III.
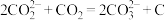
IV.
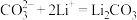
II、利用
 电池作为图2装置的中源。
电池作为图2装置的中源。(3)
 片连接
片连接 电池的
电池的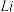 ”或“
”或“ ”)电极,电解过程中,
”)电极,电解过程中,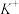 通过阳离子交换膜由
通过阳离子交换膜由(4)电解一段时间后,
 电池中生成
电池中生成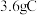 时,图2中阳极区产生气体的体积(标准状况)为
时,图2中阳极区产生气体的体积(标准状况)为
您最近一年使用:0次
名校
3 . Ⅰ.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据如下表:
一定温度下,利用催化剂将 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:
(1)反应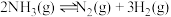

_______  。
。
(2)已知该反应的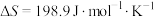 ,在下列哪些温度下反应能自发进行?_______(填标号)
,在下列哪些温度下反应能自发进行?_______(填标号)
Ⅱ.设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。回答下列问题:
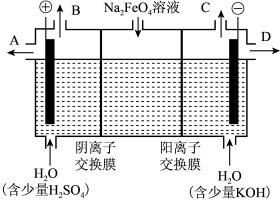
(3)该电解槽的阳极反应式为_______ 。
(4)制得的氢氧化钾溶液从出口_______ (填“A”、“B”、“C”或“D”)导出。
| 化学键 |  |  |  |
键能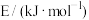 | 946 | 436.0 | 390.8 |
一定温度下,利用催化剂将
 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:(1)反应
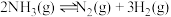

 。
。(2)已知该反应的
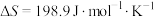 ,在下列哪些温度下反应能自发进行?_______(填标号)
,在下列哪些温度下反应能自发进行?_______(填标号)| A.298K | B.398K | C.498K | D.598K |
Ⅱ.设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。回答下列问题:

(3)该电解槽的阳极反应式为
(4)制得的氢氧化钾溶液从出口
您最近一年使用:0次
名校
4 . 二氧化锗 可用于制备半导体材料,某实验小组以铁矾渣
可用于制备半导体材料,某实验小组以铁矾渣 主要成分为FeO、CaO、GeO和
主要成分为FeO、CaO、GeO和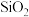 等
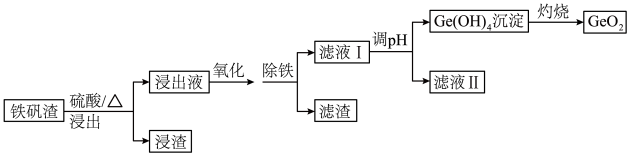
等 为原料制取二氧化锗的工艺流程如下所示。
为原料制取二氧化锗的工艺流程如下所示。
已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
请回答下列问题:
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为______ ,浸渣的主要成分为______ (填化学式 。
。

(2)“氧化”时,可选用的试剂为________ (填字母)。
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为_________ 。
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理用离子方程式表示为___________ 。
(5)若Ge4+沉淀完全时的浓度为1×10-5mol/L,根据表中数据计算25℃时Ge(OH)4的Ksp=_____ 。
(6)利用惰性电极电解酸性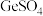 溶液也可制得
溶液也可制得 ,则阳极的电极反应式为
,则阳极的电极反应式为_________ 。
 可用于制备半导体材料,某实验小组以铁矾渣
可用于制备半导体材料,某实验小组以铁矾渣 主要成分为FeO、CaO、GeO和
主要成分为FeO、CaO、GeO和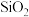 等
等 为原料制取二氧化锗的工艺流程如下所示。
为原料制取二氧化锗的工艺流程如下所示。
已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
离子 |  | 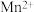 | 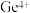 |
开始沉淀时的pH |  |  |  |
沉淀完全时的pH |  |  | 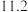 |
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为
 。
。
(2)“氧化”时,可选用的试剂为
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理用离子方程式表示为
(5)若Ge4+沉淀完全时的浓度为1×10-5mol/L,根据表中数据计算25℃时Ge(OH)4的Ksp=
(6)利用惰性电极电解酸性
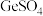 溶液也可制得
溶液也可制得 ,则阳极的电极反应式为
,则阳极的电极反应式为
您最近一年使用:0次
解题方法
5 . 下列离子方程式正确的是
A.氧化亚铁与稀盐酸反应: |
B.用惰性电极电解饱和食盐水: |
C.用酸性高锰酸钾溶液测空气中SO2的含量: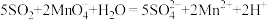 |
D.用饱和Na2CO3溶液处理锅炉水垢中的CaSO4: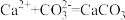 |
您最近一年使用:0次
名校
6 . 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确 的是
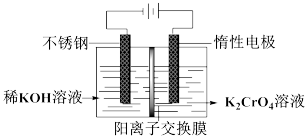

A.在阴极室,发生的电极反应为: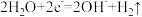 |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区 浓度增大,使平衡 浓度增大,使平衡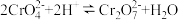 向右移动 向右移动 |
C.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为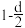 |
D.该制备过程总反应的化学方程式为: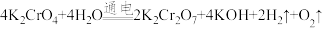 |
您最近一年使用:0次
2021-12-19更新
|
419次组卷
|
3卷引用:浙江省金华第一中学2021-2022学年高一上学期领军班期末联考化学试题
解题方法
7 . 海水中含有HCO 等离子,呈弱碱性,过量二氧化碳排放使海洋表层水的pH由8.3变到约为8,严重威胁海洋生态。用图示方法可以从酸化海水中提取并收集二氧化碳。下列说法错误的是
等离子,呈弱碱性,过量二氧化碳排放使海洋表层水的pH由8.3变到约为8,严重威胁海洋生态。用图示方法可以从酸化海水中提取并收集二氧化碳。下列说法错误的是

 等离子,呈弱碱性,过量二氧化碳排放使海洋表层水的pH由8.3变到约为8,严重威胁海洋生态。用图示方法可以从酸化海水中提取并收集二氧化碳。下列说法错误的是
等离子,呈弱碱性,过量二氧化碳排放使海洋表层水的pH由8.3变到约为8,严重威胁海洋生态。用图示方法可以从酸化海水中提取并收集二氧化碳。下列说法错误的是
A.a室发生的反应为 |
| B.图示中左侧为阳离子交换膜,右侧为阴离子交换膜 |
| C.b室排出的海水经该装置产生的物质处理后,排回大海 |
| D.使用该装置可以降低环境中温室气体二氧化碳的含量 |
您最近一年使用:0次
名校
8 . 氮是生命体的重要组成元素,自然界中氮的循环对于生命活动有重要意义。
(1)一种利用锂及其化合物的循环,将空气中的N2转化为NH3的过程如图所示。
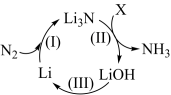
①X的化学式为___________ 。
②转化(Ⅲ)是电解熔融LiOH,该反应的化学方程式为___________ 。
(2)废水中氨氮(以NH3或NH 形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化去除,已知NH3比NH
形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化去除,已知NH3比NH 更易被氧化。NaClO除去水中氨氮的反应过程如下:
更易被氧化。NaClO除去水中氨氮的反应过程如下:
NaClO+H2O NaOH+HClO
NaOH+HClO
NH3+HClO=NH2Cl+H2O
2NH2Cl+HClO=N2↑+3HCl+H2O
①控制含氨氮废水的量和加入NaClO的量一定,测得反应相同时间,氨氮的去除率与溶液初始pH的关系如图-1所示。

(a)当pH<6时,氨氮去除率随溶液pH升高而升高的原因是:___________ 。
(b)当pH>10时,氨氮去除率随溶液pH升高而降低的原因是:___________ 。
②控制溶液的pH=7,测得反应相同时间,溶液中的氨氮、总氮(所有含氮微粒)的去除率随初始m(NaClO)∶m(NH3)的比例如图-2所示。当m(NaClO)∶m(NH3)>7.6,随m(NaClO)∶m(NH3)的增大,氨氮去除率始终接近100%,而总氮去除率逐渐降低的原因是___________ 。
③NaClO与NH3恰好完全反应时,反应的n(NaClO)∶n(NH3)的理论值是1.5.控制溶液的pH=7,测得反应相同时间,溶液中余氯含量与投入n(NaClO)∶n(NH3)的比值关系如图-3所示。水中的余氯的计算方法是向水中加入足量KI,生成的I2的物质的量看成是水中Cl2的物质的量。当n(NaClO)∶n(NH3)=1时,溶液中余氯含量较大的原因是___________ 。

(1)一种利用锂及其化合物的循环,将空气中的N2转化为NH3的过程如图所示。

①X的化学式为
②转化(Ⅲ)是电解熔融LiOH,该反应的化学方程式为
(2)废水中氨氮(以NH3或NH
 形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化去除,已知NH3比NH
形式存在)含量过高,直接排放会造成水体富营养化。用NaClO可以将氨氮氧化去除,已知NH3比NH 更易被氧化。NaClO除去水中氨氮的反应过程如下:
更易被氧化。NaClO除去水中氨氮的反应过程如下:NaClO+H2O
 NaOH+HClO
NaOH+HClONH3+HClO=NH2Cl+H2O
2NH2Cl+HClO=N2↑+3HCl+H2O
①控制含氨氮废水的量和加入NaClO的量一定,测得反应相同时间,氨氮的去除率与溶液初始pH的关系如图-1所示。

(a)当pH<6时,氨氮去除率随溶液pH升高而升高的原因是:
(b)当pH>10时,氨氮去除率随溶液pH升高而降低的原因是:
②控制溶液的pH=7,测得反应相同时间,溶液中的氨氮、总氮(所有含氮微粒)的去除率随初始m(NaClO)∶m(NH3)的比例如图-2所示。当m(NaClO)∶m(NH3)>7.6,随m(NaClO)∶m(NH3)的增大,氨氮去除率始终接近100%,而总氮去除率逐渐降低的原因是
③NaClO与NH3恰好完全反应时,反应的n(NaClO)∶n(NH3)的理论值是1.5.控制溶液的pH=7,测得反应相同时间,溶液中余氯含量与投入n(NaClO)∶n(NH3)的比值关系如图-3所示。水中的余氯的计算方法是向水中加入足量KI,生成的I2的物质的量看成是水中Cl2的物质的量。当n(NaClO)∶n(NH3)=1时,溶液中余氯含量较大的原因是

您最近一年使用:0次
2021-02-23更新
|
642次组卷
|
2卷引用:江苏省如皋市2021届高三上学期期末教学质量调研化学试题
解题方法
9 . 电镀工业往往产生含 、
、 的含铬废水,排放前须将二者还原为
的含铬废水,排放前须将二者还原为 ,之后再加碱沉淀出
,之后再加碱沉淀出 ,经处理后废水中铬的含量显著降低。
,经处理后废水中铬的含量显著降低。
(1) 、
、 中,铬
中,铬 元素的化合价为
元素的化合价为_______ 。
(2)化学平衡 。体系中
。体系中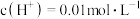 时,比较
时,比较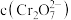 、
、 的大小:
的大小:_______
(3)化学还原法处理含铬废水
i.向废水中加入 (二元弱酸;
(二元弱酸; 溶于水即得
溶于水即得 )。
)。
① 的电离常数
的电离常数 的表达式为
的表达式为_______ 。
②将 转变为
转变为 ,利用了
,利用了 的酸性和
的酸性和_______ 性。
ⅱ.投加生石灰,将 沉淀为
沉淀为 。
。
(4)电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意图如图。
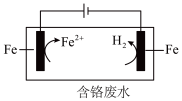
①阳极电极反应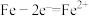 。产生的
。产生的 将
将 还原为
还原为 的离子方程式为
的离子方程式为_______ 。
②阴极区的
_______ (填“增大”或“减小”),使 、
、 形成
形成 、
、 沉淀。
沉淀。
③随着电解的进行,阳极铁板会发生钝化,表面形成 的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失。结合有关反应,解释钝化膜消失的原因
的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失。结合有关反应,解释钝化膜消失的原因_______
 、
、 的含铬废水,排放前须将二者还原为
的含铬废水,排放前须将二者还原为 ,之后再加碱沉淀出
,之后再加碱沉淀出 ,经处理后废水中铬的含量显著降低。
,经处理后废水中铬的含量显著降低。(1)
 、
、 中,铬
中,铬 元素的化合价为
元素的化合价为(2)化学平衡
 。体系中
。体系中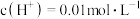 时,比较
时,比较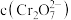 、
、 的大小:
的大小:(3)化学还原法处理含铬废水
i.向废水中加入
 (二元弱酸;
(二元弱酸; 溶于水即得
溶于水即得 )。
)。①
 的电离常数
的电离常数 的表达式为
的表达式为②将
 转变为
转变为 ,利用了
,利用了 的酸性和
的酸性和ⅱ.投加生石灰,将
 沉淀为
沉淀为 。
。(4)电解还原法处理酸性含铬废水:以铁板做阴、阳极,电解含铬废水,示意图如图。

①阳极电极反应
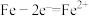 。产生的
。产生的 将
将 还原为
还原为 的离子方程式为
的离子方程式为②阴极区的

 、
、 形成
形成 、
、 沉淀。
沉淀。③随着电解的进行,阳极铁板会发生钝化,表面形成
 的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失。结合有关反应,解释钝化膜消失的原因
的钝化膜,使电解池不能正常工作。将阴极铁板与阳极铁板交换使用,一段时间后,钝化膜消失。结合有关反应,解释钝化膜消失的原因
您最近一年使用:0次
2021-01-24更新
|
375次组卷
|
3卷引用:北京市朝阳区2020-2021学年高二上学期期末质量检测化学试题
10 . 某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法正确的是
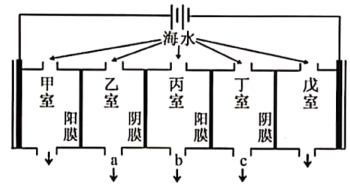
| 成分 |  |  |  |  |  |  |  |
含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

A.甲室的电极反应式为: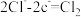 |
B.戊室中易形成水垢,水垢的主要成分是 和 和 |
| C.a、b、c都是淡水的出口 |
| D.当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol |
您最近一年使用:0次



