I.亚砷酸(H3AsO3)可以用作防腐剂、杀虫剂和除草剂,H3AsO3是三元弱酸,在溶液中存在多种含砷微粒。25℃时各种微粒物质的量分数与溶液pH的关系如图所示,其中a点横坐标值为9.3。回答下列问题。
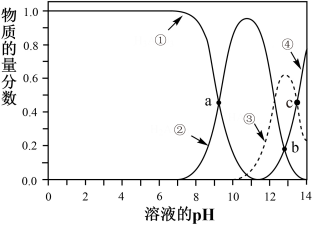
(1)曲线②代表的含砷微粒是________ 。
(2)将NaOH溶液滴加到H3AsO3溶液中,当pH从12调至13时,发生的主要反应的离子方程式是_________________________ 。
(3)将Na3AsO3和NaH2AsO3固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足3c(Na+)=7[c(AsO )+c(HAsO
)+c(HAsO )+c(H2AsO
)+c(H2AsO )+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为
)+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为_______________ 。
(4)25℃,当c(H3AsO3)=c(HAsO )时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为
)时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为_____________ 。
Ⅱ.用NaOH溶液吸收烟气中的SO2气体,将所得的Na2SO3溶液进行电解,可实现NaOH溶液的循环再生,同时得到H2SO4,以石墨为电极的电解装置如图。
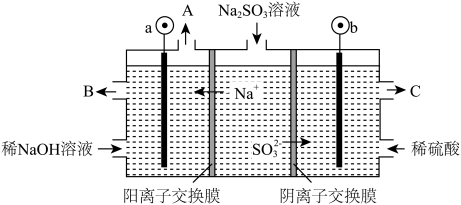
(5)Na2SO3溶液所有阴离子浓度由大到小的顺序为_____________ 。
(6)图中a极连接电源的__________ 极。
(7)b电极电极反应式为_________________ 。
Ⅲ.
(8)含铬废水中的CrO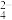 可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于
可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于_______ mol/L。

(1)曲线②代表的含砷微粒是
(2)将NaOH溶液滴加到H3AsO3溶液中,当pH从12调至13时,发生的主要反应的离子方程式是
(3)将Na3AsO3和NaH2AsO3固体按照一定物质的量关系完全溶解在水中,当溶液中离子浓度满足3c(Na+)=7[c(AsO
 )+c(HAsO
)+c(HAsO )+c(H2AsO
)+c(H2AsO )+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为
)+c(H3AsO3)]关系时,向水中加入的Na3AsO3和NaH2AsO3固体的物质的量之比为(4)25℃,当c(H3AsO3)=c(HAsO
 )时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为
)时,溶液pH为10.7,则该温度下亚砷酸的第二步电离常数为Ⅱ.用NaOH溶液吸收烟气中的SO2气体,将所得的Na2SO3溶液进行电解,可实现NaOH溶液的循环再生,同时得到H2SO4,以石墨为电极的电解装置如图。

(5)Na2SO3溶液所有阴离子浓度由大到小的顺序为
(6)图中a极连接电源的
(7)b电极电极反应式为
Ⅲ.
(8)含铬废水中的CrO
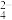 可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于
可利用Ba(NO3)2在碱性条件下以沉淀方法除去。已知:Ksp(BaCrO4)=2.4×10-10,欲使废水中铬元素的含量不高于0.26 mg/L,则滤液中c(Ba2+)不低于
更新时间:2023-02-15 18:13:03
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】I.连二次硝酸(H2N2O2)是一种二元酸。可用于制NO气体。常温下,用0.01 的NaOH溶液滴定10mL0.01
的NaOH溶液滴定10mL0.01 的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
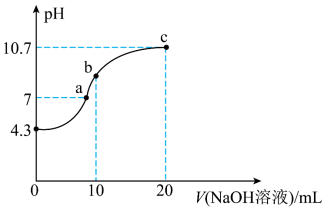
(1)N的价层电子排布图为:_______ 。
(2)常温下H2N2O2的Ka1为_______ 。
(3)b点时溶液中
_______  (填“>”“﹤”“=”,下同)。
(填“>”“﹤”“=”,下同)。
(4)a、b、c三点,水的电离程度最小的是_______ 。
II.25℃时,有浓度均为0.10 的下列4种溶液:①NaCN溶液;②NaOH溶液;③CH3COOH溶液;④NaHCO3溶液。相关电离常数如表所示。
的下列4种溶液:①NaCN溶液;②NaOH溶液;③CH3COOH溶液;④NaHCO3溶液。相关电离常数如表所示。
(5)这4种溶液pH由小到大的顺序是_______ (填序号)。
(6)①中各离子浓度由小到大的顺序是_______ 。
(7)CH3COOH和CH3COONa混合溶液中,若溶液pH=6,则溶液中
_______  (填精确值)。
(填精确值)。
 的NaOH溶液滴定10mL0.01
的NaOH溶液滴定10mL0.01 的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
的H2N2O2溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
(1)N的价层电子排布图为:
(2)常温下H2N2O2的Ka1为
(3)b点时溶液中

 (填“>”“﹤”“=”,下同)。
(填“>”“﹤”“=”,下同)。(4)a、b、c三点,水的电离程度最小的是
II.25℃时,有浓度均为0.10
 的下列4种溶液:①NaCN溶液;②NaOH溶液;③CH3COOH溶液;④NaHCO3溶液。相关电离常数如表所示。
的下列4种溶液:①NaCN溶液;②NaOH溶液;③CH3COOH溶液;④NaHCO3溶液。相关电离常数如表所示。| HCN | H2CO3 | CH3COOH |
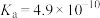 |  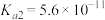 |  |
(6)①中各离子浓度由小到大的顺序是
(7)CH3COOH和CH3COONa混合溶液中,若溶液pH=6,则溶液中

 (填精确值)。
(填精确值)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】已知亚磷酸(H3PO3)的结构如图 ,具有强还原性的弱酸,可以被银离子氧化为磷酸。
,具有强还原性的弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________ .
(2)Na2HPO3是____ (填“正盐”或“酸式盐”) 正盐
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________ ;
(4)某温度下,0.10mol•L-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2mol•L-1,该温度下H3PO3的电离平衡常数K=___________________ ;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____ c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____ c(HPO32-)+c(OH-)
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。

以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_____________ .
 ,具有强还原性的弱酸,可以被银离子氧化为磷酸。
,具有强还原性的弱酸,可以被银离子氧化为磷酸。(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式
(2)Na2HPO3是
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为
(4)某温度下,0.10mol•L-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2mol•L-1,该温度下H3PO3的电离平衡常数K=
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3-、HPO32-的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。

以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】乙酸是基本的有机化工原料。
I.乙酸制氢具有重要意义,制氢过程发生如下反应等:
主反应i:CH3COOH(g) 2CO(g)+2H2(g) △H1=+213.7kJ•mol-1
2CO(g)+2H2(g) △H1=+213.7kJ•mol-1
副反应ii:CH3COOH(g) CH4(g)+CO2(g) △H2=-33.5kJ•mol-1
CH4(g)+CO2(g) △H2=-33.5kJ•mol-1
(1)在容积相同的密闭容器中,均加入1molCH3COOH(g) (g),在相同时间测得温度与气体产率的关系如图所示:
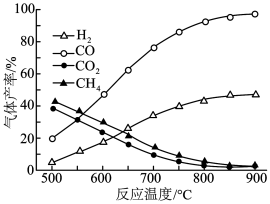
①约650℃之前,氢气产率低于甲烷的原因可能是_______ 。
②根据图像中相关物质的产率,推测该容器还发生了其它的副反应,该副反应的化学方程式为_______ 。
(2)T℃时、保持恒压(akPa)条件下,乙酸制氢反应达到平衡(假设只发生反应i和ii),此时测得混合气体中乙酸的体积分数为20%,乙酸的转化率为60%,则反应i的平衡常数Kp为_______ (kPa)3(Kp为以分压表示的平衡常数)。
Ⅱ.研究CH3COOH在电解质溶液里的离子平衡也有重要意义[已知Ka(CH3COOH)=1.75×10-5]。
(3)①常温下,某同学用酸碱中和滴定法测定某品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中 =
=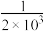 ,则此时溶液中的pH约为
,则此时溶液中的pH约为_______ (保留整数)。
②常温下,向25.00mL0.1mol/L氢氧化钠溶液中滴加0.2mol/L醋酸溶液至25.00mL,此时溶液中v(CH3COO-)+2c(OH-)=c(CH3COOH)+_______ [用c(B)表示]。
③已知常温下H2SO3的Ka1=1.4×10-2,Ka2=6.0×10-8,则足量醋酸与Na2SO3溶液反应的离子方程式为_______ 。
I.乙酸制氢具有重要意义,制氢过程发生如下反应等:
主反应i:CH3COOH(g)
 2CO(g)+2H2(g) △H1=+213.7kJ•mol-1
2CO(g)+2H2(g) △H1=+213.7kJ•mol-1副反应ii:CH3COOH(g)
 CH4(g)+CO2(g) △H2=-33.5kJ•mol-1
CH4(g)+CO2(g) △H2=-33.5kJ•mol-1(1)在容积相同的密闭容器中,均加入1molCH3COOH(g) (g),在相同时间测得温度与气体产率的关系如图所示:

①约650℃之前,氢气产率低于甲烷的原因可能是
②根据图像中相关物质的产率,推测该容器还发生了其它的副反应,该副反应的化学方程式为
(2)T℃时、保持恒压(akPa)条件下,乙酸制氢反应达到平衡(假设只发生反应i和ii),此时测得混合气体中乙酸的体积分数为20%,乙酸的转化率为60%,则反应i的平衡常数Kp为
Ⅱ.研究CH3COOH在电解质溶液里的离子平衡也有重要意义[已知Ka(CH3COOH)=1.75×10-5]。
(3)①常温下,某同学用酸碱中和滴定法测定某品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中
 =
=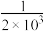 ,则此时溶液中的pH约为
,则此时溶液中的pH约为②常温下,向25.00mL0.1mol/L氢氧化钠溶液中滴加0.2mol/L醋酸溶液至25.00mL,此时溶液中v(CH3COO-)+2c(OH-)=c(CH3COOH)+
③已知常温下H2SO3的Ka1=1.4×10-2,Ka2=6.0×10-8,则足量醋酸与Na2SO3溶液反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】硫及其化合物在生产生活中有广泛应用。SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,其吸收SO2反应的离子方程式为___________ 。
(2)已知H2SO3的电离常数为Ka1=1.54×10-2mol·L-1,Ka2=1.024×10-7mol·L-1;H2CO3的电离常数为Ka1=4.30×10-7mol·L-1,Ka2=5.60×10-11mol·L-1,则下列微粒不能大量共存的是___________(填字母)。
(3)Na2SO3溶液吸收SO2的过程中,水溶液中H2SO3、HSO 、SO
、SO 随pH的分布如图:
随pH的分布如图:
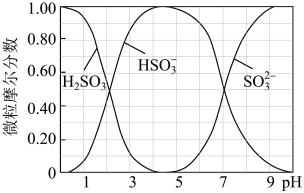
①吸收SO2制备NaHSO3溶液,实验中确定何时停止通SO2的实验操作为___________ 。
②在0.1mol·L-1NaHSO3溶液中离子浓度关系不正确的是___________ (填字母)。
A.c平(Na+)=c平(SO )+c平(HSO
)+c平(HSO )+c平(H2SO3)
)+c平(H2SO3)
B.c平(H2SO3)+c平(H+)=c平(SO )+c平(OH—)
)+c平(OH—)
C.c平(Na+)>c平(HSO )>c平(OH—)>c平(SO
)>c平(OH—)>c平(SO )
)
D.c平(Na+)+c平(H+)=c平(SO )+c平(HSO
)+c平(HSO )+c平(OH—)
)+c平(OH—)
(4)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈-1价;SOCl2遇水可生成SO2,请回答下列问题:
蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2·6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的化学方程式和必要的文字描述解释原因:___________ 。
(5)25℃时,向20mL0.1mol·L-1Na2S溶液中逐滴加入0.1mol·L-1的盐酸40mL,溶液的pH逐渐降低,溶液中含硫元素微粒的物质的量浓度的百分含量(纵轴)也发生变化,如图所示:

①B点对应的溶液中大量存在的溶质是___________ 。
②混合溶液的pH=___________ 时,溶液中开始有H2S气体放出。
③反应到A点时,加入0.1mol·L-1盐酸的体积___________ 20mL(填“>”“=”或“<”)。
(1)钠碱循环法中,吸收液为Na2SO3溶液,其吸收SO2反应的离子方程式为
(2)已知H2SO3的电离常数为Ka1=1.54×10-2mol·L-1,Ka2=1.024×10-7mol·L-1;H2CO3的电离常数为Ka1=4.30×10-7mol·L-1,Ka2=5.60×10-11mol·L-1,则下列微粒不能大量共存的是___________(填字母)。
A.CO 和HSO 和HSO | B.HCO 和HSO 和HSO | C.SO 和HCO 和HCO | D.H2SO3和HCO |
(3)Na2SO3溶液吸收SO2的过程中,水溶液中H2SO3、HSO
 、SO
、SO 随pH的分布如图:
随pH的分布如图:
①吸收SO2制备NaHSO3溶液,实验中确定何时停止通SO2的实验操作为
②在0.1mol·L-1NaHSO3溶液中离子浓度关系不正确的是
A.c平(Na+)=c平(SO
 )+c平(HSO
)+c平(HSO )+c平(H2SO3)
)+c平(H2SO3)B.c平(H2SO3)+c平(H+)=c平(SO
 )+c平(OH—)
)+c平(OH—)C.c平(Na+)>c平(HSO
 )>c平(OH—)>c平(SO
)>c平(OH—)>c平(SO )
)D.c平(Na+)+c平(H+)=c平(SO
 )+c平(HSO
)+c平(HSO )+c平(OH—)
)+c平(OH—)(4)亚硫酰氯(SOCl2)又名氯化亚砜,是一种液态的非电解质,沸点为77℃。SOCl2中氯元素与硫元素直接以共价键相连,其中Cl呈-1价;SOCl2遇水可生成SO2,请回答下列问题:
蒸干MgCl2溶液不能得到无水MgCl2,若将SOCl2与MgCl2·6H2O混合并加热,可制得无水MgCl2,请用SOCl2与水反应的化学方程式和必要的文字描述解释原因:
(5)25℃时,向20mL0.1mol·L-1Na2S溶液中逐滴加入0.1mol·L-1的盐酸40mL,溶液的pH逐渐降低,溶液中含硫元素微粒的物质的量浓度的百分含量(纵轴)也发生变化,如图所示:

①B点对应的溶液中大量存在的溶质是
②混合溶液的pH=
③反应到A点时,加入0.1mol·L-1盐酸的体积
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】25℃时,取0.l mol•L-1 HA溶液与0.1 mol•L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=9,试回答以下问题:
(1)混合溶液的pH=9的原因_____________________ (用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-) =______ mol•L-1 ,0.1 mol•L-1NaOH 溶液中由水电离出的c(OH-) =______ mol•L-1 。
(3)0.l mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合后,pH=8,则
① 所得混合液中c(HA)、c(A-)、c(Na+)、c(OH-)、c(H+) 浓度从大到小的顺序为:_________________ 。
② c(HA)+ c(A-)=_______ mol•L-1,c(HA)-c(A-)=_______ mol•L-1。
(4)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH________ 7(填“>”、“<”或“=”)。
(5)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序____ (填字母)。
A.NH4HCO3 B.NH4HSO4 C.NH4A D.NH4Cl
(1)混合溶液的pH=9的原因
(2)混合溶液中由水电离出的c(OH-) =
(3)0.l mol•L-1 HA溶液与0.05 mol•L-1 NaOH溶液等体积混合后,pH=8,则
① 所得混合液中c(HA)、c(A-)、c(Na+)、c(OH-)、c(H+) 浓度从大到小的顺序为:
② c(HA)+ c(A-)=
(4)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH
(5)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序
A.NH4HCO3 B.NH4HSO4 C.NH4A D.NH4Cl
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】二氧化碳的捕集和利用是寻找双碳解决之策最重要的部分。
(1)室温下在
 的
的 溶液中通入
溶液中通入 ,溶液中含碳物种的浓度
,溶液中含碳物种的浓度
 (不考虑通入
(不考虑通入 所引起的溶液体积变化和
所引起的溶液体积变化和 的挥发)。已知:
的挥发)。已知: 电离常数分别为
电离常数分别为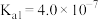 、
、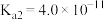 。
。
① 恰好完全转化为
恰好完全转化为 时,溶液中所含离子浓度由小到大的顺序为
时,溶液中所含离子浓度由小到大的顺序为___________ ,
___________ (用含碳微粒和氢离子浓度表示)。
②若吸收
 ,则溶液中
,则溶液中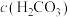
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ (用必要的计算数据和文字说明)。
③常温下,
 溶液的
溶液的 ,则该溶液中
,则该溶液中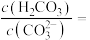
___________ 。
(2) 时,
时, 催化加氢法合成乙烯反应为:
催化加氢法合成乙烯反应为: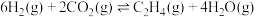
 。向2L的恒容密闭容器中加入
。向2L的恒容密闭容器中加入
 和
和
 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。___________ (填字母)。
② 下,自初始状态达到平衡时,放热为
下,自初始状态达到平衡时,放热为___________ kJ,该反应的化学平衡常数
___________ , 的平衡转化率为
的平衡转化率为___________ %。
(1)室温下在

 的
的 溶液中通入
溶液中通入 ,溶液中含碳物种的浓度
,溶液中含碳物种的浓度
 (不考虑通入
(不考虑通入 所引起的溶液体积变化和
所引起的溶液体积变化和 的挥发)。已知:
的挥发)。已知: 电离常数分别为
电离常数分别为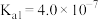 、
、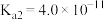 。
。①
 恰好完全转化为
恰好完全转化为 时,溶液中所含离子浓度由小到大的顺序为
时,溶液中所含离子浓度由小到大的顺序为
②若吸收

 ,则溶液中
,则溶液中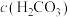
 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是③常温下,

 溶液的
溶液的 ,则该溶液中
,则该溶液中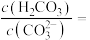
(2)
 时,
时, 催化加氢法合成乙烯反应为:
催化加氢法合成乙烯反应为: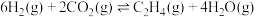
 。向2L的恒容密闭容器中加入
。向2L的恒容密闭容器中加入
 和
和
 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。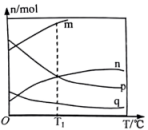
②
 下,自初始状态达到平衡时,放热为
下,自初始状态达到平衡时,放热为
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】三氧化二锑,又称锑白,在工业上作阻燃剂、填充剂等,用途广泛。一种利用辉锑矿粉(含 及少量
及少量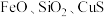 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
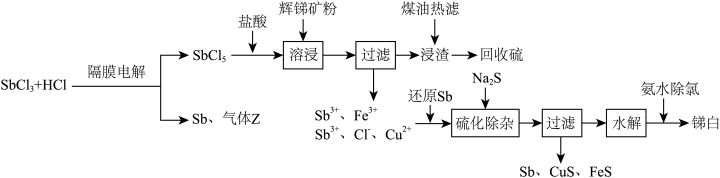
已知:①常温下,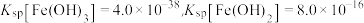 ,
, 。
。
②锑的常见价态为+3、+5价,其中 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。
(1)锑元素的原子序数为51,位于元素周期表第___________ 周期第___________ 族。
(2)溶浸时发生的主要反应的离子方程式为___________ 。
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是___________ 。
(4) 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:___________ ,锑白洗涤后便可干燥保存,检验洗净的试剂为___________ 。
(5)隔膜电解时,气体Z的分子式为___________ ;为平衡两极电荷,应使用___________ 交换膜(填“阴离子”“阳离子”或“质子”),理由是___________ 。
 及少量
及少量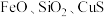 )制取锑白的工艺流程如图:
)制取锑白的工艺流程如图:
已知:①常温下,
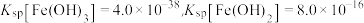 ,
, 。
。②锑的常见价态为+3、+5价,其中
 具有强氧化性,在溶液中能发生较剧烈的水解生成
具有强氧化性,在溶液中能发生较剧烈的水解生成 。
。(1)锑元素的原子序数为51,位于元素周期表第
(2)溶浸时发生的主要反应的离子方程式为
(3)加入还原Sb还原高价金属离子,能够提高产物锑白的纯度,原因是
(4)
 水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:
水解会生成多种物质,较为稳定的是SbOCl,写出SbOCl在稀氨水中最终生成锑白的化学方程式:(5)隔膜电解时,气体Z的分子式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】如图所示装置,用生成的氯气与乙二醛制备乙二酸,反应原理为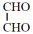 +2Cl2+2H2O→
+2Cl2+2H2O→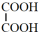 +4HCl。
+4HCl。
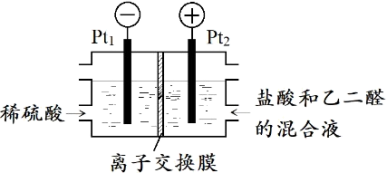
判断以下说法的正误:
⑤该装置利用上述反应将电能全部转化为化学能_____
⑥Pt1电极的反应式为2H2O+2e-=H2↑+2OH-_____
⑦盐酸除增强溶液导电性的作用,还提供Cl-参与电极反应_____
⑧理论上每得到0.1mol乙二酸,将有0.4molH+从右室迁移到左室_____
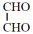 +2Cl2+2H2O→
+2Cl2+2H2O→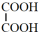 +4HCl。
+4HCl。
判断以下说法的正误:
⑤该装置利用上述反应将电能全部转化为化学能
⑥Pt1电极的反应式为2H2O+2e-=H2↑+2OH-
⑦盐酸除增强溶液导电性的作用,还提供Cl-参与电极反应
⑧理论上每得到0.1mol乙二酸,将有0.4molH+从右室迁移到左室
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
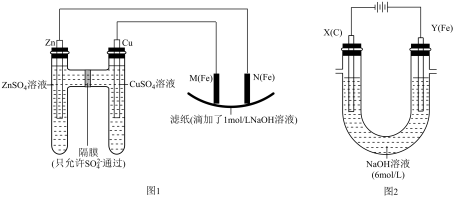
请回答:
Ⅰ.用如图1所示装置进行第一组实验:
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是_______ (填字母序号)。
A.铝B.石墨C.银D.铂
(2)M极发生反应的电极反应式为________ ;
(3)实验过程中,SO
________ (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有___________________ ,写出产生此现象的反应方程式:__________________ ;
Ⅱ.用如图2所示装置进行第二组实验:
(4)实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO )在溶液中呈紫红色。电解过程中,X极区溶液的pH
)在溶液中呈紫红色。电解过程中,X极区溶液的pH________ (填“增大”、“减小”或“不变”);
(5)电解过程中,Y极发生的电极反应为Fe﹣6e﹣+8OH﹣═FeO +4H2O和4OH﹣﹣4e﹣═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
+4H2O和4OH﹣﹣4e﹣═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________ g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2该电池正极的电极反应式为________ 。

请回答:
Ⅰ.用如图1所示装置进行第一组实验:
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A.铝B.石墨C.银D.铂
(2)M极发生反应的电极反应式为
(3)实验过程中,SO

Ⅱ.用如图2所示装置进行第二组实验:
(4)实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO
 )在溶液中呈紫红色。电解过程中,X极区溶液的pH
)在溶液中呈紫红色。电解过程中,X极区溶液的pH(5)电解过程中,Y极发生的电极反应为Fe﹣6e﹣+8OH﹣═FeO
 +4H2O和4OH﹣﹣4e﹣═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
+4H2O和4OH﹣﹣4e﹣═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2该电池正极的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】ZnS、CdSe均为重要的半导体材料,可应用于生物标记和荧光显示领域,并在光电器件、生物传感和激光材料等方面也得到了广泛的应用。
(1)基态Zn原子的价层电子排布式为______ 。
(2)S与P在周期表中是相邻元素,两者的第一电离能:S_____ P(填“>”、“<”或“=”),解释其原因_____ 。
(3)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。

①晶胞中,与Cd原子距离最近且相等的Se原子有_____ 个。
②已知,晶胞边长anm,阿伏加德罗常数为NA,CdSe的摩尔质量为191g•mol-1。则CdSe晶体的密度是_____ g•cm-3。(1nm=10-7cm)
(4)电化学沉积法可用于制备CdSe,其装置示意图如图。

电解过程中阳极有无色气泡产生,CdSe在阴极生成,纯度及颗粒大小会影响CdSe性能,沉积速率过快容易团聚。
①已知H2SeO3是弱酸。控制合适的电压,可以使Cd2+转化为纯净的CdSe,写出阴极的电极反应式:_____ 。
②研究表明,为得到更致密均匀的CdSe薄膜,可用二甲基甲酰胺( )做溶剂降低Cd2+浓度,从结构的角度分析原因:
)做溶剂降低Cd2+浓度,从结构的角度分析原因:_____ 。
(1)基态Zn原子的价层电子排布式为
(2)S与P在周期表中是相邻元素,两者的第一电离能:S
(3)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。

①晶胞中,与Cd原子距离最近且相等的Se原子有
②已知,晶胞边长anm,阿伏加德罗常数为NA,CdSe的摩尔质量为191g•mol-1。则CdSe晶体的密度是
(4)电化学沉积法可用于制备CdSe,其装置示意图如图。

电解过程中阳极有无色气泡产生,CdSe在阴极生成,纯度及颗粒大小会影响CdSe性能,沉积速率过快容易团聚。
①已知H2SeO3是弱酸。控制合适的电压,可以使Cd2+转化为纯净的CdSe,写出阴极的电极反应式:
②研究表明,为得到更致密均匀的CdSe薄膜,可用二甲基甲酰胺(
 )做溶剂降低Cd2+浓度,从结构的角度分析原因:
)做溶剂降低Cd2+浓度,从结构的角度分析原因:
您最近一年使用:0次
【推荐2】环状碳酸酯( )是一种重要的工业原料,可用作锂离子电池电解质的溶剂。一种由苯乙烯经电解制备环状碳酸酯的实验操作如下。
)是一种重要的工业原料,可用作锂离子电池电解质的溶剂。一种由苯乙烯经电解制备环状碳酸酯的实验操作如下。
ⅰ.将一定量电解质、苯乙烯、水-二甲亚砜溶剂依次放入塑料烧杯中,搅拌均匀后放入高压反应釜内,充入一定量CO2气体:
ⅱ.以石墨和铜片为两个电极,电解至苯乙烯完全消耗后,停止电解:
ⅲ.分离、提纯产品,计算产率。
在相同条件下,采用不同电解质进行实验I~IV,实验结果如表:
已知:ⅰ.电解效率η(B)= ×100%
×100%
ⅱ.I2在碱性环境中会歧化为I-和IO 。
。
(1)针对实验III进行如下分析:
①取反应后石墨电极附近溶液滴加淀粉溶液变蓝,则石墨作____ 极(填“阳”或“阴”)。
②苯乙烯与石墨电极上生成的物质发生反应,得到中间产物1—苯基—2—碘乙醇( ),写出可能存在的有机副产物的结构简式
),写出可能存在的有机副产物的结构简式____ 。
③1—苯基—2—碘乙醇在一定条件下转化为苯基环氧乙烷(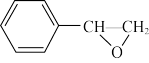 ),后者对CO2进行加成反应,得到的环状碳酸酯的结构简式为
),后者对CO2进行加成反应,得到的环状碳酸酯的结构简式为____ 。
④已知η(环状碳酸酯)≈63%,则电路中通过1mol电子时,产生___ mol环状碳酸酯。
(2)对比实验I~III可知,其他条件相同时,电解质分别选用NH4Cl、NH4Br、NH4I时,环状碳酸酯的产率依次显著升高,从原子结构角度解释,是因为____ ,导致Cl-、Br-、I-的放电能力依次增强。
(3)探究实验IV中未生成环状碳酸酯的原因,继续实验。
①实验IV中阴极产生气体的电极反应式为____ 。
②经X光单晶衍射实验证实,实验Ⅳ中得到的白色固体含NaIO3•H2O,用化学用语解释得到该物质的原理____ 。
③设计实验方案检测白色固体中的NaIO3•H2O,取少量白色固体溶于水,加稀硫酸酸化后,_____ 。可选试剂:Na2SO3溶液、KI溶液、淀粉溶液、CCl4。
 )是一种重要的工业原料,可用作锂离子电池电解质的溶剂。一种由苯乙烯经电解制备环状碳酸酯的实验操作如下。
)是一种重要的工业原料,可用作锂离子电池电解质的溶剂。一种由苯乙烯经电解制备环状碳酸酯的实验操作如下。ⅰ.将一定量电解质、苯乙烯、水-二甲亚砜溶剂依次放入塑料烧杯中,搅拌均匀后放入高压反应釜内,充入一定量CO2气体:
ⅱ.以石墨和铜片为两个电极,电解至苯乙烯完全消耗后,停止电解:
ⅲ.分离、提纯产品,计算产率。
在相同条件下,采用不同电解质进行实验I~IV,实验结果如表:
| 实验序号 | 电解质 | 产率/% | 实验现象 |
| I | NH4Cl | 微量 | 阴极产生气体,能使湿润的红色石蕊试纸变蓝 |
| II | NH4Br | 68 | |
| III | NH4I | 95 | |
| IV | NaI | 0 | 阴极产生气体;阳极附近有白色固体析出 |
 ×100%
×100%ⅱ.I2在碱性环境中会歧化为I-和IO
 。
。(1)针对实验III进行如下分析:
①取反应后石墨电极附近溶液滴加淀粉溶液变蓝,则石墨作
②苯乙烯与石墨电极上生成的物质发生反应,得到中间产物1—苯基—2—碘乙醇(
 ),写出可能存在的有机副产物的结构简式
),写出可能存在的有机副产物的结构简式③1—苯基—2—碘乙醇在一定条件下转化为苯基环氧乙烷(
 ),后者对CO2进行加成反应,得到的环状碳酸酯的结构简式为
),后者对CO2进行加成反应,得到的环状碳酸酯的结构简式为④已知η(环状碳酸酯)≈63%,则电路中通过1mol电子时,产生
(2)对比实验I~III可知,其他条件相同时,电解质分别选用NH4Cl、NH4Br、NH4I时,环状碳酸酯的产率依次显著升高,从原子结构角度解释,是因为
(3)探究实验IV中未生成环状碳酸酯的原因,继续实验。
①实验IV中阴极产生气体的电极反应式为
②经X光单晶衍射实验证实,实验Ⅳ中得到的白色固体含NaIO3•H2O,用化学用语解释得到该物质的原理
③设计实验方案检测白色固体中的NaIO3•H2O,取少量白色固体溶于水,加稀硫酸酸化后,
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】采用科学技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
(1)采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4.Ca(NO3)2的副产品,工业流程如图l所示。
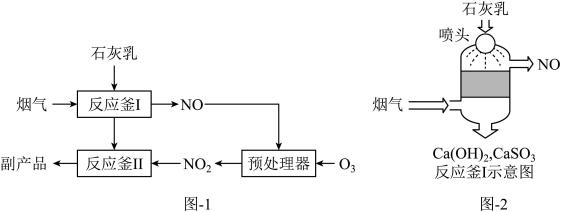
①反应釜I采用“气一液逆流”接触吸收法(如图-2),其优点是__________ 。
②反应釜Il中CaSO3转化为CaSO4的化学反应方程式为_______________________ 。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________ 。
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。
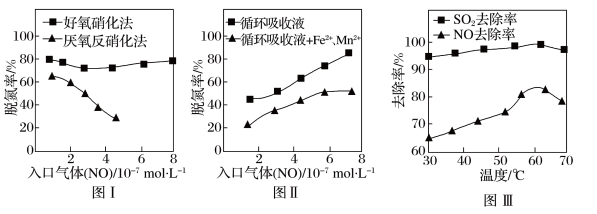
① 由图I知,当废气中的NO含量增加时,宜选用______ 法提高脱氮的效率。
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为________ 。
(4)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率下降的原因为__________ 。
②写出废气中的SO2与NaClO2反应的离子方程式:____________ 。
(1)采用“联合脱硫脱氮技术”处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4.Ca(NO3)2的副产品,工业流程如图l所示。

①反应釜I采用“气一液逆流”接触吸收法(如图-2),其优点是
②反应釜Il中CaSO3转化为CaSO4的化学反应方程式为
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。

① 由图I知,当废气中的NO含量增加时,宜选用
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为
(4)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率下降的原因为
②写出废气中的SO2与NaClO2反应的离子方程式:
您最近一年使用:0次



