1 . 镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
 Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是| A.充电时阳极反应:Ni(OH)2-e- + OH- =NiOOH+ H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
您最近一年使用:0次
2019-01-30更新
|
3950次组卷
|
101卷引用:【校级联考】湖南省浏阳一中、醴陵一中2018-2019学年高二上学期12月联考化学试题
【校级联考】湖南省浏阳一中、醴陵一中2018-2019学年高二上学期12月联考化学试题湖南省张家界市2019-2020学年高二上学期期末考试化学试题2008年普通高等学校招生统一考试化学试题(江苏卷)(已下线)山东省济南市2010届高三第一次模拟考试化学试卷(已下线)09~10年黄冈中学高二下学期期末考试化学卷(已下线)2010年浙江省嵊州一中高三上学期期中考试理综(化学)(已下线)2011届江苏省无锡一中高三上学期期中考试化学卷(已下线)2010年黑龙江省拜泉一中高二上学期期末考试化学试卷(已下线)2010—2011学年浙江省杭州二中高二上学期期末考试化学试卷(已下线)2011-2012学年安徽省濉溪县临涣中学高二上学期期中联考化学试卷(已下线)2011-2012学年山东省郓城一中高二上学期模块考试化学试卷(已下线)2011-2012学年山东省鄄城县第一中学高二上学期期中考试化学试卷(已下线)2011-2012学年山东省临沂市高二上学期期末模块质量调研化学试卷(已下线)2012届江苏省淮阴中学、海门中学、天一中学高三上学期联考化学试卷(已下线)2011-2012学年浙江省开化县华埠中学高二下学期3月月考试卷(已下线)2011-2012学年浙江省温州四中高二下学期期中考试化学试卷(已下线)2012-2013学年吉林省实验中学高二上学期期末考试化学试卷(已下线)2012-2013学年四川省雅安中学高二下学期期中考试化学试卷(已下线)2012-2013学年北京市第六十六中学高二下学期期中考试化学试卷(已下线)2012-2013学年山东省临沂市重点高中高二上学期期末考试化学试卷(已下线)2014届山东济南外国语学校高三上学期质量检测化学试卷 (已下线)2013-2014学年辽宁省抚顺市六校联合体高一下学期期末考试化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(A)卷(已下线)2014秋安徽省宿州市高二上学期期中化学(理)试卷2014-2015湖北省襄阳市四校高二12月联考化学试卷2014-2015学年四川省雅安中学高二下期末模拟化学试卷2015-2016学年辽宁省大连市第二十高级中学高二期初考试化学试卷2015-2016学年河北省唐山市一中高二上开学调研化学试卷2015-2016学年湖北省长阳一中高二第一学期第一次月考化学试卷2016届河北省邯郸市大名县第一中学高三上学期10月月考化学试卷2015-2016学年山东省新泰一中高二上学期期中测试化学试卷2016届四川省宜宾市第一中学高三上学期第10周周练化学试卷2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷2015-2016学年山西大学附中高二上12月月考化学试卷2015-2016学年河北省保定一中高二上学期第一次段考化学试卷2015-2016学年河南省孟津一中高二上学期期末化学试卷2015-2016学年广西桂林十八学高二下期中化学试卷2015-2016学年四川省华蓥市高二下期末化学试卷2016-2017学年黑龙江省哈尔滨市第六中学高二3月月考化学试卷河北省涞水波峰中学2017-2018学年高二(实验班)上学期9月月考化学试题山东省平阴县第一中学2017-2018学年高二10月月考化学试题河北省唐山一中2017-2018学年高二上学期期中考试化学试题高中化学人教版 必修2 第二章 化学反应与能量 第二节 化学能与电能 化学电源湖北省武汉2017-2018学年高二化学上学期期末考试题吉林省辽源市田家炳高级中学等五校2017-2018学年高二上学期期末联考化学试题四川省宜宾市南溪一中2017-2018学年高二下学期第一次月考化学试题新疆兵团第二师华山中学2017-2018学年高一下学期期中考试化学试题浙江省诸暨市牌头中学2017-2018学年高一下学期期中考试(A)化学试题安徽省肥东高级中学2017-2018学年高二下学期第二学段考试化学试题山东省鄄城市第一中学2018-2019学年高二上学期第一次月考化学试题黑龙江省绥芬河市高级中学2018-2019学年高二上学期期中考试化学试题重庆市万州第二高级中学2018-2019学年高二上学期期中考试化学试题【全国百强校】河北省石家庄市第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】广东省湛江市第一中学2018-2019学年高二上学期第二次大考(B卷)化学试题陕西省渭南市渭南中学2018-2019学年高二上学期第三次月考化学试题山东省沂水外国语2018-2019学年高二上学期第三次月考化学试卷【校级联考】甘肃省兰州市第二片区丙组2018-2019学年高二上学期期末联考化学试题【市级联考】甘肃省张掖市2018-2019学年高二上学期期末联考化学试题【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高二上学期期末考试化学试题【校级联考】江西省南昌市八一中学、洪都中学等七校2018-2019学年高二上学期期末考试化学试题四川省宜宾市南溪区第二中学校2018-2019学年高二下学期期中考试化学试题山东省济南第一中学2019-2020学年高二10月阶段性检测化学试题(已下线)考点09 原电池及化学电源——《备战2020年高考精选考点专项突破题集》广东省揭阳华侨高级中学2019-2020学年高二上学期12月月考化学试题广东省惠州市2019-2020学年高二上学期期末高中质量检测化学试题陕西省宝鸡市渭滨区2019—2020学年高二上学期期末考试化学试题吉林省长春市兴华中学2019-2020学年高二上学期期末考试化学试题2020年人教版高二化学选修4化学反应原理第4章《电化学基础》练习3-1陕西省西安中学2019-2020学年高二上学期期末考试化学试题2020届高三化学化学二轮复习——原电池【精编选择24题】黑龙江省牡丹江市穆棱市第一中学2019-2020学年高二上学期期末考试化学试题江苏省常州市田家炳高级中学 2019-2020学年高二上学期12月份阶段调研考试化学试题河北省唐山市第一中学2019-2020学年高一下学期期中考试化学试题宁夏自治区银川市北方民族大学附属中学2019-2020学年度(下)高二月考试卷甘肃省静宁县第一中学2019-2020学年高一下学期期中考试(第二次月考)化学试题江苏省无锡市普通高中2019-2020学年高二下学期期终调研考试化学(选修)试题河南省许昌市第三中学2019-2020学年高二上学期阶段性测试化学试题安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题福建师范大学第二附属中学2019-2020学年高二上学期期中考试化学(选考)试题安徽省六安市舒城县舒州中学2020-2021学年高二上学期12月月考化学试题(已下线)小题18 可充电电池装置 ——备战2021年高考化学经典小题考前必刷(全国通用)内蒙古集宁新世纪中学2020-2021学年高二下学期质量检测月考化学试题河北省张家口市第一中学2020-2021学年高二上学期10月月考(衔接班)化学 试题辽宁省大连市一0三中学2021-2022学年高二上学期期中考试化学试题新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 内蒙古巴彦淖尔市临河区第三中学2021-2022学年高二上学期期中考试化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月半月考化学试题吉林省通化市辉南县第六中学2022-2023学年高二上学期第一次月考化学试题北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题河北省邯郸市魏县第五中学2022-2023学年高二上学期11月期中化学试题福建省平潭翰英中学2021-2022学年高二上学期期中考试化学试题云南昆明市昆明行知中学2021-2022学年高二上学期期中考试化学试题(已下线)4.1.2 化学电源-同步学习必备知识黑龙江省哈尔滨市第一二二中学2021-2022学年高三假期检验性考试化学试题辽宁省辽河油田第二高级中学2022-2023学年高二上学期期末考试化学试题(已下线)第六章 化学反应与能量 第35练 原电池 化学电源陕西省西安市蓝田县2022-2023学年高二上学期期末考试化学试题河北省武安市第三中学2023-2024学年高二上学期开学考试化学试题上海市洋泾中学2023-2024学年高三上学期9月月考化学试题宁夏吴忠中学2023-2024学年高二上学期期末考试化学试题黑龙江省大庆实验中学实验二部2023-2024学年高二上学期期末考试化学试题
名校
2 . 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。下列关于该电池叙述错误的是
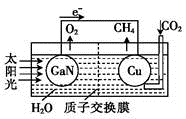

| A.为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
| B.Cu电极上的电极反应为CO2+8e-+8H+=CH4+2H2O |
| C.H+从左池移向右池 |
| D.当装置中有1 mol CH4生成时,GaN电极有44.8 L O2生成 |
您最近一年使用:0次
3 . 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨气的化学家。
(1)下图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答
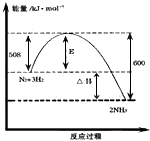
①写出氮气和氢气合成氨的热化学方程式:_____________ 。
②对于合成氨的反应下列说法正确的是_____________ (填编号)。
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
C.若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1>K2
D.该反应属于人工固氮
(2)现在普遍应用的工业合成氨的方法为N2+3H2 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是_________________ 。
A.使用的更高效催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生N2+3H2 2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=
2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________ 。从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为_____________________ 。
A. a B.b C.c D.d
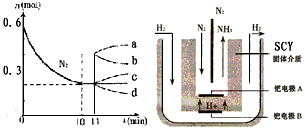
(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质里,用吸附在它内外表面上的金属钯多晶薄膜作电极,实现了常压、570℃条件下高转化率的电解法合成氮(装置如右上图)。则钯电极上的电极反应式是_____________________ 。
(1)下图表示了298K时氮气与氢气合成氨反应过程中的能量变化,据此请回答

①写出氮气和氢气合成氨的热化学方程式:
②对于合成氨的反应下列说法正确的是
A.该反应在任意条件下都可以自发进行
B.加入催化剂,能使该反应的E和△H都减小
C.若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1>K2
D.该反应属于人工固氮
(2)现在普遍应用的工业合成氨的方法为N2+3H2
 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用的更高效催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生N2+3H2
 2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=
2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=A. a B.b C.c D.d

(3)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到500℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质里,用吸附在它内外表面上的金属钯多晶薄膜作电极,实现了常压、570℃条件下高转化率的电解法合成氮(装置如右上图)。则钯电极上的电极反应式是
您最近一年使用:0次
名校
解题方法
4 . “天宫一号”使用镍氢电池供电。镍氢电池的负极材料为储氢合金(用—表示,氢以单原子填入合金晶格),总反应为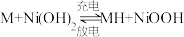 ,下列说法正确的是
,下列说法正确的是
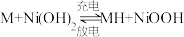 ,下列说法正确的是
,下列说法正确的是| A.电池充电时氢原子被氧化 |
B.电池放电时正极为 |
C.电池充电时,与电源负极相连的电极反应为: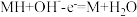 |
D.电池放电时,负极反应为: |
您最近一年使用:0次
5 . 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,当外电路中通过0.04 mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是

| A.VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,c电极表面先有红色物质析出,然后有气泡产生 |
| D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.2mol/L |
您最近一年使用:0次
名校
解题方法
6 . 锰酸锂(LiMn2O4)可作为锂离子电池的正极材料。工业上利用软锰矿浆吸收含硫烟气(SO2和O2)制备锰酸锂,生产流程如下:
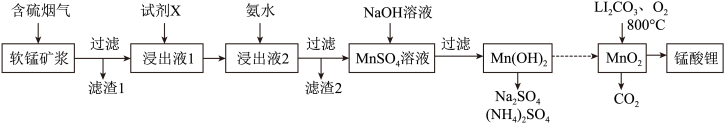
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质。
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
③部分氢氧化物沉淀相关的溶液pH如下表:
(1)已知:

下列措施可提高SO2吸收率的是__________ (填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是_____________ (填化学式)
(3)加氨水调溶液pH在5~6之间,目的是_______________ 。
(4)锰酸锂可充电电池的总反应式为:Li1-xMnO2+LixC LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
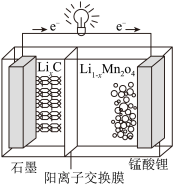
①放电时,电池的正极反应式为__________________
②充电时,若转移1mole-,则石墨电极将增重__________ g。

已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质。
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
③部分氢氧化物沉淀相关的溶液pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |

| 实验序号 | SO2浓度(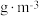 ) ) | 烟气流速(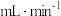 ) ) |
① | 4.1 | 55 |
② | 4.1 | 96 |
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是
(3)加氨水调溶液pH在5~6之间,目的是
(4)锰酸锂可充电电池的总反应式为:Li1-xMnO2+LixC
 LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
①放电时,电池的正极反应式为
②充电时,若转移1mole-,则石墨电极将增重
您最近一年使用:0次
2017-03-08更新
|
715次组卷
|
2卷引用:湖南省衡阳市第八中学2017-2018学年高二(实验班)上学期第一次月考理综化学试题
2011·湖南·一模
名校
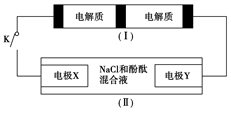
7 . 下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充、放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
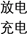 Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
| A.闭合开关K时,Na+从右到左通过离子交换膜 |
| B.闭合开关K时,负极反应式为3NaBr-2e-===NaBr3+2Na+ |
| C.闭合开关K时,当有0.1 mol Na+通过离子交换膜时,X电极上放出标准状况下气体1.12 L |
| D.闭合开关K时,X电极反应式为2Cl--2e-===Cl2↑ |
您最近一年使用:0次
2017-12-07更新
|
161次组卷
|
6卷引用:2012届湖南省四市九校高三上学期第一次联考化学试卷
(已下线)2012届湖南省四市九校高三上学期第一次联考化学试卷(已下线)2012-2013学年江苏省郑梁梅中学高二下学期期末考试化学试卷河北省衡水市安平中学2018届高三上学期期中考试化学试题云南省大理州漾濞一中2020届高三上学期开学考试化学试题安徽省滁州市民办高中2019-2020学年高二下学期期末考试化学试题(已下线)第24讲 电解池与金属腐蚀与保护-2021年高考化学一轮复习名师精讲练
名校
8 . 高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体。下列叙述正确的是
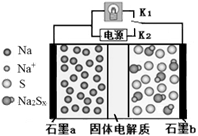

| A.放电时,石墨电极a为正极 |
| B.放电时,Na+从石墨b向石墨a方向迁移 |
| C.充电时,b极反应为Na2Sx -2e- = xS+2Na+ |
| D.可将装置中的固体电解质改成NaCl溶液 |
您最近一年使用:0次
2016-12-09更新
|
397次组卷
|
5卷引用:湖南省常德市第一中学2017届高三第八次月考理科综合化学试题
湖南省常德市第一中学2017届高三第八次月考理科综合化学试题2015届安徽省淮北市高三第二次模拟考试理综化学试卷2015-2016学年甘肃省兰州一中高二上学期期末化学试卷2016届四川省成都市邛崃市高埂中学高三上学期开学考试化学试卷(已下线)课时32 可充电电池装置-2022年高考化学一轮复习小题多维练(全国通用)
9 . 原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________ 池;
(2)下列反应能设计成原电池的是:__________
①2FeCl3+Fe=3FeCl2
②AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
③NaOH+HCl=NaCl+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为:________________________ 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式:___________ ;当甲中产生0.1mol气体时,乙中析出铜的质量应为________ g。
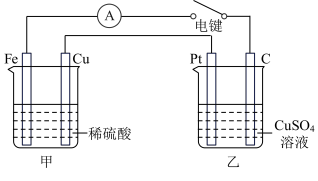
(1)可将化学能转化为电能是
(2)下列反应能设计成原电池的是:
①2FeCl3+Fe=3FeCl2
②AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
③NaOH+HCl=NaCl+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为:
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式:

您最近一年使用:0次
2011·重庆·一模
名校
10 . 全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
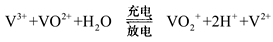 。下列说法正确的是
。下列说法正确的是
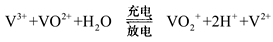 。下列说法正确的是
。下列说法正确的是A.放电时正极反应为: |
B.充电时阴极反应为: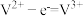 |
| C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 |
| D.充电过程中,H+由阴极区向阳极区迁移 |
您最近一年使用:0次
2016-12-09更新
|
1048次组卷
|
5卷引用:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷



