1 . 当今社会的主题之一:发展经济,节能减排。而燃料电池因其无污染,且原料来源广可再生被人们青睐,广泛应用于生产、生活、科学研究中,现有如下图所示装置,所有电极均为Pt,请按要求回答下列问题:_______ (填“原电池”或“电解池”),写出a极的电极反应_______ 。
(2)乙池中c极的电极反应_______ 。
(3)当b极消耗标准状况下的O2112mL时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的pH=_______ 。
(4)若CuSO4(aq)足够,电解一段时间后,要恢复到原来的状态,则可加入_______。
(5)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为_______ (写化学式),M为_______ 离子交换膜(填“阴”或“阳”)。

(2)乙池中c极的电极反应
(3)当b极消耗标准状况下的O2112mL时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的pH=
(4)若CuSO4(aq)足够,电解一段时间后,要恢复到原来的状态,则可加入_______。
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
您最近一年使用:0次
2021-12-25更新
|
812次组卷
|
3卷引用:湖南省A佳大联考2021-2022学年高二12月月考化学试题
名校
2 . 降低能耗是氯碳工业发展的重要方向。我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
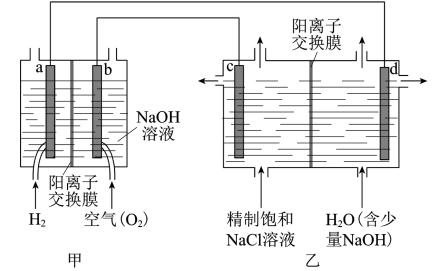
(1)a极的电极反应式为__ 。
(2)乙装置中电解饱和NaCl溶液的化学方程式为__ 。
(3)下列说法正确的是__ 。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
(4)结合化学用语解释d极区产生NaOH的原因:__ 。
(5)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为__ 。下列生产措施有利于提高Cl2产量、降低阳极O2产量的是__ 。
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(6)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为__ 。

(1)a极的电极反应式为
(2)乙装置中电解饱和NaCl溶液的化学方程式为
(3)下列说法正确的是
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
(4)结合化学用语解释d极区产生NaOH的原因:
(5)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(6)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
您最近一年使用:0次
2021-12-14更新
|
251次组卷
|
3卷引用:湖南省长沙市明德中学 2021-2022学年高二上学期12月月考化学试题
湖南省长沙市明德中学 2021-2022学年高二上学期12月月考化学试题辽宁省鞍山市普通高中2022-2023学年高二下学期第一次月考化学(A卷)试题(已下线)第29讲 第四章《化学反应与电能》单元测试(基础巩固)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
名校
解题方法
3 . “碳呼吸电池”是一种新型能源装置,其工作原理如图所示。下列有关说法不正确的是
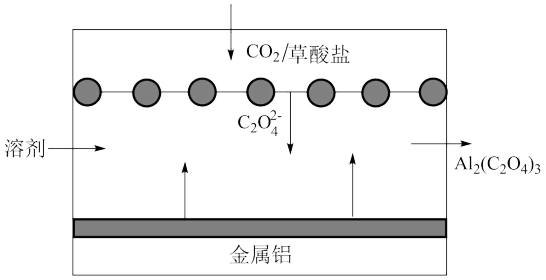

A.通入 的一极为原电池的正极 的一极为原电池的正极 |
B.该装置工作时负极的电极反应式为: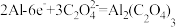 |
C.该装置工作时每转移 电子,理论上可捕获标准状况下 电子,理论上可捕获标准状况下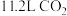 |
D.将该装置作为电源对粗铜进行精炼时,金属铝每减重 时,理论上阴极增重 时,理论上阴极增重 |
您最近一年使用:0次
2021-11-20更新
|
643次组卷
|
4卷引用:湖南省长沙市长郡中学2021-2022学年高三上学期月考试卷(三)化学试题
湖南省长沙市长郡中学2021-2022学年高三上学期月考试卷(三)化学试题湖南省常德市第一中学 2023届高三7月摸底考试化学试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)第34练 原电池-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
4 . 某课外活动小组用如图所示装置进行实验(电解液足量)。下列说法正确的是
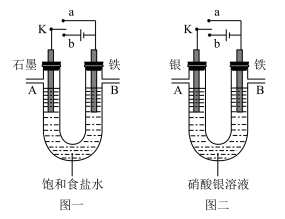

| A.图二中若开始实验时开关K与a连接,电解液的浓度保持不变 |
| B.图一中若开始实验时开关K与b连接,一段时间后向电解液中加适量稀盐酸可使电解液恢复到电解前的浓度 |
C.图一中若开始实验时开关K与a连接,B极的电极反应式为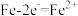 |
| D.图二中若开始实验时开关K与b连接,A极减少的质量等于B极增加的质量 |
您最近一年使用:0次
2021-11-14更新
|
413次组卷
|
4卷引用:湖南省长沙市第一中学、广东省深圳实验学校2021-2022学年高三上学期联考化学试题
5 . 锰酸锂电池曾在大型蓄电池应用领域占主导地位。放电时的总反应可以表示为:Li1-xMnO4+xLi=LiMnO4,下列说法正确的是
| A.放电时电池的正极反应为Li-e-=Li+ |
| B.充电时电池内部Li+向负极移动 |
| C.放电过程中,电极正极材料的质量减少 |
| D.充电时电池上标注有“+”的电极应与外接电源的负极相连 |
您最近一年使用:0次
名校
解题方法
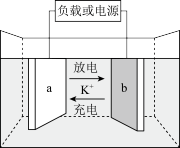
6 . 如图是一套模拟工业生产的电化学装置。丙装置中两电极均为惰性电极,电解质溶液为KCl溶液,不考虑气体溶解,且钾离子交换膜只允许钾离子通过。下列说法正确的是
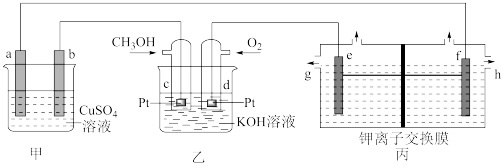

| A.若甲装置中b为精铜,a为镀件,则可实现a上镀铜 |
B.乙池通入CH3OH的电极反应式为CH3OH+6e-+2H2O=CO +8H+ +8H+ |
| C.丙装置可以制取KOH溶液,制得的KOH可以通过g口排出 |
| D.当d电极消耗标准状况下1.12LO2时,丙装置中阳极室溶液质量减少14.9g |
您最近一年使用:0次
2021-10-07更新
|
833次组卷
|
4卷引用:湖南省长沙市周南中学2021-2022学年高二上学期(12月)第三次阶段检测卷化学试题
名校
7 . 一种阴离子交换膜(AEM)与Ni-Fe析氧催化剂配对设计的电解槽,能高效低成本的电解纯水,原理如图所示。下列叙述正确的是
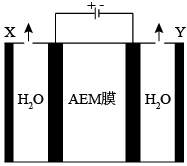

| A.电解时阳极反应为4OH--4e-=2H2O+O2↑ |
| B.电解时OH-由左向右穿过AEM膜 |
| C.右侧电极含有Ni-Fe析氧催化剂 |
| D.理论上两极生成气体的质量比为m(X):m(Y)=1:8 |
您最近一年使用:0次
2021-08-19更新
|
229次组卷
|
4卷引用:湖南省长沙市长郡中学2021届高三上学期第一次月考化学试题
湖南省长沙市长郡中学2021届高三上学期第一次月考化学试题山东省济钢高级中学2021-2022学年高二上学期第二次教学检测化学试题辽宁省丹东市东港第二高级中学2021-2022学年高二上学期11月第二次教学检测化学试题(已下线)专题20 电解池 金属的电化学腐蚀与防护(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练
名校
8 . 我国科学家研发了一种K-CO2二次电池,电池总反应为:4KSn+3CO2 2K2CO3+C+4Sn。下列说法错误的是
2K2CO3+C+4Sn。下列说法错误的是
 2K2CO3+C+4Sn。下列说法错误的是
2K2CO3+C+4Sn。下列说法错误的是
| A.充电时,a电极为阴极 |
| B.充电时,电路中每转移1 mol e-,b电极质量减少12 g |
| C.放电时,电子由a极经过外电路流向b极 |
| D.放电时,a电极发生的电极反应为:KSn-e-=K++Sn |
您最近一年使用:0次
2021-07-20更新
|
332次组卷
|
2卷引用:湖南省衡阳师范学院祁东附属中学2021-2022学年高三上学期12月月考化学试题
名校
解题方法
9 . 以甲烷为燃料的电池的工作原理如图所示,下列说法正确的是
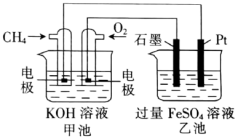

A.电池工作时,乙池中的 移向石墨 移向石墨 |
B.甲池中通入 的一极上发生的反应为 的一极上发生的反应为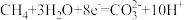 |
C.甲池中每消耗2.24L氧气,转移的电子数为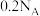 |
D.乙池Pt电极上发生的反应为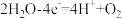 ↑ ↑ |
您最近一年使用:0次
2021-06-09更新
|
324次组卷
|
7卷引用:湖南省重点中学2020-2021学年高二下学期5月份联合考试化学试题
解题方法
10 . 过渡元素镍(Ni)、钒(V)、钛(Ti)等在工业上具有广泛的用途,根据原子结构与周期表及元素的性质,向答下列问题:
(1)镍可形成多种配合物,其中[Ni(NH3)6]SO4所含元素电负性最大的为___ (填元素符号),配位体的电子式为___ ,阴离子的立体构型是___ 。
(2)基态23V原子的电子排布式为___ ,其氧化物V2O5难溶于水,可以由VOCl3(易溶于水)水解来制备,反应的化学方程式为___ 。
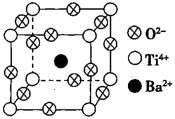
(3)钡钛矿晶体的晶胞结构如图所示,晶胞边长为acm。若该晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则a=___ cm(列出计算式,用ρ表示)。
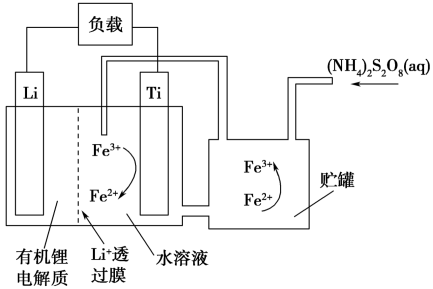
(4)钛可作为电池电极材料应用,在某种锂离子电池中,电池结构如图。写出钛电极上发生的电极反应式___ ,充电时,钛电极与电源___ 极相连。
(1)镍可形成多种配合物,其中[Ni(NH3)6]SO4所含元素电负性最大的为
(2)基态23V原子的电子排布式为
(3)钡钛矿晶体的晶胞结构如图所示,晶胞边长为acm。若该晶体的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则a=

(4)钛可作为电池电极材料应用,在某种锂离子电池中,电池结构如图。写出钛电极上发生的电极反应式

您最近一年使用:0次
2021-05-14更新
|
235次组卷
|
2卷引用:湖南省郴州市2022届高三上学期第一次月考化学试题



