名校
解题方法
1 . 下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到 336 mL (标准状态)气体。回答:

(1)直流电源中,M为_______ 极。
(2)Pt电极上生成的物质是_______ ,其质量为_______ g。
(3)电源输出电子的物质的量与电极b、c、d分别生成的物质的物质的量之比为2:_______ :_______ :_______ 。
(4)AgNO3溶液的浓度_______ (填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH_______ ,硫酸的浓度_______ ,硫酸的pH_______ 。
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸_______ g。

(1)直流电源中,M为
(2)Pt电极上生成的物质是
(3)电源输出电子的物质的量与电极b、c、d分别生成的物质的物质的量之比为2:
(4)AgNO3溶液的浓度
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸
您最近一年使用:0次
2022-03-31更新
|
84次组卷
|
4卷引用:云南省丘北县第一中学校2021-2022学年高二下学期开学考试化学试题
名校
2 . I.工业上H2O2是一种重要的绿色氧化还原试剂,某小组对 的催化分解实验进行探究。在同浓度
的催化分解实验进行探究。在同浓度 的催化下,探究
的催化下,探究 浓度对
浓度对 分解反应速率的影响。实验装置如图所示:
分解反应速率的影响。实验装置如图所示:

(1)写出 溶液在
溶液在 催化下分解的化学方程式
催化下分解的化学方程式_______ ;除了图中所示仪器之外,该实验还必需的仪器是_______ 。
(2)请写出下面表格中Ⅰ、Ⅱ、Ⅲ的实验记录内容或数据:
Ⅰ=_______ ,Ⅱ=_______ ,Ⅲ=_______ 。
II.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,并同时制得 和NaOH溶液.相关物料的传输与转化关系如图所示:
和NaOH溶液.相关物料的传输与转化关系如图所示:

请回答下列问题:
(3)A池总反应的离子反应方程式为_______ .燃料电池B中正负电极上发生反应分别为_______ ;_______ 。
(4)装置中的离子膜是阳离子交换膜,当阴极产生1molY时,A中通过离子交换膜的 有
有_______ mol。
(5)装置图中氢氧化钠溶液质量分数的大小:a%_______ b%(填“>”、“=”或“<”)。
 的催化分解实验进行探究。在同浓度
的催化分解实验进行探究。在同浓度 的催化下,探究
的催化下,探究 浓度对
浓度对 分解反应速率的影响。实验装置如图所示:
分解反应速率的影响。实验装置如图所示:
(1)写出
 溶液在
溶液在 催化下分解的化学方程式
催化下分解的化学方程式(2)请写出下面表格中Ⅰ、Ⅱ、Ⅲ的实验记录内容或数据:
| 实验序号 |  溶液的的体积/mL 溶液的的体积/mL | Ⅱ | 30% 溶液的体积/mL 溶液的体积/mL | 蒸馏水的体积/mL |  的体积/mL 的体积/mL |
| 1 | Ⅰ | b | c | d | e |
| 2 | a | b | d | Ⅲ | f |
II.氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,并同时制得
 和NaOH溶液.相关物料的传输与转化关系如图所示:
和NaOH溶液.相关物料的传输与转化关系如图所示:
请回答下列问题:
(3)A池总反应的离子反应方程式为
(4)装置中的离子膜是阳离子交换膜,当阴极产生1molY时,A中通过离子交换膜的
 有
有(5)装置图中氢氧化钠溶液质量分数的大小:a%
您最近一年使用:0次
3 . 一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法错误的是
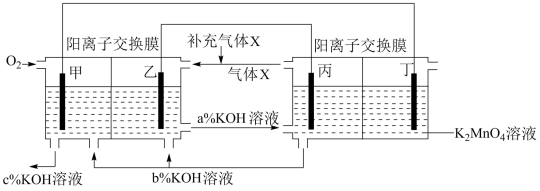

A.电极丁的反应式为MnO -e-=MnO -e-=MnO |
| B.气体X为氢气,电极乙附近溶液的pH减小 |
| C.KOH溶液的质量分数:c%>a%>b% |
| D.导线中流过2mol电子时,电解池中理论上有2molK+移入阴极区 |
您最近一年使用:0次
2021-09-10更新
|
1271次组卷
|
10卷引用:重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题
重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题河北省衡水中学2017届高三大联考(全国卷)理科综合化学试题吉林省辽源市第五中学2016-2017学年高二下学期期末考试化学试题(已下线)《考前20天终极攻略》-5月22日 电化学基础山西省太原市山西大学附属中学2019-2020学年高二上学期12月月考化学试题福建省泉州市永春第一中学2021-2022学年高二上学期9月线上考试化学试题福建省福州市八县(市、区)一中2021-2022学年高二上学期期中联考化学试题2021年广东省高考化学试卷变式题11-21(已下线)备战2022年高考化学精准检测卷【全国卷】05河北省保定市唐县第一中学2023-2024学年高二上学期12月期中考试化学试题
名校
解题方法
4 . CO2是温室气体,CO2的利用是解决温室效应的有效途径。试回答下列问题:
I.CO2催化制CH4
在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g) CH4(g) + 2H2O(g) △H1
CH4(g) + 2H2O(g) △H1
反应II CO2(g) + H2(g) CO(g) + H2O(g) △H2
CO(g) + H2O(g) △H2
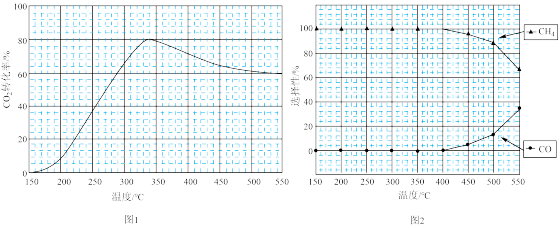
(1)①下列说法不正确的是___________
A.△H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
② 350℃时,反应I在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为___________ (用a、V表示)。
II.CO2电化学制CH4
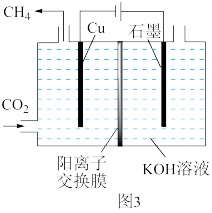
(2)图3表示以KOH溶液作电解质溶液进行电解的示意图,阴极的电极反应方程式为___________ ,电解一段时间后,阳极区KOH溶液的质量分数减小,其原因是___________ 。
(3)甲烷可以做燃料电池,具有广阔的开发和应用前景,某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验(如图4)。
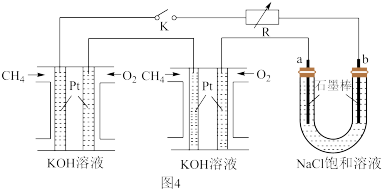
①通入甲烷气体的电极是原电池的___________ 极,其电极反应式为___________ 。
②a电极反应式为___________ 。
③如图4所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为22.4ml(标况),且反应完全。则理论上通过电解池的电量为___________ (单个电子的电荷量e=1.6×10-19 C,结果保留三位有效数字),若产生的气体全部逸出,电解后溶液混合均匀,温度恢复为室温,则电解后U形管中溶液的pH为___________ 。
III.CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3
(4)①Na2CO3俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式___________ 。已知25℃时, 第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c(
第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c( ):c(
):c( )=20:1时,溶液的pH=
)=20:1时,溶液的pH=___________ 。
I.CO2催化制CH4
在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应I CO2(g)+4H2(g)
 CH4(g) + 2H2O(g) △H1
CH4(g) + 2H2O(g) △H1反应II CO2(g) + H2(g)
 CO(g) + H2O(g) △H2
CO(g) + H2O(g) △H2
(1)①下列说法不正确的是
A.△H1小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1:3,可提高CO2平衡转化率
② 350℃时,反应I在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为
II.CO2电化学制CH4
(2)图3表示以KOH溶液作电解质溶液进行电解的示意图,阴极的电极反应方程式为

(3)甲烷可以做燃料电池,具有广阔的开发和应用前景,某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验(如图4)。

①通入甲烷气体的电极是原电池的
②a电极反应式为
③如图4所示U形管中氯化钠溶液的体积为800ml。闭合K后,若每个电池甲烷用量均为22.4ml(标况),且反应完全。则理论上通过电解池的电量为
III.CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3
(4)①Na2CO3俗称纯碱,因
 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式 第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c(
第一步水解的水解常数Kh=2×10﹣4mol/L,当溶液中c( ):c(
):c( )=20:1时,溶液的pH=
)=20:1时,溶液的pH=
您最近一年使用:0次
名校
解题方法
5 . 一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确 的是


| A.甲为正极,丙为阴极 |
B.丁极的电极反应式为 -e-=== -e-=== |
| C.KOH溶液的质量分数:c%>b%>a% |
| D.标准状况下,甲电极上每消耗22.4L气体时,理论上有2molK+移入阴极区 |
您最近一年使用:0次
2020-07-27更新
|
402次组卷
|
14卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题
黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题【省级联考】四省名校2019届高三下学期第三次大联考理科综合化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(A)内蒙古自治区集宁一中2019-2020学年高二上学期期中考试化学试题安徽省六安市毛坦厂中学2019-2020学年高二上学期期中考试化学(实验班)试题福建省厦门双十中学2020届高三上学期期中考试化学试题黑龙江省宾县一中2020届高三上学期第三次月考化学试题福建省南安市侨光中学2019-2020学年高二上学期第二次阶段考试化学试题(已下线)【新东方】 2020-21浙江省金华十校2020届高三11月模拟考试化学试题广东省汕头市金山中学2019-2020学年高二下学期期中考试化学试题甘肃省兰州市第一中学2019-2020学年高二上学期期末考试化学试题黑龙江省大庆铁人中学2020-2021学年高二上学期第一次月考化学试题湖南省邵阳市第二中学2021届高三下学期第一次月考化学试题
真题
名校
6 . 请回答氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______ (要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________ (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
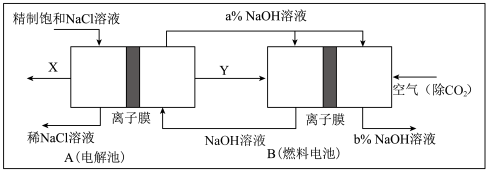
①图中X、Y分别是_____ 、_______ (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________ ;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______ ;负极:_____ ;
③这样设计的主要节(电)能之处在于(写出2处)____________ 、____________ 。
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中X、Y分别是
②分别写出燃料电池B中正极、负极上发生的电极反应正极:
③这样设计的主要节(电)能之处在于(写出2处)
您最近一年使用:0次
2016-12-09更新
|
195次组卷
|
7卷引用:2020年安徽省全省教学质量检测统一考试(练习检测一)
2020年安徽省全省教学质量检测统一考试(练习检测一)2009年普通高等学校招生统一考试理综试题化学部分(宁夏卷)2009年高考真题汇编-卤 素(已下线)2010年陕西省五校高三第一次模拟考试理综化学试题(已下线)2011-2012学年河南省平顶山市高一上学期期末调研考试化学试卷2016-2017学年江苏省如东高级中学高一下学期第一次(3月)阶段检测化学试卷云南省普洱市景东彝族自治县第一中学2019-2020学年高二下学期期中考试理综化学试题



