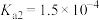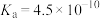2023高三·全国·专题练习
1 . 某实验小组同学利用如下装置对电化学原理进行了一系列探究活动。

(1)甲池反应前两电极质量相等,工作一段时间后,两电极质量相差14g,则导线中通过___________ mol电子。实验过程中,甲池左侧烧杯中 的浓度
的浓度___________ (选填“A:增大”“B:减小”或“C:不变”)。
(2)若乙池中为 溶液,则乙池发生的总反应方程式为
溶液,则乙池发生的总反应方程式为___________ 。工作一段时间后,若要使乙池中溶液恢复原浓度,可向溶液中加入___________ (填化学式)。
(3)若乙池中为 溶液,在一定条件下该装置可制备
溶液,在一定条件下该装置可制备 。已知
。已知 易溶于水,可与
易溶于水,可与 发生反应。产生
发生反应。产生 的电极反应方程式为
的电极反应方程式为___________ 。乙池中的交换膜是___________ 交换膜(选填“A:阴离子”或“B:阳离子”)。
(4)乙池也可用于保护金属或合金不被腐蚀,此时生铁和___________ 电极相连(选填“A:Cu”或“B:Ag”),这一方法的名称是___________ 。
(5)若将乙池改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为 溶液,则下列说法中正确的是___________
溶液,则下列说法中正确的是___________

(1)甲池反应前两电极质量相等,工作一段时间后,两电极质量相差14g,则导线中通过
 的浓度
的浓度(2)若乙池中为
 溶液,则乙池发生的总反应方程式为
溶液,则乙池发生的总反应方程式为(3)若乙池中为
 溶液,在一定条件下该装置可制备
溶液,在一定条件下该装置可制备 。已知
。已知 易溶于水,可与
易溶于水,可与 发生反应。产生
发生反应。产生 的电极反应方程式为
的电极反应方程式为(4)乙池也可用于保护金属或合金不被腐蚀,此时生铁和
(5)若将乙池改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),电解质溶液为
 溶液,则下列说法中正确的是___________
溶液,则下列说法中正确的是___________| A.电解过程中,阳极减少的质量与阴极增加的质量相等 |
| B.乙池左侧电极为粗铜,发生氧化反应 |
C. 溶液的浓度保持不变 溶液的浓度保持不变 |
| D.杂质中Ag、Pt、Au以单质的形式沉淀到池底 |
您最近一年使用:0次
名校
2 . 2019年诺贝尔化学奖授予对锂电池及锂离子电池研究做出贡献的三位科学家。
(1)最早的可充电锂电池用金属锂作负极。锂在元素周期表中的位置是_______ ,属于活泼金属,使电池存在较大安全隐患。
(2)现在广泛使用的锂离子电池有多种类型。某可充电钴酸锂(充、放电时某电极上发生 与
与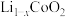 的相互转化)电池的工作原理如下图所示:
的相互转化)电池的工作原理如下图所示:

①该电池放电时,其中一极的电极反应式是 ,则该极应为上图中的
,则该极应为上图中的______ (填“A”或“B”)。另一极的电极反应式是________ 。
②碳酸乙烯酯(EC)常用作电解液的溶剂,其结构为 ,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式:
,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式:_________ 。
③从正极材料中回收钴和锂的流程如下:
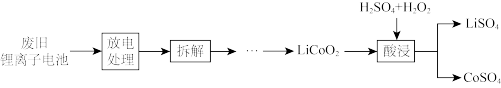
写出酸浸过程中发生反应的化学方程式__________ 。拆解废旧电池前需进行放电处理,既可保证安全又有利于回收锂。有利于回收锂的原因是_________ 。
(1)最早的可充电锂电池用金属锂作负极。锂在元素周期表中的位置是
(2)现在广泛使用的锂离子电池有多种类型。某可充电钴酸锂(充、放电时某电极上发生
 与
与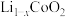 的相互转化)电池的工作原理如下图所示:
的相互转化)电池的工作原理如下图所示:
①该电池放电时,其中一极的电极反应式是
 ,则该极应为上图中的
,则该极应为上图中的②碳酸乙烯酯(EC)常用作电解液的溶剂,其结构为
 ,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式:
,熔点35℃,可燃,可由二氧化碳和有机物X在一定条件下合成。X与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成EC的化学方程式:③从正极材料中回收钴和锂的流程如下:

写出酸浸过程中发生反应的化学方程式
您最近一年使用:0次
名校
3 . 回答下列问题:
Ⅰ.25℃时,某些弱电解质的电离常数如表所示,回答下列问题。
(1)25℃时, 盐酸的pH约为
盐酸的pH约为______ ,该溶液中水电离出的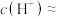
______  。
。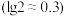
(2)少量的 通入
通入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为______ 。
(3) 发生水解反应的水解平衡常数
发生水解反应的水解平衡常数 表达式为
表达式为______ ;25℃时, 的水解平衡常数
的水解平衡常数
______ 其电离平衡常数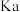 (填“>”或“<”),故
(填“>”或“<”),故 溶液显
溶液显______ 性。
Ⅱ.请分析如下电化学装置,回答下列问题:

(4)甲池为______ (填“原电池”“电解池”或“电镀池”),通入 电极的电极反应式正确的为
电极的电极反应式正确的为______ 。
A. B.
B.
C.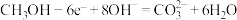 D.
D.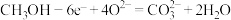
(5)当甲池中消耗 为1.12L(标准状况下)时,理论上乙池中B极质量增加
为1.12L(标准状况下)时,理论上乙池中B极质量增加______ g。
(6)丙池中发生的总反应化学方程式为______ ;为了防止丙池中两极产物相互反应,实际生产中在两极之间设有______ 离子交换膜(填“阴”或“阳”或“质子”)。
Ⅰ.25℃时,某些弱电解质的电离常数如表所示,回答下列问题。
弱电解质 |
|
| HClO |
电离常数 |
|
|
|
(1)25℃时,
 盐酸的pH约为
盐酸的pH约为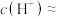
 。
。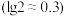
(2)少量的
 通入
通入 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为(3)
 发生水解反应的水解平衡常数
发生水解反应的水解平衡常数 表达式为
表达式为 的水解平衡常数
的水解平衡常数
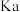 (填“>”或“<”),故
(填“>”或“<”),故 溶液显
溶液显Ⅱ.请分析如下电化学装置,回答下列问题:

(4)甲池为
 电极的电极反应式正确的为
电极的电极反应式正确的为A.
 B.
B.
C.
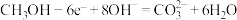 D.
D.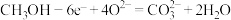
(5)当甲池中消耗
 为1.12L(标准状况下)时,理论上乙池中B极质量增加
为1.12L(标准状况下)时,理论上乙池中B极质量增加(6)丙池中发生的总反应化学方程式为
您最近一年使用:0次
名校
4 . 吸入氧气、排出二氧化碳,这看似再简单不过的新陈代谢,在遥远的太空中却并不容易,因为在航天服、航天器、空间站等密闭系统中,CO2浓度会高得多,而超过一定浓度会导致呼吸急促、头晕头痛、昏迷甚至死亡,因此必须通过一定方法将CO2清除。
I.非再生式氢氧化锂(LiOH)除碳技术
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附时发生反应的化学方程式为___________ 。采用LiOH而不用NaOH的原因是___________ 。
Ⅱ.再生式快速循环胺技术
(2)以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是___________ 变化(填“物理”或“化学”)。
Ⅲ.萨巴蒂尔(Sabatier)除碳生氧技术
(3)利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。

下列说法错误的是___________。
Ⅳ.富集CO2的原电池模拟装置如图:

(4)b极为___________ 极,a电极上发生的电极反应为___________ 。
(5)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(6)该装置若消耗2molH2,则理论上在b极除去CO2的质量为___________ 。
V.能量存储与循环技术
(7)将电解水装置与燃料电池配合使用,可实现充放电的循环过程,应用于长寿命的航天器中,工作原理如图:

关于该循环系统下列说法正确的是___________
I.非再生式氢氧化锂(LiOH)除碳技术
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附时发生反应的化学方程式为
Ⅱ.再生式快速循环胺技术
(2)以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是
Ⅲ.萨巴蒂尔(Sabatier)除碳生氧技术
(3)利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。

下列说法错误的是___________。
| A.CO2的最终产物为CH4和O2 |
| B.电解水装置中,反应物的能量低于生成物的能量 |
| C.萨巴蒂尔反应器中反应的氧化剂与还原剂质量之比为11∶1 |
| D.物质转化中O、H原子的利用率均为100% |
Ⅳ.富集CO2的原电池模拟装置如图:

(4)b极为
(5)上述电极材料采用多孔碳载镍,“多孔”的优点是
(6)该装置若消耗2molH2,则理论上在b极除去CO2的质量为
V.能量存储与循环技术
(7)将电解水装置与燃料电池配合使用,可实现充放电的循环过程,应用于长寿命的航天器中,工作原理如图:

关于该循环系统下列说法正确的是___________
| A.该系统中存在着太阳能、电能、化学能和机械能之间的相互转化 |
| B.电解池中可选用CuSO4来增强水的导电性 |
| C.太阳能电池帆板的主要成分为SiO2 |
| D.利用太阳能代替化石能源符合“低碳经济” |
您最近一年使用:0次
名校
5 . 氧化和还原是认识物质性质、分析化学变化的重要视角之一,对生产、生活乃至生命活动中有着十分重要的作用。
(1)下列物质间的转化,需要加入氧化剂才能实现的是_____。
(2)下列溶液中的离子因发生氧化还原反应而不能大量共存的是_____。
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2
①配平下列化学方程式并标出电子转移方向和个数。_____
_____NaIO3+_____NaHSO3—_____I2+_____Na2SO4+_____H2SO4+_____H2O
②在该反应中NaHSO3体现_____ (填“氧化性”或“还原性”),I2为_____ (填“氧化产物”或“还原产物”)。
③已知: 、I2、I-、
、I2、I-、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
_____ I-(填“>”或“<”),写出该反应的化学方程式_____ 。
化学能与电能之间的转化,是能量转化的重要形式之一,对于生产与生活有很多。

(4)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列叙述中正确的是_____。
(5)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是_____。
(6)用如图装置可以模拟铁的电化学防护,下列说法不正确的是_____。

(7)如图是乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料是石墨和铁中的一种,工作时M、N两个电极的质量都不减少
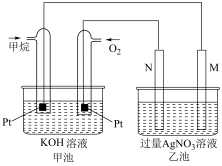
①甲池中通入乙醇的铂电极名称是_____ (选填“正极”、“负极”、“阴极”、“阳极”),通入O2的铂电极反应式为_____ 。
②乙池属于_____ (填“原电池”或“电解池”),工作时,乙池中电子流出的电极是_____ (选填“M”或N”);
③若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为_____ L(标况下);
④若用电解方法精炼粗铜,乙池电解液选用CuSO4溶液,则N电极的材料是_____ (选填“粗铜”或“精铜”),反应一段时间以后,电解液溶液的浓度_____ 。(选填“增大”、“减小”“不变”)
(1)下列物质间的转化,需要加入氧化剂才能实现的是_____。
| A.NH3→NO | B.Fe2O3→Fe |
| C.KClO3→Cl2 | D.H2SO4→SO2 |
(2)下列溶液中的离子因发生氧化还原反应而不能大量共存的是_____。
A.Fe2+、H+、 、 、 |
B.Cu2+、Al3+、 、Cl- 、Cl- |
C.K+、Al3+、OH-、 |
D.Ba2+、Na+、 、ClO- 、ClO- |
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2
①配平下列化学方程式并标出电子转移方向和个数。
_____NaIO3+_____NaHSO3—_____I2+_____Na2SO4+_____H2SO4+_____H2O
②在该反应中NaHSO3体现
③已知:
 、I2、I-、
、I2、I-、 和一些未知物组成的一个氧化还原反应,其中
和一些未知物组成的一个氧化还原反应,其中 是氧化产物,该反应中还原性
是氧化产物,该反应中还原性
化学能与电能之间的转化,是能量转化的重要形式之一,对于生产与生活有很多。

(4)汽车的启动电源常用铅酸蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列叙述中正确的是_____。
| A.PbO2是电池的负极 |
| B.Pb是负极 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
(5)港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是_____。
| A.防腐原理主要是避免发生反应:2Fe+O2+2H2O=2Fe(OH)2 |
| B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池 |
| C.采用外加电流的阴极保护时需外接镁、锌等作辅助阳极 |
| D.钢构件可采用不锈钢材料以减缓电化学腐蚀 |
(6)用如图装置可以模拟铁的电化学防护,下列说法不正确的是_____。

| A.若X为碳棒,开关K置于A处时,铁电极反应2H2O+2e-=H2+2OH- |
| B.若X为碳棒,开关K置于A处可以减缓铁的腐蚀 |
| C.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀 |
| D.若X为锌棒,开关K置于B处时,铁电极反应为2H++2e-=H2 |
(7)如图是乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料是石墨和铁中的一种,工作时M、N两个电极的质量都不减少

①甲池中通入乙醇的铂电极名称是
②乙池属于
③若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为
④若用电解方法精炼粗铜,乙池电解液选用CuSO4溶液,则N电极的材料是
您最近一年使用:0次
解题方法
6 . 研究金属腐蚀和防腐的原理很有现实意义,回答下列问题:
(1)某化学实验兴趣小组同学利用如图所示装置进行实验:
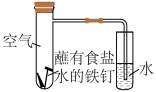
①该实验为___________ (填“析氢”或“吸氧”)腐蚀。
②实验进行一段时间后,在右侧小试管中,可观察到的现象为___________ 。
③在左侧大试管中,正极上发生反应的电极反应式为___________ 。
(2)实际生产中,可在铁的表面镀铜防止铁被腐蚀(如图所示):
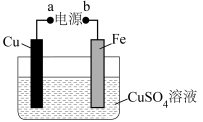
①a为电源的___________ (填“正极”或“负极”),判断的理由为___________ 。
②电镀时,Fe电极上发生反应的电极反应式为___________ 。
③电镀过程中,电解质溶液的pH将___________ (填“增大”、“减小”或“不变”)。
④电镀时,当电路中转移0.2mol电子时,此时两电极的质量差为_______ g(假设起始两电极的质量相等)。
(1)某化学实验兴趣小组同学利用如图所示装置进行实验:

①该实验为
②实验进行一段时间后,在右侧小试管中,可观察到的现象为
③在左侧大试管中,正极上发生反应的电极反应式为
(2)实际生产中,可在铁的表面镀铜防止铁被腐蚀(如图所示):

①a为电源的
②电镀时,Fe电极上发生反应的电极反应式为
③电镀过程中,电解质溶液的pH将
④电镀时,当电路中转移0.2mol电子时,此时两电极的质量差为
您最近一年使用:0次
2023-12-04更新
|
360次组卷
|
6卷引用:内蒙古部分名校2023-2024学年高二上学期期中联合考试化学试题
解题方法
7 . 电化学与能源、材料、化工等领域紧密联系,应用广泛。
(1)利用 燃料电池电解制备
燃料电池电解制备 ,并得到副产物
,并得到副产物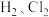 等,装置如图。
等,装置如图。

① 极为
极为________ (填“正极”、“负极”、“阴极”或“阳极”), 电极上的电极反应式为
电极上的电极反应式为_______ 。
②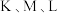 膜为离子交换膜,其中阳离子交换膜是
膜为离子交换膜,其中阳离子交换膜是___________ (填“K膜”、“L膜”、或“M膜”)
③ 极上消耗标准状况下
极上消耗标准状况下 的
的 ,理论上阳极室减少
,理论上阳极室减少___________  。
。
(2)用 溶液制备
溶液制备 的过程如图。
的过程如图。

①“灼烧”时得到了 ,该反应能自发的原因是
,该反应能自发的原因是___________ 。
②“电解”时阳极用石墨电极,阳极电极反应式为___________ 。
(1)利用
 燃料电池电解制备
燃料电池电解制备 ,并得到副产物
,并得到副产物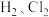 等,装置如图。
等,装置如图。
①
 极为
极为 电极上的电极反应式为
电极上的电极反应式为②
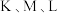 膜为离子交换膜,其中阳离子交换膜是
膜为离子交换膜,其中阳离子交换膜是③
 极上消耗标准状况下
极上消耗标准状况下 的
的 ,理论上阳极室减少
,理论上阳极室减少 。
。(2)用
 溶液制备
溶液制备 的过程如图。
的过程如图。
①“灼烧”时得到了
 ,该反应能自发的原因是
,该反应能自发的原因是②“电解”时阳极用石墨电极,阳极电极反应式为
您最近一年使用:0次
名校
8 . 以CH3OH燃料电池为电源电解法制取ClO2,二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
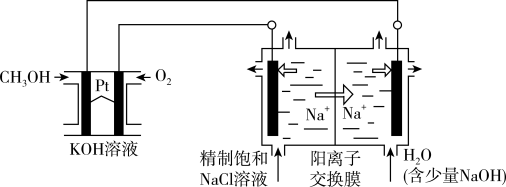
(1)CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH___________ (填“增大减小”或“不变”),负极反应式为。________________ 。
(2)图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,阳极产生ClO2的反应式为_______________ 。
(3)电解一段时间,从阴极处收集到的气体比阳极处收集到的气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为___________ mol。

(1)CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH
(2)图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,阳极产生ClO2的反应式为
(3)电解一段时间,从阴极处收集到的气体比阳极处收集到的气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为
您最近一年使用:0次
2023-12-02更新
|
98次组卷
|
2卷引用:海南省农垦中学2023-2024学年高二上学期第一次月考化学试题
名校
9 . 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入 和空气,其中固体电解质是掺杂了
和空气,其中固体电解质是掺杂了 的
的 固体,它在高温下能传导正极生成的
固体,它在高温下能传导正极生成的 离子(
离子( )。
)。
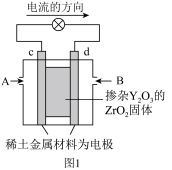
(1)c电极为___________ 极,c电极上的电极反应式为___________ 。
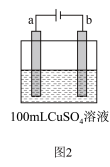
(2)如图2所示为用惰性电极电解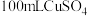 溶液,a电极上的电极反应式为
溶液,a电极上的电极反应式为___________ ;电解一段时间后,a电极产生气体,b电极不产生气体,则溶液的
___________ (填“减小”或“增大”)。
(3)在工业上,利用该电池电解 溶液生产
溶液生产 ,装置如图。
,装置如图。
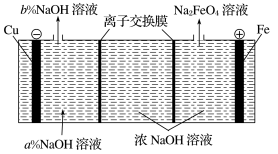
①阳极的电极反应式为___________ 。
②阴极产生的气体为___________ 。
③右侧的离子交换膜为___________ (填“阴”或“阳”)离子交换膜,阴极区a%___________ b%(填“>”“=”或“<”)。
 和空气,其中固体电解质是掺杂了
和空气,其中固体电解质是掺杂了 的
的 固体,它在高温下能传导正极生成的
固体,它在高温下能传导正极生成的 离子(
离子( )。
)。
(1)c电极为
(2)如图2所示为用惰性电极电解
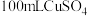 溶液,a电极上的电极反应式为
溶液,a电极上的电极反应式为

(3)在工业上,利用该电池电解
 溶液生产
溶液生产 ,装置如图。
,装置如图。
①阳极的电极反应式为
②阴极产生的气体为
③右侧的离子交换膜为
您最近一年使用:0次
2023-12-01更新
|
297次组卷
|
2卷引用:黑龙江省齐齐哈尔市普高联谊校2023-2024学年高三上学期11月月考化学试题
名校
10 . 根据所学电化学知识,回答下列问题:
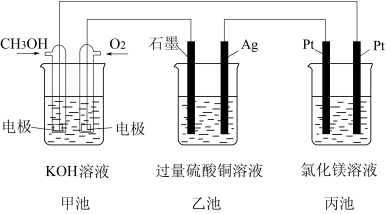
(1)①甲池中通入CH3OH的电极名称是___________ 极;写出其电极反应式___________ ;乙池中石墨电极反应式为___________ ;丙池中反应的离子方程式为___________ 。
②反应一段时间后,甲池中消耗560mL(标准状况下)O2,此时乙池溶液的c(H+)=___________ ;若向乙池中加入___________ ,其质量为___________ g,能使CuSO4溶液恢复到原浓度(假设电解前后溶液的体积不变,均为100mL)。丙池中理论上最多产生___________ g 固体。
(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,写出此过程中阴极上的电极反应式___________ 。

(1)①甲池中通入CH3OH的电极名称是
②反应一段时间后,甲池中消耗560mL(标准状况下)O2,此时乙池溶液的c(H+)=
(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,写出此过程中阴极上的电极反应式
您最近一年使用:0次