解题方法
1 . 回答下列问题:
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:_______ 。
②已知H2O(l)=H2O(g) ΔH=44kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是_______ kJ。
③上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是_______ 。
(2)如图所示,某研究性学习小组利用上述氧化还原反应原理设计一个肼(N2H4)-空气燃料电池(如图甲)并探究某些工业原理。
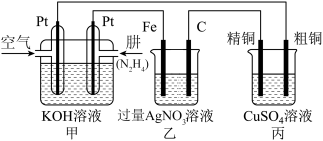
根据要求回答相关问题:
①甲装置中正极的电极反应式为_______ 。
②乙装置中Fe电极的电极反应式为_______ 。电解一段时间后,乙装置中的溶液呈_______ 性。
③图中用丙装置模拟工业中的_______ 原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中消耗肼的质量为_______ g。
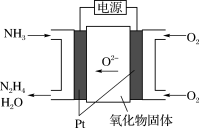
(3)工业上利用N2和H2合成NH3,NH3又可以进一步制备肼(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为_______ 。有学者探究用电解法制备,装置如图所示,试写出其阳极的电极反应式:_______ 。
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式:
②已知H2O(l)=H2O(g) ΔH=44kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
③上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
(2)如图所示,某研究性学习小组利用上述氧化还原反应原理设计一个肼(N2H4)-空气燃料电池(如图甲)并探究某些工业原理。

根据要求回答相关问题:
①甲装置中正极的电极反应式为
②乙装置中Fe电极的电极反应式为
③图中用丙装置模拟工业中的
(3)工业上利用N2和H2合成NH3,NH3又可以进一步制备肼(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为

您最近一年使用:0次
解题方法
2 . 科学家利用CO2和H2合成CH3OH有利于实现碳中和。主要反应有:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g),ΔH2
CO(g)+H2O(g),ΔH2
Ⅲ.CO(g)+2H2(g) CH3OH(g),ΔH3=-90.6kJ·mol-1
CH3OH(g),ΔH3=-90.6kJ·mol-1
回答下列问题:
(1)ΔH2=_______ kJ·mol-1,反应Ⅲ在_______ (填“高温”或“低温”)易自发进行。
(2)若将反应I看成由反应Ⅱ和反应Ⅲ两步进行,反应Ⅱ为慢反应,画出由反应原料经两步生成产物的反应过程能量示意图_______ 。

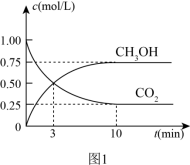
(3)一定条件下,在体积为1L的密闭容器中发生反应Ⅰ,起始物n(H2)/n(CO2)=3,CO2(g)和CH3OH(g)的浓度随时间变化如图1所示,3min内用H2浓度变化表示的反应速率_______ mol·L-1·min-1.若平衡时压强为P0,该反应条件的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)反应Ⅱ中,为提高H2的转化率,可采取的措施有_______ (任意答一条)。
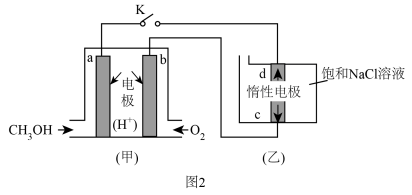
(5)图2是以甲醇燃料电池为电源电解饱和食盐水,甲装置a电极反应式为_______ 。当甲装置中消耗11.2LO2(标准状况),理论上乙装置中通过导线的电子数目为_______ 。
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g),ΔH2
CO(g)+H2O(g),ΔH2Ⅲ.CO(g)+2H2(g)
 CH3OH(g),ΔH3=-90.6kJ·mol-1
CH3OH(g),ΔH3=-90.6kJ·mol-1回答下列问题:
(1)ΔH2=
(2)若将反应I看成由反应Ⅱ和反应Ⅲ两步进行,反应Ⅱ为慢反应,画出由反应原料经两步生成产物的反应过程能量示意图

(3)一定条件下,在体积为1L的密闭容器中发生反应Ⅰ,起始物n(H2)/n(CO2)=3,CO2(g)和CH3OH(g)的浓度随时间变化如图1所示,3min内用H2浓度变化表示的反应速率

(4)反应Ⅱ中,为提高H2的转化率,可采取的措施有
(5)图2是以甲醇燃料电池为电源电解饱和食盐水,甲装置a电极反应式为

您最近一年使用:0次
3 . 氨的用途十分广泛,是制造硝酸和氮肥的重要原料。
(1)工业合成氨中,合成塔中每产生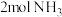 ,放出92.2kJ热量。
,放出92.2kJ热量。

1mol N-H键断裂吸收的能量约等于___________ kJ
(2)一定条件下,在恒温恒容的密闭容器中加入等物质的量 和
和 发生反应生成
发生反应生成 下列状态能说明反应达到平衡的是___________(填标号)。
下列状态能说明反应达到平衡的是___________(填标号)。
(3)以氨为原料生产尿素的方程式为 。
。
①为进一步提高 的平衡转化率,下列措施能达到目的的是
的平衡转化率,下列措施能达到目的的是___________ (填标号)。
A.增大 的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
②尿素的合成分两步进行:
a.
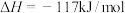
b.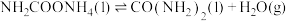

第一步反应速率快,可判断活化能较大的是___________ (填“第一步”或“第二步”)。
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的 和
和 发生反应:
发生反应: ,反应过程中混合气体中
,反应过程中混合气体中 的体积分数如下图所示。
的体积分数如下图所示。
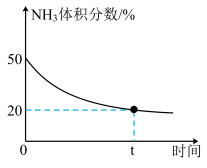
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数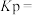
___________ (已知:分压=总压×体积分数)。
(4)中国首个空间实验室——“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。a、b、c、d均为Pt电极。
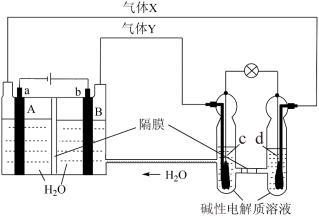
气体X为___________ ,A区pH___________ (填“变大”或“变小”或“不变”)图中右管中的 通过隔膜向
通过隔膜向___________ 电极移动(填“c”或“d”),c是___________ 极,电极上的电极反应为___________ 。
(1)工业合成氨中,合成塔中每产生
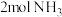 ,放出92.2kJ热量。
,放出92.2kJ热量。
1mol N-H键断裂吸收的能量约等于
(2)一定条件下,在恒温恒容的密闭容器中加入等物质的量
 和
和 发生反应生成
发生反应生成 下列状态能说明反应达到平衡的是___________(填标号)。
下列状态能说明反应达到平衡的是___________(填标号)。| A.容器内压强不变 | B. 的体积分数不变 的体积分数不变 |
| C.气体的密度不再改变 | D. |
(3)以氨为原料生产尿素的方程式为
 。
。①为进一步提高
 的平衡转化率,下列措施能达到目的的是
的平衡转化率,下列措施能达到目的的是A.增大
 的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂
的浓度 B.增大压强 C.及时转移生成的尿素 D.使用更高效的催化剂②尿素的合成分两步进行:
a.

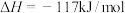
b.
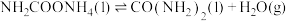

第一步反应速率快,可判断活化能较大的是
③某实验小组为了模拟工业上合成尿素,在恒温恒容的真空密闭容器中充入一定量的
 和
和 发生反应:
发生反应: ,反应过程中混合气体中
,反应过程中混合气体中 的体积分数如下图所示。
的体积分数如下图所示。
实验测得体系平衡时的压强为10MPa,计算该反应的平衡常数
(4)中国首个空间实验室——“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。a、b、c、d均为Pt电极。

气体X为
 通过隔膜向
通过隔膜向
您最近一年使用:0次
名校
4 . 电化学原理在电池制造、能量转换、物质合成等方面应用广泛。
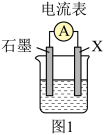
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为_____ (填化学式),石墨电极的电极反应式为_____ 。将石墨换成铁电极后,电池总反应变为_____ 。
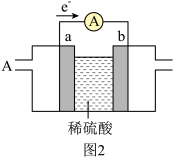
(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为_____ 极,正极的电极反应式为_____ 。当通入4.48L(标准状况下)甲烷气体时,测得电路中转移1.1mol电子,则甲烷的利用率为_____ 。(保留小数点后1位)。
(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为_____ 。当H2和CO共生成2mol时,生成标准状况下O2的体积为_____ 。
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为

(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为

(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为
您最近一年使用:0次
2023-04-29更新
|
236次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一下学期期中考试化学(A)试题
名校
解题方法
5 . 请回答下列问题:
(1)工业上以 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。
反应分两步:i. 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
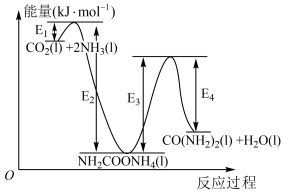
结合反应过程中能量变化示意图,合成尿素总反应的 为
为___________ 。(用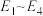 列式表示)
列式表示)
(2)根据表格计算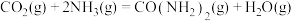

___________ 。
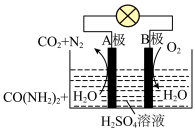
(3)尿素 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为___________ 。
(4)近年研究发现,电催化 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
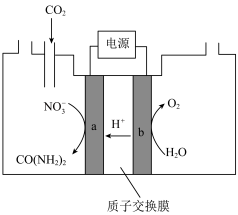
①电极b是电解池的___________ 极。
②尿素分子中,C元素的价态为___________ 。电解过程中生成尿素的电极反应为___________ 。
(5)以石墨为阳极、铁为阴极电解含 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。

①0~1 min时,阴极发生的主要电极反应方程式为___________ 。
②若向废水中加入一定量的NaCl,则电解后的废水中 几乎完全转化为
几乎完全转化为 ,原因是
,原因是___________ 。
(1)工业上以
 和
和 为原料在一定温度和压强下合成尿素。
为原料在一定温度和压强下合成尿素。反应分两步:i.
 和
和 生成
生成 ;ii.
;ii. 分解生成尿素。
分解生成尿素。
结合反应过程中能量变化示意图,合成尿素总反应的
 为
为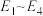 列式表示)
列式表示)(2)根据表格计算
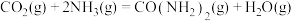

| 化学键 |  |  |  |  |
键能( ) ) | 389 | 728 | 305 | 464 |
(3)尿素
 燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
燃料电池可直接去除城市废水中的尿素,既能产生净化水,又能发电。其装置如下图所示,正极反应为
(4)近年研究发现,电催化
 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
①电极b是电解池的
②尿素分子中,C元素的价态为
(5)以石墨为阳极、铁为阴极电解含
 废水可用于去除
废水可用于去除 。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
。电解过程中各种含氮微粒的浓度、溶液的pH与时间的关系如图所示。
①0~1 min时,阴极发生的主要电极反应方程式为
②若向废水中加入一定量的NaCl,则电解后的废水中
 几乎完全转化为
几乎完全转化为 ,原因是
,原因是
您最近一年使用:0次
名校
6 . 回答下列问题:
(1)已知: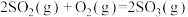
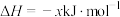
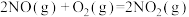
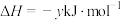
则反应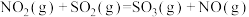 的
的 =
=______  。
。
(2)二十世纪初,工业上以 和
和 ,为原料在一定温度和压强下合成尿素。反应分两步:
,为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ. 和
和 生成
生成 ;
;
ⅱ. 分解生成尿素。
分解生成尿素。
①合成尿素反应的热化学方程式为______ 。
②结合反应过程中能量变化示意图1,下列说法正确的是______ (填序号)。

a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.对总反应速率影响较大的是反应ⅰ
(3)某研究团队合成的低配位Cu在碱性条件下催化 还原生成乙烯的电化学装置如图2所示。
还原生成乙烯的电化学装置如图2所示。
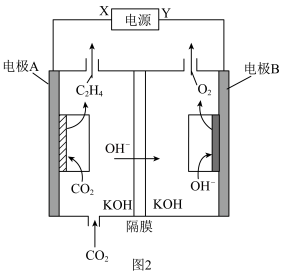
①Y为电源的______ (填“正极”或“负极”)。
②电极A上的电极反应式为______ 。
③理论上电极A上消耗的 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为______ 。
(4)以Al和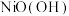 为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的
为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的______ 电极(填“Al”或“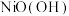 ”),该电化学防护法称为
”),该电化学防护法称为______ 。
(1)已知:
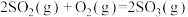
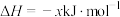
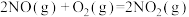
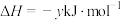
则反应
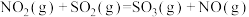 的
的 =
= 。
。(2)二十世纪初,工业上以
 和
和 ,为原料在一定温度和压强下合成尿素。反应分两步:
,为原料在一定温度和压强下合成尿素。反应分两步:ⅰ.
 和
和 生成
生成 ;
;ⅱ.
 分解生成尿素。
分解生成尿素。①合成尿素反应的热化学方程式为
②结合反应过程中能量变化示意图1,下列说法正确的是

a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.对总反应速率影响较大的是反应ⅰ
(3)某研究团队合成的低配位Cu在碱性条件下催化
 还原生成乙烯的电化学装置如图2所示。
还原生成乙烯的电化学装置如图2所示。
①Y为电源的
②电极A上的电极反应式为
③理论上电极A上消耗的
 与电极B上生成的
与电极B上生成的 的物质的量之比为
的物质的量之比为(4)以Al和
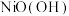 为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的
为电极,NaOH溶液为电解液组成一种新型电池,该电池保护地下铁管道不被腐蚀,铁管道应连接电池的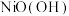 ”),该电化学防护法称为
”),该电化学防护法称为
您最近一年使用:0次



