科学家利用CO2和H2合成CH3OH有利于实现碳中和。主要反应有:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g),ΔH2
CO(g)+H2O(g),ΔH2
Ⅲ.CO(g)+2H2(g) CH3OH(g),ΔH3=-90.6kJ·mol-1
CH3OH(g),ΔH3=-90.6kJ·mol-1
回答下列问题:
(1)ΔH2=_______ kJ·mol-1,反应Ⅲ在_______ (填“高温”或“低温”)易自发进行。
(2)若将反应I看成由反应Ⅱ和反应Ⅲ两步进行,反应Ⅱ为慢反应,画出由反应原料经两步生成产物的反应过程能量示意图_______ 。

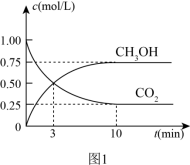
(3)一定条件下,在体积为1L的密闭容器中发生反应Ⅰ,起始物n(H2)/n(CO2)=3,CO2(g)和CH3OH(g)的浓度随时间变化如图1所示,3min内用H2浓度变化表示的反应速率_______ mol·L-1·min-1.若平衡时压强为P0,该反应条件的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)反应Ⅱ中,为提高H2的转化率,可采取的措施有_______ (任意答一条)。
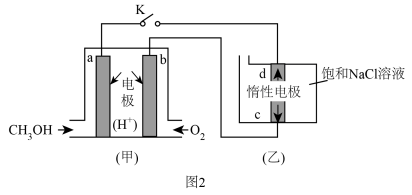
(5)图2是以甲醇燃料电池为电源电解饱和食盐水,甲装置a电极反应式为_______ 。当甲装置中消耗11.2LO2(标准状况),理论上乙装置中通过导线的电子数目为_______ 。
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g),ΔH2
CO(g)+H2O(g),ΔH2Ⅲ.CO(g)+2H2(g)
 CH3OH(g),ΔH3=-90.6kJ·mol-1
CH3OH(g),ΔH3=-90.6kJ·mol-1回答下列问题:
(1)ΔH2=
(2)若将反应I看成由反应Ⅱ和反应Ⅲ两步进行,反应Ⅱ为慢反应,画出由反应原料经两步生成产物的反应过程能量示意图

(3)一定条件下,在体积为1L的密闭容器中发生反应Ⅰ,起始物n(H2)/n(CO2)=3,CO2(g)和CH3OH(g)的浓度随时间变化如图1所示,3min内用H2浓度变化表示的反应速率

(4)反应Ⅱ中,为提高H2的转化率,可采取的措施有
(5)图2是以甲醇燃料电池为电源电解饱和食盐水,甲装置a电极反应式为

更新时间:2024-03-03 14:34:44
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的 一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将 转化为
转化为 ,再氧化为
,再氧化为
已知:a.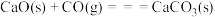
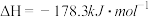
b.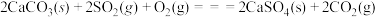
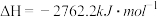
c.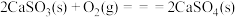
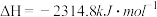
写出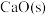 与
与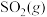 反应生成
反应生成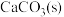 的热化学方程式:
的热化学方程式:________________________________ 。
②方法2:用氨水将 转化为
转化为 ,再氧化
,再氧化 。
。
实验测得 溶液中
溶液中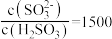 ,则溶液的pH为
,则溶液的pH为________ (已知: 的
的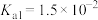 ,
, )。
)。
(2)煤制得的化工原料气中含有羰基硫(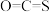 ),该物质可转化为
),该物质可转化为 ,反应为
,反应为
 。
。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是________ (填字母)。
a. COS的浓度保持不变 b.化学平衡常数不改变
c.混合气体的密度不再改变 d.形成2 ml H-S键的同时成1 mol H-H键
② 时,在恒容的密容器中,将定量的CO和
时,在恒容的密容器中,将定量的CO和 混合加热并达到下列平衡:
混合加热并达到下列平衡: ,
,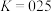 ,则该温度下反应
,则该温度下反应 的平衡常数
的平衡常数
________ 。
 时,向容积为10 L的恒容密闭容器中充入1 mol COS(g)和
时,向容积为10 L的恒容密闭容器中充入1 mol COS(g)和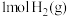 ,达到平衡时COS的转化率为
,达到平衡时COS的转化率为________ 。
(3)过二硫酸( )是一种强氧化性酸,其结构式为
)是一种强氧化性酸,其结构式为
①在 催化作用下,
催化作用下, 能与
能与 在水溶液中发生反应生成
在水溶液中发生反应生成 和
和 ,
,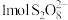 能氧化的
能氧化的 的物质的量为
的物质的量为________ mol。
②工业上可用情性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为________________ 。
(1)工业尾气中的
 一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:①方法1:燃煤中加入生石灰,将
 转化为
转化为 ,再氧化为
,再氧化为
已知:a.
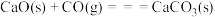
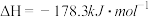
b.
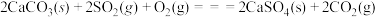
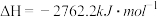
c.
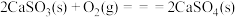
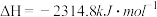
写出
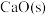 与
与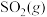 反应生成
反应生成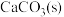 的热化学方程式:
的热化学方程式:②方法2:用氨水将
 转化为
转化为 ,再氧化
,再氧化 。
。实验测得
 溶液中
溶液中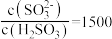 ,则溶液的pH为
,则溶液的pH为 的
的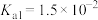 ,
, )。
)。(2)煤制得的化工原料气中含有羰基硫(
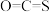 ),该物质可转化为
),该物质可转化为 ,反应为
,反应为
 。
。①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是
a. COS的浓度保持不变 b.化学平衡常数不改变
c.混合气体的密度不再改变 d.形成2 ml H-S键的同时成1 mol H-H键
②
 时,在恒容的密容器中,将定量的CO和
时,在恒容的密容器中,将定量的CO和 混合加热并达到下列平衡:
混合加热并达到下列平衡: ,
,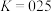 ,则该温度下反应
,则该温度下反应 的平衡常数
的平衡常数
 时,向容积为10 L的恒容密闭容器中充入1 mol COS(g)和
时,向容积为10 L的恒容密闭容器中充入1 mol COS(g)和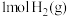 ,达到平衡时COS的转化率为
,达到平衡时COS的转化率为(3)过二硫酸(
 )是一种强氧化性酸,其结构式为
)是一种强氧化性酸,其结构式为
①在
 催化作用下,
催化作用下, 能与
能与 在水溶液中发生反应生成
在水溶液中发生反应生成 和
和 ,
,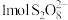 能氧化的
能氧化的 的物质的量为
的物质的量为②工业上可用情性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为
您最近一年使用:0次
【推荐2】甲醇是一种可再生能源,由 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:
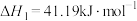
反应Ⅱ:
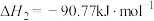
回答下列问题:
(1)写出反应Ⅲ二氧化碳和氢气制备甲醇气体和气态水的热化学反应方程式_________ ,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K3=_________ (用K1、K2表示)。
(2)反应Ⅲ自发进行条件是_________ 。
A.较低温度 B.较高温度 C.任何温度
(3)在一定条件下2 L恒容密闭容器中充入 和
和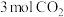 ,仅发生反应Ⅲ,实验测得不同反应温度与体系中
,仅发生反应Ⅲ,实验测得不同反应温度与体系中 的平衡转化率的关系,如下表所示。
的平衡转化率的关系,如下表所示。
①T_________ 500℃(填“>”“<”“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率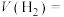
_________ ;该温度下,反应Ⅲ的平衡常数K=_________ 。
(4)由 制备甲醇还需要氢气。工业上用电解法制取
制备甲醇还需要氢气。工业上用电解法制取 ,同时获得氢气:
,同时获得氢气: ,工作原理如图所示。电解一段时间后,
,工作原理如图所示。电解一段时间后,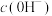 降低的区域在
降低的区域在_________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为_________ 。
 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:反应Ⅰ:

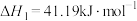
反应Ⅱ:

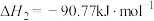
回答下列问题:
(1)写出反应Ⅲ二氧化碳和氢气制备甲醇气体和气态水的热化学反应方程式
(2)反应Ⅲ自发进行条件是
A.较低温度 B.较高温度 C.任何温度
(3)在一定条件下2 L恒容密闭容器中充入
 和
和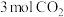 ,仅发生反应Ⅲ,实验测得不同反应温度与体系中
,仅发生反应Ⅲ,实验测得不同反应温度与体系中 的平衡转化率的关系,如下表所示。
的平衡转化率的关系,如下表所示。| 温度(℃) | 500 | T |
 的平衡转化率 的平衡转化率 | 60% | 40% |
①T
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率
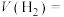
(4)由
 制备甲醇还需要氢气。工业上用电解法制取
制备甲醇还需要氢气。工业上用电解法制取 ,同时获得氢气:
,同时获得氢气: ,工作原理如图所示。电解一段时间后,
,工作原理如图所示。电解一段时间后,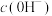 降低的区域在
降低的区域在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氟气化学性质十分活泼,具有很强的氧化性,工业上氟气常用作火箭燃料的氧化剂、卤化氟的原料、冷冻剂等。回答下列问题:
(1)已知2F2+Na2SO4=2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有______ (填字母标号)。
a.SO2F2既是氧化产物又是还原产物
b.生成42 g NaF时则该反应转移1 mol电子
c.F2的氧化性强于O2
d.既有极性键、非极性键的断裂,又有极性键、非极性键的形成
(2)下图是发射卫星时用肼(N2H4)作燃料,用NO2作氧化剂,两者反应生成N2、水蒸气和用F2作氧化剂,两者反应生成N2、HF的反应原理。

通过计算,可知原理(I)和原理(II)氧化气态肼生成氮气的热化学方程式分别为______ 、______ ,消耗等量的N2H4时释放能量较多的是_______ (填“原理(I)”或“原理(II)”)。
(3)在绝热的某刚性容器中置入1 mol F2和3 mol ClF3,发生反应:F2(g)+ClF(g) ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有
ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有_______ (填字母标号)。
a.F2(g)与ClF(g)体积之比恒定不变 b.F2(g)与ClF3(g)速率之比恒定不变
c.容器中温度恒定不变 d.混合物中Cl元素质量分数恒定不变
(4)在K℃下,分别将0.20 mol F2、0.40 mol ClF充入2 L和1 L的2个刚性容器中,发生反应:F2(g)+ClF(g) ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
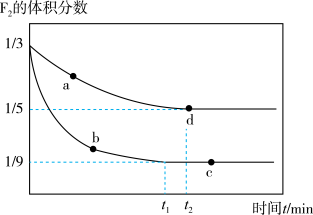
①针对F2,若仅从浓度而言,则va(逆)、vb(正)、vc(正)、vd(逆)大小顺序为_________ 。
②反应进行到d点时,反应速率v(F2)=______ mol/(L·min)。
③c点处,F2的平衡转化率α=_______ %,d点处,平衡常数Kc=________ 。
④若升高温度,在2 L的容器中,平衡后ClF的体积分数为0.8,该反应的△H_____ 0(填“>”“ <”或“=”),F2的平衡转化率α_______ (填“增大”“减小”或“不变”)。
(1)已知2F2+Na2SO4=2NaF+SO2F2+O2,针对该反应的下列有关说法正确的有
a.SO2F2既是氧化产物又是还原产物
b.生成42 g NaF时则该反应转移1 mol电子
c.F2的氧化性强于O2
d.既有极性键、非极性键的断裂,又有极性键、非极性键的形成
(2)下图是发射卫星时用肼(N2H4)作燃料,用NO2作氧化剂,两者反应生成N2、水蒸气和用F2作氧化剂,两者反应生成N2、HF的反应原理。

通过计算,可知原理(I)和原理(II)氧化气态肼生成氮气的热化学方程式分别为
(3)在绝热的某刚性容器中置入1 mol F2和3 mol ClF3,发生反应:F2(g)+ClF(g)
 ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有
ClF3(g) △H。下列说法中能够判断该反应一定处于平衡状态的有a.F2(g)与ClF(g)体积之比恒定不变 b.F2(g)与ClF3(g)速率之比恒定不变
c.容器中温度恒定不变 d.混合物中Cl元素质量分数恒定不变
(4)在K℃下,分别将0.20 mol F2、0.40 mol ClF充入2 L和1 L的2个刚性容器中,发生反应:F2(g)+ClF(g)
 ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
ClF3(g) △H。实验测得F2的体积分数随时间变化如图所示:
①针对F2,若仅从浓度而言,则va(逆)、vb(正)、vc(正)、vd(逆)大小顺序为
②反应进行到d点时,反应速率v(F2)=
③c点处,F2的平衡转化率α=
④若升高温度,在2 L的容器中,平衡后ClF的体积分数为0.8,该反应的△H
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(在刚性容器中进行):2H2(g)+CO(g) СН3ОН(g)。
СН3ОН(g)。
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的焓变△H_______ (填“<”“>”或“=”)0,要使该反应自发进行,反应温度不宜_______ (填“过高”或“过低”)。
②要提高CO的转化率,可以采取的措施是_______ (填字母代号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.恒容加入惰性气体 f.分离出甲醇
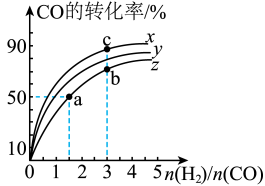
(2)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图所示是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是_______ ℃;该温度下上述反应的化学平衡常数为_______ 。曲线上a、b、c三点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为_______ 。
 СН3ОН(g)。
СН3ОН(g)。(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2 e.恒容加入惰性气体 f.分离出甲醇
(2)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图所示是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
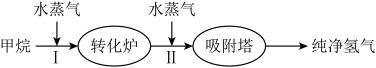
【推荐2】广东某石化厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图水蒸气水蒸气。
(1)此流程的第Ⅰ步反应为CH4(g)+H2O(g) 3H2(g)+CO(g) △H=+206.4kJ•mol-1,
3H2(g)+CO(g) △H=+206.4kJ•mol-1,
①已知断开1mol相关化学键所需键能如表:
则a=________ 。
②一定条件下CH4的平衡转化率与温度、压强的关系如图所示,则p1_______ p2(填“<”“>”“=”)。

(2)此流程的第Ⅱ步反应为:CO(g)+H2O(g)=H2(g)+CO2(g),该反应的化学平衡常数表达式为K=_______ ;反应的平衡常数随温度的变化如表所示:
从表可以推断:此反应是_______ (填“吸热”“放热”)反应。
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)=H2(g)+CO2(g),在1000℃时,某时刻反应混合物中CO、H2O、H2、CO2的物质量浓度分别为2mol/L、2mol/L、1mol/L、1mol/L,则此时反应朝________ (填“正反应方向”或“逆反应方向”)进行。
(4)在一个不绝热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是________ (填序号)
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
⑥v正(CO2)=v逆(H2O)
(5)化学反应过快或过慢都会影响我们的生产生活,请你写出一种生活中减慢化学反应速率的方法_______ 。

(1)此流程的第Ⅰ步反应为CH4(g)+H2O(g)
 3H2(g)+CO(g) △H=+206.4kJ•mol-1,
3H2(g)+CO(g) △H=+206.4kJ•mol-1,①已知断开1mol相关化学键所需键能如表:
| 化学键 | H-H | O-H | C-H | C=O |
| 键能(kJ/mol) | 436 | 465 | a | 1076 |
②一定条件下CH4的平衡转化率与温度、压强的关系如图所示,则p1

(2)此流程的第Ⅱ步反应为:CO(g)+H2O(g)=H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数/K | 10 | 9 | 1 | 0.6 |
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)=H2(g)+CO2(g),在1000℃时,某时刻反应混合物中CO、H2O、H2、CO2的物质量浓度分别为2mol/L、2mol/L、1mol/L、1mol/L,则此时反应朝
(4)在一个不绝热的固定容积的容器中,判断此流程的第Ⅱ步反应达到平衡的标志是
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
⑥v正(CO2)=v逆(H2O)
(5)化学反应过快或过慢都会影响我们的生产生活,请你写出一种生活中减慢化学反应速率的方法
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】研究 、
、 等大气污染物的处理具有重要意义。
等大气污染物的处理具有重要意义。
(1)某温度下,已知:
①
②
③
则
________ 。
(2)按投料比2∶1把 和
和 加入到一密闭容器中发生反应
加入到一密闭容器中发生反应 ,测得平衡时
,测得平衡时 的转化率的温度T、压强p的关系如图甲所示:
的转化率的温度T、压强p的关系如图甲所示:
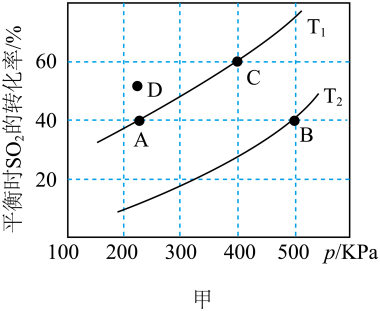
A、B两点对应的平衡常数大小关系为KA_______ KB(填“>”“<”或“=”,下同);温度为 时D点
时D点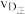 与
与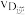 的大小关系为
的大小关系为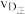
________ 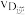 ;
;
(3)恒温恒容下,对于反应 ,测得平衡时
,测得平衡时 的体积分数与起始
的体积分数与起始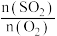 的关系如图乙所示,则当
的关系如图乙所示,则当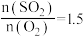 达到平衡状态时,
达到平衡状态时,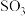 的体积分数是图乙中D、E、F三点中的
的体积分数是图乙中D、E、F三点中的_______ 点。A、B两点 转化率的大小关系为
转化率的大小关系为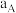
_______ (填“>”“<”或“=”) 。
。

(4)工业上脱硫脱硝还可采用电化学法,其中的一种方法是内电池模式(直接法),烟气中的组分直接在电池液中被吸收及在电极反应中被转化,采用内电池模式将 吸收在电池液中,并在电极反应中氧化为硫酸,在此反应过程中可得到质量分数为40%的硫酸。写出通入
吸收在电池液中,并在电极反应中氧化为硫酸,在此反应过程中可得到质量分数为40%的硫酸。写出通入 电极的反应式:
电极的反应式:_________ ;若40%的硫酸溶液吸收氨气获得 的稀溶液,测得常温下,该溶液的
的稀溶液,测得常温下,该溶液的 ,则
,则
________ (列出计算式已知该温度下 的
的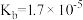 );若将该溶液蒸发掉一部分水后恢复室温,则
);若将该溶液蒸发掉一部分水后恢复室温,则 的值将
的值将_________ (填“变大”“不变”或“变小”)。
 、
、 等大气污染物的处理具有重要意义。
等大气污染物的处理具有重要意义。(1)某温度下,已知:
①
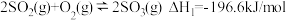
②

③

则

(2)按投料比2∶1把
 和
和 加入到一密闭容器中发生反应
加入到一密闭容器中发生反应 ,测得平衡时
,测得平衡时 的转化率的温度T、压强p的关系如图甲所示:
的转化率的温度T、压强p的关系如图甲所示:
A、B两点对应的平衡常数大小关系为KA
 时D点
时D点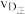 与
与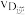 的大小关系为
的大小关系为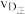
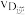 ;
;(3)恒温恒容下,对于反应
 ,测得平衡时
,测得平衡时 的体积分数与起始
的体积分数与起始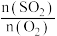 的关系如图乙所示,则当
的关系如图乙所示,则当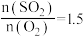 达到平衡状态时,
达到平衡状态时,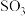 的体积分数是图乙中D、E、F三点中的
的体积分数是图乙中D、E、F三点中的 转化率的大小关系为
转化率的大小关系为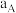
 。
。
(4)工业上脱硫脱硝还可采用电化学法,其中的一种方法是内电池模式(直接法),烟气中的组分直接在电池液中被吸收及在电极反应中被转化,采用内电池模式将
 吸收在电池液中,并在电极反应中氧化为硫酸,在此反应过程中可得到质量分数为40%的硫酸。写出通入
吸收在电池液中,并在电极反应中氧化为硫酸,在此反应过程中可得到质量分数为40%的硫酸。写出通入 电极的反应式:
电极的反应式: 的稀溶液,测得常温下,该溶液的
的稀溶液,测得常温下,该溶液的 ,则
,则
 的
的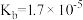 );若将该溶液蒸发掉一部分水后恢复室温,则
);若将该溶液蒸发掉一部分水后恢复室温,则 的值将
的值将
您最近一年使用:0次
【推荐1】有效除去大气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。
(1)用NaOH溶液吸收热电企业产生的废气时,涉及如下转化:由下图关系可得:△H4=________ 。

(2)某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g) N2O4(g)(快反应) △H<0,体系的总压强p总和pO2随时间的变化如下图所示:
N2O4(g)(快反应) △H<0,体系的总压强p总和pO2随时间的变化如下图所示:
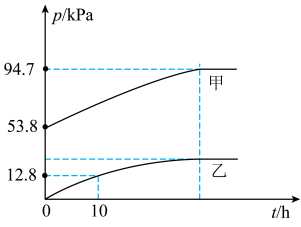
①上图中表示O2压强变化的曲线是______________________ (填“甲”或“乙”)。
②已知N2O5 分解的反应速率v=0.12pN2O5(kPa•h-1),t=10h时,pN2O5=_________ kPa,v=_________ kPa•h-1(结果保留两位小数,下同)。
③该温度下2NO2 N2O4 反应的平衡常数Kp=
N2O4 反应的平衡常数Kp=__________________ kPa-1(Kp为以分压表示的平衡常数)。
(3)亚硝酸盐广泛存在于各种水体和腌制品中,可用电吸附装置去除。去除量跟电压、初始浓度、共存阴离子等因素有关。某科研机构的实验结果如下图所示:
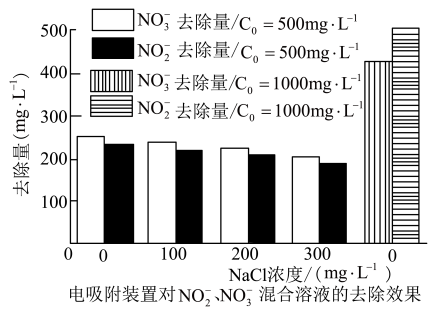
①据上图可知,待处理液中NO2–与NO3-的C0=__________ mg•L-1时,装置对NO3-的吸附量高于NO2-。
②据上图分析,为提高离子去除量可采取的措施有___________________________________ (写出一条即可)。
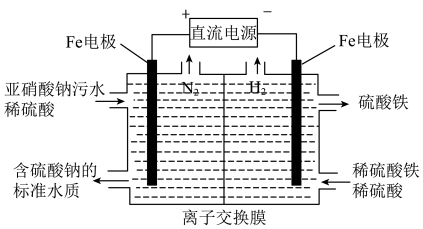
(4)电解法也可以对亚硝酸盐污水进行处理(工作原理如下图所示)。通电后,左极区产生浅绿色溶液,随后生成无色气体。当Fe电极消耗11.2g时,理论上可处理 NaNO2含量为4.6%的污水______________ g。
(1)用NaOH溶液吸收热电企业产生的废气时,涉及如下转化:由下图关系可得:△H4=

(2)某温度下,N2O5 气体在一体积固定的容器中发生如下反应:2N2O5(g) = 4NO2(g)+O2(g)(慢反应) △H<0,2NO2(g)
 N2O4(g)(快反应) △H<0,体系的总压强p总和pO2随时间的变化如下图所示:
N2O4(g)(快反应) △H<0,体系的总压强p总和pO2随时间的变化如下图所示:
①上图中表示O2压强变化的曲线是
②已知N2O5 分解的反应速率v=0.12pN2O5(kPa•h-1),t=10h时,pN2O5=
③该温度下2NO2
 N2O4 反应的平衡常数Kp=
N2O4 反应的平衡常数Kp=(3)亚硝酸盐广泛存在于各种水体和腌制品中,可用电吸附装置去除。去除量跟电压、初始浓度、共存阴离子等因素有关。某科研机构的实验结果如下图所示:

①据上图可知,待处理液中NO2–与NO3-的C0=
②据上图分析,为提高离子去除量可采取的措施有
(4)电解法也可以对亚硝酸盐污水进行处理(工作原理如下图所示)。通电后,左极区产生浅绿色溶液,随后生成无色气体。当Fe电极消耗11.2g时,理论上可处理 NaNO2含量为4.6%的污水

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
(1)反应 A 的平衡常数表达式是_____ 。在恒温恒容的密闭容器中进行该反应,下列说法正确的是_____ (填字母)。
A.反应达到平衡时,容器的总压强不再改变
B.加入合适的催化剂,可以提高 CO2的转化率
C.将初始投料增加 1 倍,可以提高CO2的转化率
D.充入一定量的He 气,可以提高CO2的转化率
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。
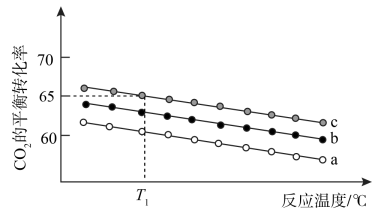
① 反应 A 的ΔH1_____ 0(填“>”或“<”)。
② 曲线 c 对应的投料是_____ 。
③ T1℃时,曲线c 对应的化学平衡常数_____ 1(填“大于”、“小于”或“等于”)。
(3)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。
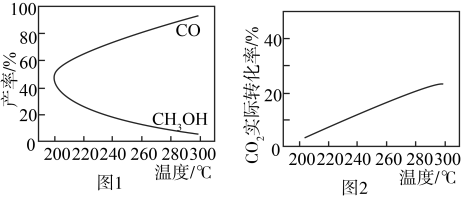
由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_____ 。
(4)以 CO2和 H2O 为原料合成 CH4,可以借助氮化镓(GaN)与 Cu 组成的人工光合系统, 装置如图所示。
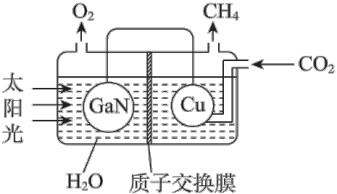
① GaN 电极上的电极反应式是_____ 。
② 当有 0.4mol 电子转移时,铜电极上生成的CH4在标准状况下的体积是_____ L。
(1)反应 A 的平衡常数表达式是
A.反应达到平衡时,容器的总压强不再改变
B.加入合适的催化剂,可以提高 CO2的转化率
C.将初始投料增加 1 倍,可以提高CO2的转化率
D.充入一定量的He 气,可以提高CO2的转化率
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。

① 反应 A 的ΔH1
② 曲线 c 对应的投料是
③ T1℃时,曲线c 对应的化学平衡常数
(3)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。

由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是
(4)以 CO2和 H2O 为原料合成 CH4,可以借助氮化镓(GaN)与 Cu 组成的人工光合系统, 装置如图所示。

① GaN 电极上的电极反应式是
② 当有 0.4mol 电子转移时,铜电极上生成的CH4在标准状况下的体积是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。
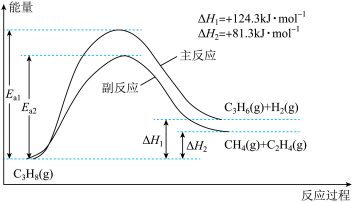
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)____ (填“增大”、“减小”或“不变”,下同),转化率α(C3H8)_____ 。
②温度升高,副反应更容易发生的主要原因是__________________________________ 。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104 Pa和105 Pa)。
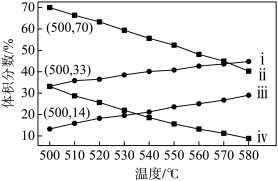
①104 Pa时,图中表示丙烯的曲线是____ (填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____ (已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
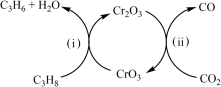
已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
298 K 时,该工艺总反应的热化学方程式为_____________________________________ 。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)
②温度升高,副反应更容易发生的主要原因是
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104 Pa和105 Pa)。

①104 Pa时,图中表示丙烯的曲线是
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
298 K 时,该工艺总反应的热化学方程式为
您最近一年使用:0次
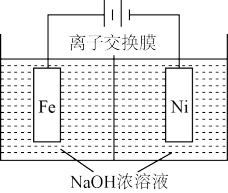
【推荐1】研究金属的腐蚀过程及防腐蚀对人们的日常生活有重大意义。某化学社团欲进行以下研究,回答相关问题:
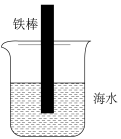
(1)利用下图研究氧气的浓度对铁腐蚀速率的影响。插入海水中的铁棒(含碳量为10.8%)越靠近下端腐蚀就越___________ (填“轻微”、“严重”)。
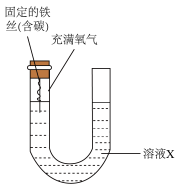
(2)利用下图研究电解质的酸碱性对铁腐蚀速率的影响。起始时两管内液面相平,均在恒温条件下研究。若溶液X是1mol/L的盐酸,一段时间后发现U形管内液面左低右高,则铁丝的腐蚀过程属于___________ (填“吸氧腐蚀”或“析氢腐蚀”)。
(3)利用下图装置研究铁的防腐过程:
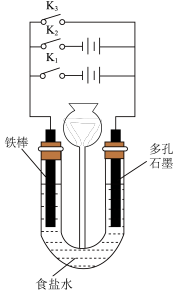
①能最大程度地减缓铁棒腐蚀的方案是闭合___________ (填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
②若闭合 ,石墨电极附近的pH将
,石墨电极附近的pH将___________ (填“变大”、“变小”或“不变”)。
(1)利用下图研究氧气的浓度对铁腐蚀速率的影响。插入海水中的铁棒(含碳量为10.8%)越靠近下端腐蚀就越

(2)利用下图研究电解质的酸碱性对铁腐蚀速率的影响。起始时两管内液面相平,均在恒温条件下研究。若溶液X是1mol/L的盐酸,一段时间后发现U形管内液面左低右高,则铁丝的腐蚀过程属于

(3)利用下图装置研究铁的防腐过程:

①能最大程度地减缓铁棒腐蚀的方案是闭合
 ”、“
”、“ ”或“
”或“ ”)。
”)。②若闭合
 ,石墨电极附近的pH将
,石墨电极附近的pH将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
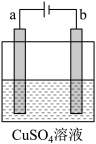
【推荐2】某课外活动小组用如图所示装置进行实验,试回答下列问题:
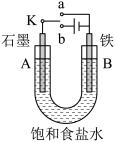
(1)若开始时开关K与a连接,则B极的电极反应式为_______ 。
(2)若开始时开关K与b极连接,此装置为______ (原电池或电解池)总反应的离子方程式为_______ 。
(3)如图所示用惰性电极电解100 mL 0.5 mol·L 硫酸铜溶液,a电极上的电极反应式为
硫酸铜溶液,a电极上的电极反应式为_______ ,若a电极产生56 mL(标准状况)气体,则所得溶液的
_______ (不考虑溶液体积变化)。

(1)若开始时开关K与a连接,则B极的电极反应式为
(2)若开始时开关K与b极连接,此装置为
(3)如图所示用惰性电极电解100 mL 0.5 mol·L
 硫酸铜溶液,a电极上的电极反应式为
硫酸铜溶液,a电极上的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】I、某研究性学习小组为探究Fe3+与Ag反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。

(1)K闭合时,指针向左偏转,石墨作________ (填“正极”或“负极”);石墨电极上的电极反应方程式为___________ 。
(2)一段时间后指针归零,向左侧U形管中滴加几滴FeCl2浓溶液,发现指针向右偏转,写出此时银电极的反应式:_________________ 。
(3)结合上述实验分析,写出Fe3+和Ag反应的离子方程式______________ 。
II、某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
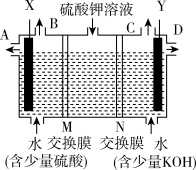
(1)X极与电源的_____ (填正或负)极相连,氢气从____ (选填A、 B、C或D)口导出。
(2)离子交换膜只允许一类离子通过,则M为________ (填阴离子或阳离子)交换膜。
(3)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为______________ 。

(1)K闭合时,指针向左偏转,石墨作
(2)一段时间后指针归零,向左侧U形管中滴加几滴FeCl2浓溶液,发现指针向右偏转,写出此时银电极的反应式:
(3)结合上述实验分析,写出Fe3+和Ag反应的离子方程式
II、某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。

(1)X极与电源的
(2)离子交换膜只允许一类离子通过,则M为
(3)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为
您最近一年使用:0次



