解题方法
1 . Ⅰ. 全钒液流电池 是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为
是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为 放电工作原理。
放电工作原理。
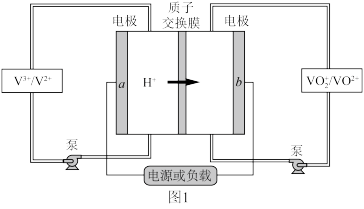
(1)电极 为
为___________ 极(填“正”或“负”),充电时, 电极的反应为
电极的反应为___________ 。
(2)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
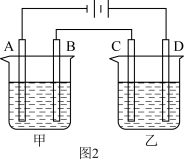
①甲槽是电极电解饱和食盐水的装置,产生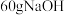 时,
时,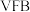 电池中消耗
电池中消耗___________ 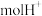 。
。
②乙槽为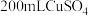 溶液,当C电极析出
溶液,当C电极析出 物质时,则乙槽中生成的
物质时,则乙槽中生成的 的物质的量浓度为
的物质的量浓度为___________  。
。
③若通电一段时间后,向所得的乙槽溶液中加入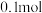 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为___________ (用 表示)。
表示)。
Ⅱ. 实验:市售补铁食盐中铁含量测定。
已知:①补铁食盐中还含有 ,其中
,其中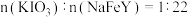 (其中
(其中 显
显 价);
价);
② 。
。
实验步骤:称取 样品,加稀硫酸溶解后配成
样品,加稀硫酸溶解后配成 溶液。取出
溶液。取出 ,加入稍过量的
,加入稍过量的 溶液,充分反应后,滴入淀粉溶液,用
溶液,充分反应后,滴入淀粉溶液,用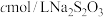 标准液滴定,重复操作
标准液滴定,重复操作 次,消耗
次,消耗 标准液平均值为
标准液平均值为 。
。
(3)滴定终点的现象为___________ 。
(4)样品中铁元素的质量分数为___________ 。
 是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为
是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图1为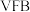 放电工作原理。
放电工作原理。
(1)电极
 为
为 电极的反应为
电极的反应为(2)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生
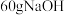 时,
时,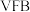 电池中消耗
电池中消耗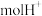 。
。②乙槽为
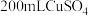 溶液,当C电极析出
溶液,当C电极析出 物质时,则乙槽中生成的
物质时,则乙槽中生成的 的物质的量浓度为
的物质的量浓度为 。
。③若通电一段时间后,向所得的乙槽溶液中加入
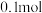 的
的 才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为
才能恰好恢复到电解前的浓度,则电解过程中转移的电子数目为 表示)。
表示)。Ⅱ. 实验:市售补铁食盐中铁含量测定。
已知:①补铁食盐中还含有
 ,其中
,其中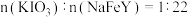 (其中
(其中 显
显 价);
价);②
 。
。实验步骤:称取
 样品,加稀硫酸溶解后配成
样品,加稀硫酸溶解后配成 溶液。取出
溶液。取出 ,加入稍过量的
,加入稍过量的 溶液,充分反应后,滴入淀粉溶液,用
溶液,充分反应后,滴入淀粉溶液,用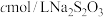 标准液滴定,重复操作
标准液滴定,重复操作 次,消耗
次,消耗 标准液平均值为
标准液平均值为 。
。(3)滴定终点的现象为
(4)样品中铁元素的质量分数为
您最近一年使用:0次
解题方法
2 . 氯碱工业是高能耗产业,节能技术的研发是当前的重要课题。
(1)一种节能技术是将电解池与燃料电池相组合,相关物料传输与转化关系如下图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。
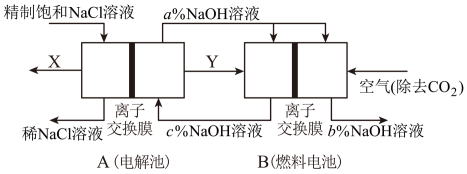
①当产生0.5molX时,A中通过离子交换膜的Na+有___________ mol。
②写出燃料电池B中负极上的电极反应式___________ 。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序___________ 。
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应式为___________ 。
(1)一种节能技术是将电解池与燃料电池相组合,相关物料传输与转化关系如下图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。

①当产生0.5molX时,A中通过离子交换膜的Na+有
②写出燃料电池B中负极上的电极反应式
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应式为
您最近一年使用:0次
2022-01-16更新
|
256次组卷
|
2卷引用:浙江省嘉兴市2021-2022学年高二上学期期末检测化学试题
解题方法
3 . 某兴趣小组设计的以甲烷为燃料的电池的工作原理示意图如图所示(两个电极上分别通入 和
和 )。
)。
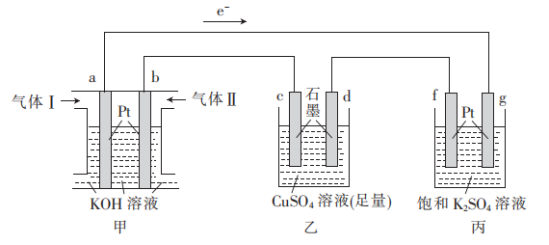
回答下列问题:
(1)电极b为燃料电池的__________ (填“正极”或“负极”),气体Ⅱ为__________ (填“ ”或“
”或“ ”),电极a上的电极反应式为
”),电极a上的电极反应式为________________________________________ 。
(2)电极d上的现象为________________________________________ ,电池工作一段时间后,乙中加入适量的__________ (填化学式,填一种即可),可使其恢复至与原溶液相同的状态。
(3)若丙中盛装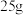 质量分数为
质量分数为 的
的 溶液,当外电路中转移的电子为
溶液,当外电路中转移的电子为 时,气体体积均换算成标准状况下,整个过程中无晶体析出。
时,气体体积均换算成标准状况下,整个过程中无晶体析出。
①丙中电极 上生成气体的体积为
上生成气体的体积为__________ L。
②丙中 溶液的质量分数变为
溶液的质量分数变为___________ %。
 和
和 )。
)。
回答下列问题:
(1)电极b为燃料电池的
 ”或“
”或“ ”),电极a上的电极反应式为
”),电极a上的电极反应式为(2)电极d上的现象为
(3)若丙中盛装
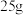 质量分数为
质量分数为 的
的 溶液,当外电路中转移的电子为
溶液,当外电路中转移的电子为 时,气体体积均换算成标准状况下,整个过程中无晶体析出。
时,气体体积均换算成标准状况下,整个过程中无晶体析出。①丙中电极
 上生成气体的体积为
上生成气体的体积为②丙中
 溶液的质量分数变为
溶液的质量分数变为
您最近一年使用:0次
2022-01-23更新
|
163次组卷
|
2卷引用:安徽省淮北市名校联盟2021-2022学年高二上学期期末联考化学试题
名校
解题方法
4 . Ⅰ.新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 和
和 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:

(1)甲烷燃料电池正负极的电极反应分别为_______ ,_______ 。
(2)闭合K开关后,a、b电极上均有气体产生。其中b电极上得到的是_______ ,电极a的电极反应方程式为_______ ;
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上最多能产生的氯气体积为_______ L(标准状况),通过电解池的电量为_______ (法拉第常数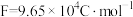 列式计算)。
列式计算)。
Ⅱ.如图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。

(4)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是_______ ,D电极上的电极反应式为_______ 。
(5)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时C电极上的电极反应式为_______ ,整套实验装置的总的离子方程式为_______ 。
 和
和 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题:
(1)甲烷燃料电池正负极的电极反应分别为
(2)闭合K开关后,a、b电极上均有气体产生。其中b电极上得到的是
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上最多能产生的氯气体积为
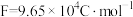 列式计算)。
列式计算)。Ⅱ.如图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源正极。

(4)向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是
(5)一段时间后,再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时C电极上的电极反应式为
您最近一年使用:0次
解题方法
5 . 氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上,并同时制得 和
和 溶液。相关物料的传输与转化关系如图所示:
溶液。相关物料的传输与转化关系如图所示:
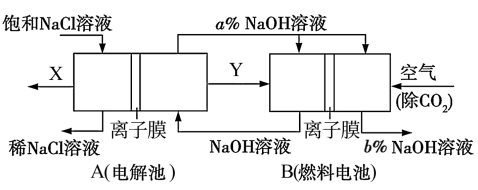
请回答下列问题:
(1)A池总反应的离子反应方程式为___________ 。燃料电池B中正极上发生的电极反应式为___________ 。
(2)装置中的离子膜是阳离子交换膜,当阴极产生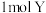 时,通过离子交换膜的
时,通过离子交换膜的 有
有___________  。
。
(3)装置图中氢氧化钠溶液质量分数的大小:
___________ 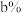 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
 和
和 溶液。相关物料的传输与转化关系如图所示:
溶液。相关物料的传输与转化关系如图所示:
请回答下列问题:
(1)A池总反应的离子反应方程式为
(2)装置中的离子膜是阳离子交换膜,当阴极产生
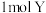 时,通过离子交换膜的
时,通过离子交换膜的 有
有 。
。(3)装置图中氢氧化钠溶液质量分数的大小:

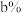 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
您最近一年使用:0次
6 . 2020年9月中国明确提出“双碳”目标。因此,研发 资源化利用技术、降低空气中
资源化利用技术、降低空气中 含量成为科学家的研究热点。图1为我国科学家利用
含量成为科学家的研究热点。图1为我国科学家利用 和金属
和金属 成功发明的
成功发明的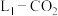 电池的工作示意图。通入
电池的工作示意图。通入 一极的反应产物为
一极的反应产物为 和单质碳;图2为采用“两室”膜电解法将
和单质碳;图2为采用“两室”膜电解法将 转化为
转化为 的示意图。请回答下列问题:
的示意图。请回答下列问题: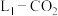 电池中:
电池中:
(1) Li为______ (填“正”或“负”)极,正极的电极反应为____________ 。
(2)研究表明, 电还原后与
电还原后与 结合形成
结合形成 的反应历程如下,反应II的离子方程式为
的反应历程如下,反应II的离子方程式为____________
I.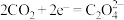
II._________________
III.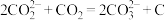
IV.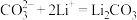
II、利用 电池作为图2装置的中源。
电池作为图2装置的中源。
(3) 片连接
片连接 电池的
电池的_______ (填“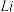 ”或“
”或“ ”)电极,电解过程中,
”)电极,电解过程中,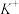 通过阳离子交换膜由
通过阳离子交换膜由_______ (填“左室移向右室”或“右室移向左室”),阴极发生的电极反应为_______ 。
(4)电解一段时间后, 电池中生成
电池中生成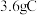 时,图2中阳极区产生气体的体积(标准状况)为
时,图2中阳极区产生气体的体积(标准状况)为_______ L。
 资源化利用技术、降低空气中
资源化利用技术、降低空气中 含量成为科学家的研究热点。图1为我国科学家利用
含量成为科学家的研究热点。图1为我国科学家利用 和金属
和金属 成功发明的
成功发明的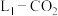 电池的工作示意图。通入
电池的工作示意图。通入 一极的反应产物为
一极的反应产物为 和单质碳;图2为采用“两室”膜电解法将
和单质碳;图2为采用“两室”膜电解法将 转化为
转化为 的示意图。请回答下列问题:
的示意图。请回答下列问题: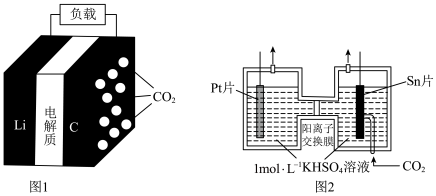
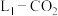 电池中:
电池中:(1) Li为
(2)研究表明,
 电还原后与
电还原后与 结合形成
结合形成 的反应历程如下,反应II的离子方程式为
的反应历程如下,反应II的离子方程式为I.
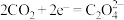
II._________________
III.
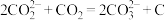
IV.
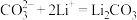
II、利用
 电池作为图2装置的中源。
电池作为图2装置的中源。(3)
 片连接
片连接 电池的
电池的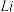 ”或“
”或“ ”)电极,电解过程中,
”)电极,电解过程中,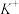 通过阳离子交换膜由
通过阳离子交换膜由(4)电解一段时间后,
 电池中生成
电池中生成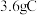 时,图2中阳极区产生气体的体积(标准状况)为
时,图2中阳极区产生气体的体积(标准状况)为
您最近一年使用:0次
解题方法
7 . 我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。因此,研发 利用技术,降低空气中
利用技术,降低空气中 含量成为研究热点。
含量成为研究热点。
(1)科学家发明了一种新型 水介电池。电池示意图如图所示,电极为金属锌和选择性催化材料。放电时,
水介电池。电池示意图如图所示,电极为金属锌和选择性催化材料。放电时, 被转化为储氢物质甲酸等。
被转化为储氢物质甲酸等。
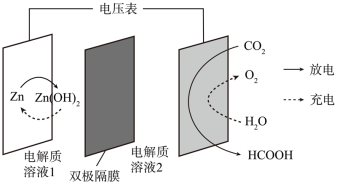
①放电时,Zn电极上发生___________ (填“氧化”或“还原”)反应。
②充电时,阳极上发生的电极反应为___________ 。
(2)研究证实,在酸性水溶液中可以通过电解 生成甲醇,生成甲醇的电极反应式为
生成甲醇,生成甲醇的电极反应式为___________ ,电路中每转移0.3mol电子,消耗 的体积为
的体积为___________ L(已换算成标准状况)。
(3) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。

①M为电源的___________ (填“正极”或“负极”)。
②若生成的乙烯和乙烷的物质的量分别为3mol、2mol,则装置中转移的电子数为___________ 。
 利用技术,降低空气中
利用技术,降低空气中 含量成为研究热点。
含量成为研究热点。(1)科学家发明了一种新型
 水介电池。电池示意图如图所示,电极为金属锌和选择性催化材料。放电时,
水介电池。电池示意图如图所示,电极为金属锌和选择性催化材料。放电时, 被转化为储氢物质甲酸等。
被转化为储氢物质甲酸等。
①放电时,Zn电极上发生
②充电时,阳极上发生的电极反应为
(2)研究证实,在酸性水溶液中可以通过电解
 生成甲醇,生成甲醇的电极反应式为
生成甲醇,生成甲醇的电极反应式为 的体积为
的体积为(3)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示。
①M为电源的
②若生成的乙烯和乙烷的物质的量分别为3mol、2mol,则装置中转移的电子数为
您最近一年使用:0次
名校
解题方法
8 . 降低能耗是氯碱工业发展的重要方向。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
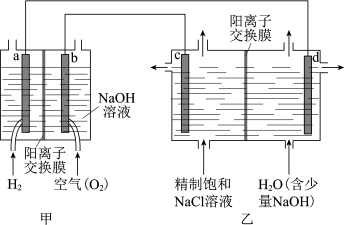
①a极为_______ (填“正”或“负”)极。
②乙装置中电解饱和NaCl溶液的化学方程式为。_______ 。
③下列说法正确的是_______ 。
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为_______ 。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是_______ 。
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为_______ 。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。

①a极为
②乙装置中电解饱和NaCl溶液的化学方程式为。
③下列说法正确的是
A.甲装置可以实现化学能向电能转化
B.甲装置中Na+透过阳离子交换膜向a极移动
C.乙装置中c极一侧流出的是淡盐水
④实际生产中,阳离子交换膜的损伤会造成OH- 迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl-浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
您最近一年使用:0次
2022-04-12更新
|
208次组卷
|
9卷引用:江西省临川一中暨临川一中实验学校2021-2022学年高二上学期期末考试化学试题
江西省临川一中暨临川一中实验学校2021-2022学年高二上学期期末考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题吉林省长春市清蒲中学2021-2022学年高二上学期期末考试化学试题吉林省永吉县第四中学2022-2023学年高二上学期期末考试化学试题北京市西城区2020-2021学年高二上学期期末考试化学试题江西省南昌市第二中学2020-2021学年高二上学期期末考试化学试题北京师范大学第二附属中学未来科技城学校2021-2022学年高二上学期期中考试化学试题北京三中2021-2022学年高二上学期期中考试化学试题天津市武清区杨村第一中学2023-2024学年高三上学期第三次质量检测化学试题



