1 . 乙酸正丁酯是优良的有机溶剂,因其具有果香气味,也用于香料工业。某同学在实验室制取并提纯乙酸正丁酯。实验操作如下:
Ⅰ.依次将18.5mL正丁醇和20.0mL冰醋酸的混合液,0.4mL浓硫酸加入A中,放入适量沸石,装置见下图(沸石、加热及加持等装置均已略去),然后加热回流约20分钟。

Ⅱ.将反应后的溶液进行如下处理:①水洗,②用试剂X干燥,③用质量分数为10%的 溶液洗涤。
溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯转入烧瓶中进行蒸馏,最后得到15.2g乙酸正丁酯。部分实验数据如表所示:
(1)装置B的名称是_______ ,其中冷却水从_______ (填“a”或b”)口进。
(2)制取乙酸正丁酯的化学方程式为_______ 。加热回流时,分水器中液体分为两层,适时放出水使上层液体流入烧瓶A,从平衡角度考虑,分水器的作用是_______ 。
(3)步骤Ⅱ中的操作顺序为_______ ,用 溶液洗涤的目的是
溶液洗涤的目的是_______ ,下列物质肯定不属于试剂X的是_______ (填字母)。
a.新制生石灰 b.无水硫酸镁 c.无水氯化钙 d.无水硫酸钠
(4)步骤I酯化反应过程中可能得到的有机副产物有_______ (写出一种物质的结构简式)。
(5)该实验过程中乙酸正丁酯的产率是_______ (保留2位有效数字)。
Ⅰ.依次将18.5mL正丁醇和20.0mL冰醋酸的混合液,0.4mL浓硫酸加入A中,放入适量沸石,装置见下图(沸石、加热及加持等装置均已略去),然后加热回流约20分钟。

Ⅱ.将反应后的溶液进行如下处理:①水洗,②用试剂X干燥,③用质量分数为10%的
 溶液洗涤。
溶液洗涤。Ⅲ.将所得到的乙酸正丁酯转入烧瓶中进行蒸馏,最后得到15.2g乙酸正丁酯。部分实验数据如表所示:
| 密度/(g/cm3) | 沸点/℃ | 水溶性 | |
| 1-丁醇 | 0.80 | 117.7 | 可溶 |
| 乙酸 | 1.05 | 117.9 | 互溶 |
| 乙酸正丁酯 | 0.88 | 126.6 | 微溶 |
(2)制取乙酸正丁酯的化学方程式为
(3)步骤Ⅱ中的操作顺序为
 溶液洗涤的目的是
溶液洗涤的目的是a.新制生石灰 b.无水硫酸镁 c.无水氯化钙 d.无水硫酸钠
(4)步骤I酯化反应过程中可能得到的有机副产物有
(5)该实验过程中乙酸正丁酯的产率是
您最近一年使用:0次
名校
2 . 肉桂酸乙酯是高级防晒霜中必不可少的成分之一。由于其分子中存在碳碳双键,稳定性较差。研究肉桂酸乙酯的合成一直是热点,制备原理如下:

已知:①物理常数
②三元共沸物的组成和沸点
③实验步骤:
①向圆底烧瓶中加入44.4g肉桂酸、25mL无水乙醇和25mL环己烷,在不断振摇下将3mL浓硫酸分多次加入其中,加完后充分摇匀并加入几粒沸石;
②按照图示组装好仪器(安装分水器),加热圆底烧瓶,开始回流,分水器中出现上下两层;
③停止加热后,将圆底烧瓶中的物质倒入盛有80mL水的烧杯中,分批加入碳酸钠粉末至溶液呈弱酸性,直至无二氧化碳逸出;
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层;
⑤……
⑥首先低温蒸出乙醚,再改用减压蒸馏 水浴加热即可
水浴加热即可 得到产品肉桂酸乙酯的体积为35.2mL。
得到产品肉桂酸乙酯的体积为35.2mL。
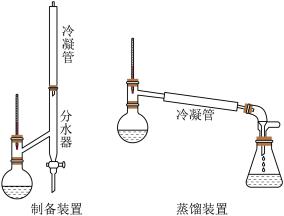
回答下列问题:
(1)已经开始回流,发现盛装硫酸的量筒中残留大量硫酸,后续应该如何操作___ 。
(2)实验中加入环己烷的作用是___ 。
(3)制备肉桂酸乙酯时,反应结束的判断标准为___ 。
(4)步骤⑤所对应的操作为___ ;减压蒸馏的原因是___ ;减压蒸馏时,选用的冷凝管为___  填字母)。
填字母)。
A.空气冷凝管 B.球形冷凝管 C.直形冷凝管 D.蛇形冷凝管
(5)已知无水乙醇的密度为0.79g·mL-1,该实验中肉桂酸乙酯的产率为___ 。

已知:①物理常数
| 有机物 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度/(g•mL-1) | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 肉桂酸 | 148 | 白色晶体 | 135 | 300 | 1.25 | 微溶 | 溶 | 溶 |
| 肉桂酸乙酯 | 176 | 无色油状 | 12 | 271.5 | 1.05 | 不溶 | 溶 | 溶 |
| 物质 | 水 | 乙醇 | 环己烷 | 共沸物 | |
| 沸点/℃(1atm) | 100 | 78.3 | 80.8 | 62.6 | |
| 质量分数/% | 4.8 | 19.7 | 75.5 |  | |
| 分水器内液体组成 | 上层 | 0.2 | 5.2 | 94.6 |  |
| 下层 | 10.4 | 18.4 | 71.2 | ||
①向圆底烧瓶中加入44.4g肉桂酸、25mL无水乙醇和25mL环己烷,在不断振摇下将3mL浓硫酸分多次加入其中,加完后充分摇匀并加入几粒沸石;
②按照图示组装好仪器(安装分水器),加热圆底烧瓶,开始回流,分水器中出现上下两层;
③停止加热后,将圆底烧瓶中的物质倒入盛有80mL水的烧杯中,分批加入碳酸钠粉末至溶液呈弱酸性,直至无二氧化碳逸出;
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层;
⑤……
⑥首先低温蒸出乙醚,再改用减压蒸馏
 水浴加热即可
水浴加热即可 得到产品肉桂酸乙酯的体积为35.2mL。
得到产品肉桂酸乙酯的体积为35.2mL。
回答下列问题:
(1)已经开始回流,发现盛装硫酸的量筒中残留大量硫酸,后续应该如何操作
(2)实验中加入环己烷的作用是
(3)制备肉桂酸乙酯时,反应结束的判断标准为
(4)步骤⑤所对应的操作为
 填字母)。
填字母)。A.空气冷凝管 B.球形冷凝管 C.直形冷凝管 D.蛇形冷凝管
(5)已知无水乙醇的密度为0.79g·mL-1,该实验中肉桂酸乙酯的产率为
您最近一年使用:0次
2021-07-28更新
|
134次组卷
|
2卷引用:江西省宜春市丰城市第九中学2020-2021学年高二下学期期中考试化学试题
名校
3 . 某有机化合物充分燃烧后的产物只有CO2和H2O,摩尔质量为90g/mol,含碳元素的质量分数为40%,氢元素的质量分数为6.67%。
(1)该化合物的分子式为___________ 。
(2)取相同质量的该化合物分别与足量的NaHCO3和Na反应,生成标准状况下的气体的量相同,则该有机物可能的结构简式为___________ 。
(3)该分子有多种同分异构体,写出满足下列条件的物质与足量乙酸反应的化学方程式:___________ :
Ⅰ.能与新制的银氨溶液反应生成光亮的银镜;
Ⅱ.该物质与足量的乙酸在一定条件下生成1mol有机产物时,质量增加84g;
Ⅲ.该物质有5种环境的氢。
(1)该化合物的分子式为
(2)取相同质量的该化合物分别与足量的NaHCO3和Na反应,生成标准状况下的气体的量相同,则该有机物可能的结构简式为
(3)该分子有多种同分异构体,写出满足下列条件的物质与足量乙酸反应的化学方程式:
Ⅰ.能与新制的银氨溶液反应生成光亮的银镜;
Ⅱ.该物质与足量的乙酸在一定条件下生成1mol有机产物时,质量增加84g;
Ⅲ.该物质有5种环境的氢。
您最近一年使用:0次
解题方法
4 . 酯广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯一般通过乙酸和乙醇酯化合成。请根据要求回答下列问题:
(1)将乙酸、乙醇、浓硫酸混合的同时加入碎瓷片的目的是_______ ,在合成过程中控制乙酸过量的作用是_______ 。
(2)向反应后混合液中加入5%Na2CO3溶液洗涤至中性。分液,取上层油状液体,加入无水Na2SO4固体,过滤后蒸馏,收集76~78℃馏分。实验中加入少量无水Na2SO4固体的目的是_______ 。
(3)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂。实验数据如表所示(乙酸和乙醇以等物质的量混合)。
①根据表中数据,下列_______ (填字母)为该反应的最佳条件。
A.40℃,3h B.60℃,4h C.80℃,2h D.120℃,4h
②当反应温度达到120℃时,反应选择性降低的原因可能为_______ 。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH CH3COOC2H5+2H2
CH3COOC2H5+2H2
在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图。关于该方法,下列推测合理的是_______ 。

A.该反应属于消去反应
B.反应温度不宜超过300℃
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
(1)将乙酸、乙醇、浓硫酸混合的同时加入碎瓷片的目的是
(2)向反应后混合液中加入5%Na2CO3溶液洗涤至中性。分液,取上层油状液体,加入无水Na2SO4固体,过滤后蒸馏,收集76~78℃馏分。实验中加入少量无水Na2SO4固体的目的是
(3)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂。实验数据如表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
A.40℃,3h B.60℃,4h C.80℃,2h D.120℃,4h
②当反应温度达到120℃时,反应选择性降低的原因可能为
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH
 CH3COOC2H5+2H2
CH3COOC2H5+2H2在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图。关于该方法,下列推测合理的是

A.该反应属于消去反应
B.反应温度不宜超过300℃
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
您最近一年使用:0次
5 . 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr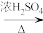 C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________ 。
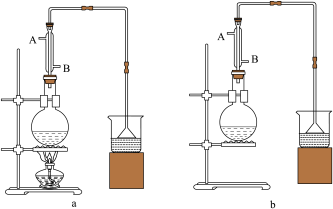
(2)反应装置中的烧瓶应选择下列哪种规格最合适( )
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是( )
A. A进B出B. B进A出C.从A进或B进均可
(4)可能发生的副反应为:_____________ 、__________ 、______________ (至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________ 。
C2H5—OH+HBr
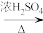 C2H5Br+H2O
C2H5Br+H2O已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?

(2)反应装置中的烧瓶应选择下列哪种规格最合适
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是
A. A进B出B. B进A出C.从A进或B进均可
(4)可能发生的副反应为:
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是
您最近一年使用:0次
2016-12-09更新
|
656次组卷
|
22卷引用:云南省玉溪市通海县三中2019-2020学年高二上学期期中考试化学试题
云南省玉溪市通海县三中2019-2020学年高二上学期期中考试化学试题云南省玉溪市澄江一中2019-2020学年高二上学期期中考试化学试题广东省佛山市萌茵实验学校2020-2021学年高二下学期期中考试化学试题2015-2016学年宁夏银川二中高二下3月月考化学试卷云南省鲁甸县一中2019-2020学年高二10月月考化学试题云南省昭通鲁甸县二中2019-2020学年高二10月月考化学试题云南省河口县第一中学2019-2020学年高二上学期12月月考化学试题云南省玉溪市华宁县第二中学2019-2020学年高二上学期期末考试化学试题云南省迪庆州香格里拉中学2019-2020学年高二上学期期末考试化学试题云南省富宁县三中2019-2020学年高二上学期期末考试化学试题云南省绿春县高级中学2019-2020学年高二上学期期末考试化学试题云南省普洱市墨江县民族学校2019—2020学年高二上学期期末考试化学试题云南省镇雄县民族中学2019-2020学年高二上学期期末考试化学试题云南省昭通市彝良县第一中学2019—2020学年高二上学期期末考试化学试题贵州省贞丰县第二中学2019-2020学年高二上学期期末考试化学试题云南省勐腊县第二中学2019-2020学年高二上学期期末考试化学试题广西罗城县第二高级中学2019-2020学年高二上学期期末考试化学试题广西贺州市富川县民族中学2019-2020学年高二上学期期末考试化学试题广西壮族自治区河池市环江县第三中学2019-2020学年高二上学期期末考试化学试题云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题河北省张家口市第一中学2020-2021学年高二下学期 4月月考(普实班)化学试题广东省深圳市龙华中学2021-2022学年高三下学期(二月第一次)半周测化学试题
6 . 某学习小组按如下实验流程制备乙酸乙酯,并测定乙酸乙酯的酸值(乙酸的含量)。

实验(一)乙酸乙酯的制取
已知:乙酸乙酯在盐溶液中溶解度较小
实验(二)乙酸乙酯酸值的测定
某同学通过查阅资料可知:
A.中和1g酯中含有的酸所需氢氧化钾的质量(mg)即为酸值,单位用mg/g表示;
B.常温下乙酸乙酯在稀碱溶液中反应速率较慢;
该学习小组设计如下实验步骤测定乙酸乙酯的酸值。
步骤1:取10mL乙醇,加入2-3滴酚酞试液,用0.10mol/LKOH标准液滴加至出现微粉红色,备用。
步骤2:用托盘天平称取10.0g样品,加入步骤1中配制的溶液,待试样完全溶解后,用0.10mol/LKOH标准液滴定,直至出现微粉红色,并保持5s不褪色即为终点。
步骤3:重复测定,计算乙酸乙酯的酸值 回答下列问题:
(1)实验(一)中浓硫酸的作用是________ ;
(2)蒸馏2最适合的装置________ 。(加热装置和夹持仪器已省略)

(3)洗涤-分液环节操作②的目的是________ 。
(4)实验(二)步骤1加入乙醇的目的________ ;
(5)下列操作会导致酸值测定结果偏高的是 。
(6)数据记录如下表,计算酸值________ mg/g。

实验(一)乙酸乙酯的制取
已知:乙酸乙酯在盐溶液中溶解度较小
实验(二)乙酸乙酯酸值的测定
某同学通过查阅资料可知:
A.中和1g酯中含有的酸所需氢氧化钾的质量(mg)即为酸值,单位用mg/g表示;
B.常温下乙酸乙酯在稀碱溶液中反应速率较慢;
该学习小组设计如下实验步骤测定乙酸乙酯的酸值。
步骤1:取10mL乙醇,加入2-3滴酚酞试液,用0.10mol/LKOH标准液滴加至出现微粉红色,备用。
步骤2:用托盘天平称取10.0g样品,加入步骤1中配制的溶液,待试样完全溶解后,用0.10mol/LKOH标准液滴定,直至出现微粉红色,并保持5s不褪色即为终点。
步骤3:重复测定,计算乙酸乙酯的酸值 回答下列问题:
(1)实验(一)中浓硫酸的作用是
(2)蒸馏2最适合的装置

(3)洗涤-分液环节操作②的目的是
(4)实验(二)步骤1加入乙醇的目的
(5)下列操作会导致酸值测定结果偏高的是 。
| A.装氢氧化钾标准液的滴定管水洗后直接滴定 |
| B.溶液出现微粉红色,并持续30秒不褪色 |
| C.锥形瓶用蒸馏水洗净后未干燥即盛放待测液 |
| D.振荡过猛,锥形瓶中有溶液溅出 |
| 次数 | 滴定前读数/mL | 滴定后读数/mL |
| 第1次 | 0.00 | 1.98 |
| 第2次 | 1.98 | 4.00 |
| 第3次 | 4.00 | 5.80 |
| 第4次 | 5.80 | 7.80 |
您最近一年使用:0次



