名校
解题方法
1 . 水杨酸异戊酯(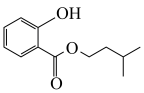 ,摩尔质量为208g/mol)是一种具有较高应用价值的化工产品,在香精、医药等领域有广泛的应用。制备水杨酸异戊酯实验步骤如下:
,摩尔质量为208g/mol)是一种具有较高应用价值的化工产品,在香精、医药等领域有广泛的应用。制备水杨酸异戊酯实验步骤如下:
①取27.6g(0.20mol)水杨酸、43.2mL(0.40mol)异戊醇、8mL环己烯和2mL浓硫酸依次加到圆底烧瓶中。
②按照下图搭建反应装置,在145~155℃油浴下加热回流至不再有水生成。
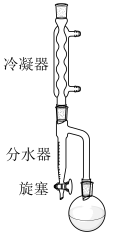
③待反应液冷却后依次用水、 溶液、饱和NaCl溶液洗涤至中性后分出有机层。
溶液、饱和NaCl溶液洗涤至中性后分出有机层。
④干燥、减压蒸馏有机层,收集到31.2g产物。
⑤用红外光谱仪和核磁共振仪对产物进行表征。
已知:①环己烯(沸点83℃)可与水形成沸点为70℃的共沸物。
②沸点:水杨酸211℃、异戊醇131℃、环己烯83℃、水杨酸异戊酯282℃。
回答以下问题:
(1)反应中浓硫酸的作用是吸水剂和_______ ,加入环己烯的目的是_______ 。
(2)写出制备水杨酸异戊酯的化学方程式:_______ 。
(3)步骤②中回流到圆底烧瓶中的物质主要有_______ ,表明反应中不再有水生成的现象是_______ 。
(4)洗涤反应液时需要使用的仪器是_______ 。
(5)采用减压蒸馏有机层滤液的原因是_______ 。
(6)本次实验的产率为_______ %。
(7)红外光谱图中可获得产物信息包括_______ 。
a.产物中碳氧双键键长 b.产物相对分子质量
c.产物中含有酯基结构 d.产物中氧元素质量分数
 ,摩尔质量为208g/mol)是一种具有较高应用价值的化工产品,在香精、医药等领域有广泛的应用。制备水杨酸异戊酯实验步骤如下:
,摩尔质量为208g/mol)是一种具有较高应用价值的化工产品,在香精、医药等领域有广泛的应用。制备水杨酸异戊酯实验步骤如下:①取27.6g(0.20mol)水杨酸、43.2mL(0.40mol)异戊醇、8mL环己烯和2mL浓硫酸依次加到圆底烧瓶中。
②按照下图搭建反应装置,在145~155℃油浴下加热回流至不再有水生成。

③待反应液冷却后依次用水、
 溶液、饱和NaCl溶液洗涤至中性后分出有机层。
溶液、饱和NaCl溶液洗涤至中性后分出有机层。④干燥、减压蒸馏有机层,收集到31.2g产物。
⑤用红外光谱仪和核磁共振仪对产物进行表征。
已知:①环己烯(沸点83℃)可与水形成沸点为70℃的共沸物。
②沸点:水杨酸211℃、异戊醇131℃、环己烯83℃、水杨酸异戊酯282℃。
回答以下问题:
(1)反应中浓硫酸的作用是吸水剂和
(2)写出制备水杨酸异戊酯的化学方程式:
(3)步骤②中回流到圆底烧瓶中的物质主要有
(4)洗涤反应液时需要使用的仪器是
(5)采用减压蒸馏有机层滤液的原因是
(6)本次实验的产率为
(7)红外光谱图中可获得产物信息包括
a.产物中碳氧双键键长 b.产物相对分子质量
c.产物中含有酯基结构 d.产物中氧元素质量分数
您最近一年使用:0次
解题方法
2 . 下列实验方案合理的是
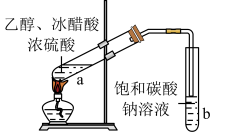

| A.除去Na2CO3溶液中混有少量NaHCO3杂质时,可加入足量NaOH溶液 |
| B.用图所示的实验装置制备乙酸乙酯 |
C.向溶液中加入盐酸酸化的氯化钡溶液可鉴定溶液中是否含有 |
| D.配制50 g质量分数为5%CuSO4溶液:将47.5 mL水加入到盛有2.5 g CuSO4·5H2O的烧杯中,搅拌溶解 |
您最近一年使用:0次
名校
3 . 肉桂酸乙酯是高级防晒霜中必不可少的成分之一、由于其分子中存在碳碳双键,稳定性较差。研究肉桂酸乙酯的合成一直是热点,制备原理:
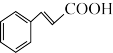 +CH3CH2OH
+CH3CH2OH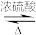
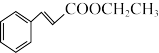 +H2O
+H2O
已知:Ⅰ.物理常数
Ⅱ.三元共沸物的组成和沸点
Ⅲ.实验步骤:
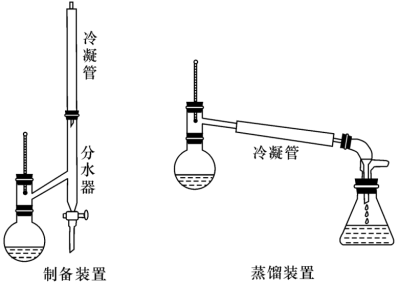
①向圆底烧瓶中加入44.4g肉桂酸、25mL无水乙醇和25mL环己烷,在不断振摇下将3mL浓硫酸分多次加入其中,加完后充分摇匀并加入几粒沸石;
②按照图示组装好仪器(安装分水器),加热圆底烧瓶,开始回流,分水器中出现上下两层,过程中不断将上层液体流回圆底烧瓶,将下层液体放出;
③停止加热后,将圆底烧瓶中的物质倒入盛有80mL水的烧杯中,分批加入碳酸钠粉末;
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层;
⑤干燥,过滤;
⑥首先低温蒸出乙醚,再改用减压蒸馏(水浴加热即可)得到产品肉桂酸乙酯的体积为35.2mL。回答下列问题:
(1)蒸馏装置中,选用的冷凝管为_______(填标号)。
(2)本实验中,分水器的作用是_______ 。
(3)步骤③加入碳酸钠粉末的作用是_______ 。
(4)步骤⑤合适的干燥剂为_______ (填标号);
A.浓硫酸 B.无水氯化钙 C.氧化钙 D.氢氧化钠
采用减压蒸馏的原因是_______ 。
(5)已知无水乙醇的密度为0.79 g·mL−1,该实验中肉桂酸乙酯的产率为_______ 。
(6)产品纯度的分析,取amL所得样品,用乙醇作溶剂,准确配制成250.00mL溶液,量取25.00mL所配溶液转移至锥形瓶中,加入mg氢氧化钠(过量),充分反应后,用浓度为c mol·L−1的盐酸滴定,消耗盐酸的体积为V mL,该样品的纯度为_______ (用代数式表示,无需化简)。
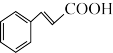 +CH3CH2OH
+CH3CH2OH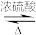
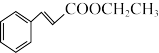 +H2O
+H2O已知:Ⅰ.物理常数
| 有机物 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度/(g/mL) | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 肉桂酸 | 148 | 白色晶体 | 135 | 300 | 1.25 | 微溶 | 溶 | 溶 |
| 肉桂酸乙酯 | 176 | 无色油状 | 12 | 271.5 | 1.05 | 不溶 | 溶 | 溶 |

Ⅱ.三元共沸物的组成和沸点
| 物质 | 水 | 乙醇 | 环己烷 | 共沸物 | |
| 沸点/℃(1at) | 100 | 78.3 | 80.8 | 62.6 | |
| 质量分数/% | 4.8 | 19.7 | 75.5 | ---------- | |
| 分水器内液体组成 | 上层 | 0.2 | 5.2 | 94.6 | --------------- |
| 下层 | 10.4 | 18.4 | 71.2 | ||
①向圆底烧瓶中加入44.4g肉桂酸、25mL无水乙醇和25mL环己烷,在不断振摇下将3mL浓硫酸分多次加入其中,加完后充分摇匀并加入几粒沸石;
②按照图示组装好仪器(安装分水器),加热圆底烧瓶,开始回流,分水器中出现上下两层,过程中不断将上层液体流回圆底烧瓶,将下层液体放出;
③停止加热后,将圆底烧瓶中的物质倒入盛有80mL水的烧杯中,分批加入碳酸钠粉末;
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层;
⑤干燥,过滤;
⑥首先低温蒸出乙醚,再改用减压蒸馏(水浴加热即可)得到产品肉桂酸乙酯的体积为35.2mL。回答下列问题:
(1)蒸馏装置中,选用的冷凝管为_______(填标号)。
| A.空气冷凝管 | B.球形冷凝管 | C.直形冷凝管 | D.蛇形冷凝管 |
(3)步骤③加入碳酸钠粉末的作用是
(4)步骤⑤合适的干燥剂为
A.浓硫酸 B.无水氯化钙 C.氧化钙 D.氢氧化钠
采用减压蒸馏的原因是
(5)已知无水乙醇的密度为0.79 g·mL−1,该实验中肉桂酸乙酯的产率为
(6)产品纯度的分析,取amL所得样品,用乙醇作溶剂,准确配制成250.00mL溶液,量取25.00mL所配溶液转移至锥形瓶中,加入mg氢氧化钠(过量),充分反应后,用浓度为c mol·L−1的盐酸滴定,消耗盐酸的体积为V mL,该样品的纯度为
您最近一年使用:0次
4 . 下列实验不能达到目的的是
| 目的 | 实验 | |
| A | 证明乙醇分子中含有一个羟基 | 23g金属钠和含有1mol乙醇的水溶液作用恰好产生0.5molH2 |
| B | 鉴别乙酸乙酯和乙酸 | 分别加入饱和NaHCO3溶液 |
| C | 测定混有NaCl的Na2CO3固体样品中Na2CO3的质量分数 | 取m1g样品加入过量盐酸充分反应,加热蒸干后,称量固体质量为m2g |
| D | 研究浓度对反应速率的影响 | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 下列实验装置能达到实验目的的是
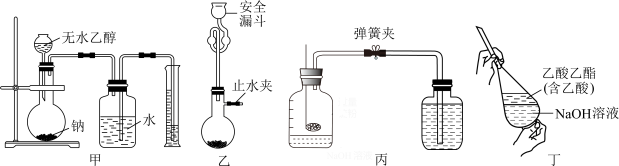
| A.装置甲测定乙醇结构 |
| B.装置乙制取少量CO2 |
| C.装置丙红磷燃烧测定空气中氧气的含量 |
| D.装置丁提纯乙酸乙酯 |
您最近一年使用:0次
2022-05-15更新
|
575次组卷
|
2卷引用:湖北武汉市2022届高三5月第一次模拟考试化学试题
6 . 甲酸 是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。

Ⅰ.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸 与甲醇
与甲醇 的酯化反应实验:
的酯化反应实验:
有关物质的性质如下:
(1)装置中,仪器A的名称是__________ ,长玻璃管c的作用是__________ 、__________
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________ 。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为____________________ 。
Ⅱ.甲酸能脱水制取一氧化碳,一定条件下, 能与
能与 固体发生反应:
固体发生反应: 。
。
(1)如图所示是以甲酸钠 溶液为电解质溶液的甲醇燃料电池:
溶液为电解质溶液的甲醇燃料电池:
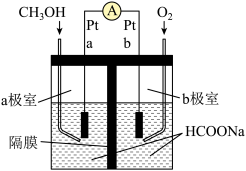
则a极电极反应式为_______________ 。
(2)测定产物中甲酸钠 的纯度:
的纯度: 与足量
与足量 充分反应后,消耗标况下
充分反应后,消耗标况下 ,所得固体物质为
,所得固体物质为 ,则所得固体物质中甲酸钠的质量分数为
,则所得固体物质中甲酸钠的质量分数为_______ (计算结果精确到0.1%)。
(3)甲酸钠溶液呈弱碱性的原因:__________________ (用离子方程式表示)
 是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
Ⅰ.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸
 与甲醇
与甲醇 的酯化反应实验:
的酯化反应实验:有关物质的性质如下:
| 沸点/℃ | 密度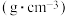 | 水中溶解性 | |
| 甲醇 | 64.5 | 0.79 | 易溶 |
| 甲酸 | 100.7 | 1.22 | 易溶 |
| 甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)装置中,仪器A的名称是
(2)甲酸和甲醇进行酯化反应的化学方程式为
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为
Ⅱ.甲酸能脱水制取一氧化碳,一定条件下,
 能与
能与 固体发生反应:
固体发生反应: 。
。(1)如图所示是以甲酸钠
 溶液为电解质溶液的甲醇燃料电池:
溶液为电解质溶液的甲醇燃料电池:
则a极电极反应式为
(2)测定产物中甲酸钠
 的纯度:
的纯度: 与足量
与足量 充分反应后,消耗标况下
充分反应后,消耗标况下 ,所得固体物质为
,所得固体物质为 ,则所得固体物质中甲酸钠的质量分数为
,则所得固体物质中甲酸钠的质量分数为(3)甲酸钠溶液呈弱碱性的原因:
您最近一年使用:0次
7 . 下列实验操作可达到预期目的的是
| 选项 | 目的 | 操作 |
| A | 利用密度差异分离混合物 | 对乙酸乙酯和乙醇混合液用分液漏斗进行分液 |
| B | 配制0.10mol/LNa2CO3溶液 | 称取5.3gNa2CO3•10H2O固体于烧杯中,加入少量蒸馏水溶解,冷却后,转移至500mL容量瓶中定容 |
| C | 测定硫酸铜晶体中结晶水含量 | 加热后的坩埚直接放置在石棉网上冷却,称重 |
| D | 配制FeSO4溶液 | 先将FeSO4固体溶在稀硫酸中,然后稀释,并加入少量铁粉 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-23更新
|
1212次组卷
|
5卷引用:四川省成都市2022届高三第二次诊断性检测理综化学试题
四川省成都市2022届高三第二次诊断性检测理综化学试题(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)卷13 化学基础实验(检验、鉴别、分离、提纯)-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)山东省潍坊青州市2022届5月学业水平等级考试化学试题(已下线)第一部分 二轮专题突破 专题17 典型实验装置及化学实验基本操作
解题方法
8 . 化合物H是一种用于合成胃酸分泌调节剂的药物中间体,其合成路线流程图如图:
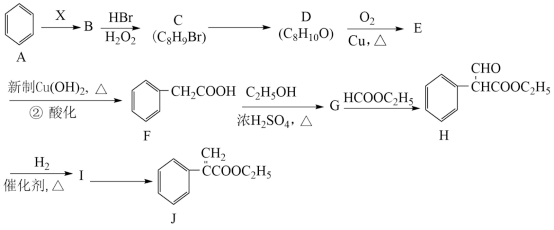
已知B为烃,其中含碳元素的质量分数为92.31%,其相对分子质量小于110。回答下列问题:
(1)H的官能团名称是__ 。
(2)X的名称为__ 。
(3)I→J的反应条件为__ ;A→B的反应类型为__ 。
(4)B分子中最多有__ 个碳原子在一条直线上。
(5)化合物I的多种同分异构体中,同时满足下列条件的同分异构体有__ 种。
①能发生水解反应和银镜反应②能与FeCl3溶液发生显色反应③苯环上有四个取代基,且苯环上一卤代物只有一种。其中,核磁共振氢谱有5组吸收峰物质的结构简式为__ (任写一种即可)。
(6)参照上述合成路线,写出由F、甲醇、甲酸甲酯为有机原料制备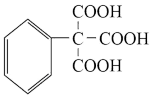 的合成路线流程图
的合成路线流程图___ (无机试剂任选)。
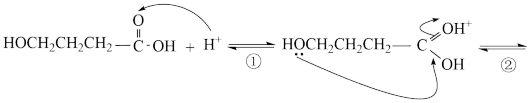
(7)酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):
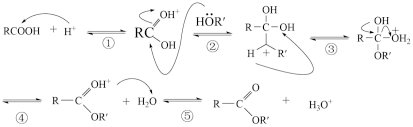
据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯(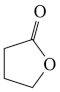 )的反应历程:
)的反应历程:
__ 。

已知B为烃,其中含碳元素的质量分数为92.31%,其相对分子质量小于110。回答下列问题:
(1)H的官能团名称是
(2)X的名称为
(3)I→J的反应条件为
(4)B分子中最多有
(5)化合物I的多种同分异构体中,同时满足下列条件的同分异构体有
①能发生水解反应和银镜反应②能与FeCl3溶液发生显色反应③苯环上有四个取代基,且苯环上一卤代物只有一种。其中,核磁共振氢谱有5组吸收峰物质的结构简式为
(6)参照上述合成路线,写出由F、甲醇、甲酸甲酯为有机原料制备
 的合成路线流程图
的合成路线流程图(7)酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):

据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯(
 )的反应历程:
)的反应历程:
您最近一年使用:0次
9 . 乙酸乙酯是一种用途广泛的精细化工产品,一般通过乙酸和乙醇酯化合生成。
(1)在实验室利用上述方法制得乙酸乙酯含有杂质(不计副反应),简述如何提纯产品_______ 。
(2)若用 标记乙醇,该反应的化学方程式
标记乙醇,该反应的化学方程式_______ 。
(3)一定温度下该反应的平衡常数 。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率
。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率
_______ (计算时不计副反应);若乙酸和乙醇的物质的量之比为 ,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图
,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图_______ 。
(4)近年来,用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显的经济优势,其合成的基本反应为 (
( )。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是
)。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是_______ 。
a.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,反应已达到化学平衡
b.当乙烯的百分含量保持不变时,反应已达到化学平衡
c.在反应过程中任意时刻移除部分产品,都可以使平衡正向移动,但该反应的平衡常数不变
d.达到平衡后再通入少量乙烯,再次达到平衡时,乙烯的浓度大于原平衡
(5)在乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强、相同时间点进行了乙酸乙酯的产率随温度变化的测定实验,实验结果如图所示。回答下列问题:
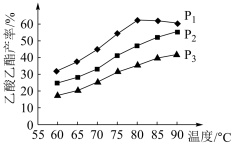
①温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是_______ [用 、
、 、
、 分别表示在不同压强下的反应速率]。
分别表示在不同压强下的反应速率]。
②在压强为 、温度超过80℃时,乙酸乙酯产率下降的原因可能是
、温度超过80℃时,乙酸乙酯产率下降的原因可能是_______ 。
③为提高乙酸乙酯的合成速率和产率,可以采取的措施_______ (任写两条)。
(1)在实验室利用上述方法制得乙酸乙酯含有杂质(不计副反应),简述如何提纯产品
(2)若用
 标记乙醇,该反应的化学方程式
标记乙醇,该反应的化学方程式(3)一定温度下该反应的平衡常数
 。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率
。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率
 ,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图
,相应平衡体系中乙酸乙酯的物质的量分数为x,请绘制x随n变化的示意图(4)近年来,用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显的经济优势,其合成的基本反应为
 (
( )。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是
)。在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是a.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,反应已达到化学平衡
b.当乙烯的百分含量保持不变时,反应已达到化学平衡
c.在反应过程中任意时刻移除部分产品,都可以使平衡正向移动,但该反应的平衡常数不变
d.达到平衡后再通入少量乙烯,再次达到平衡时,乙烯的浓度大于原平衡
(5)在乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强、相同时间点进行了乙酸乙酯的产率随温度变化的测定实验,实验结果如图所示。回答下列问题:

①温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是
 、
、 、
、 分别表示在不同压强下的反应速率]。
分别表示在不同压强下的反应速率]。②在压强为
 、温度超过80℃时,乙酸乙酯产率下降的原因可能是
、温度超过80℃时,乙酸乙酯产率下降的原因可能是③为提高乙酸乙酯的合成速率和产率,可以采取的措施
您最近一年使用:0次
2021-04-09更新
|
721次组卷
|
2卷引用:上海市黄埔区2021届高三第二次模拟考试化学试题
解题方法
10 . I.乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
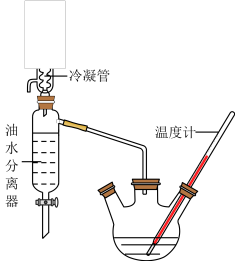
第一步:在反应容器中加入0.1 mol无水乳酸、45.0 mL(密度:0.789g/cm3)无水乙醇、一定量的苯和沸石……;装上油水分离器和冷凝管,缓慢加热回流2 h至反应完全。
第二步:将反应容器中液体倒入盛有适量5%Na2CO3溶液的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中充分静置,过滤、蒸馏,得产品7.08 g。
(1)第一步操作中,还缺少的试剂是______________________ ;加入苯的目的是_________________ ;实验过程中,若油水分离器中水层不再增厚,则表明___________________________________ 。
(2)第二步中证明“水洗”已经完成的实验方案是_______________________________ 。
(3)本实验制备乳酸乙酯的产率为_________________________ 。
Ⅱ.磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强,易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05m·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
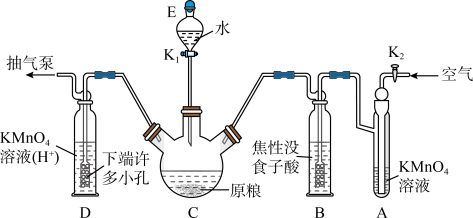
【操作流程】安装吸收装置 PH3的产生与吸收
PH3的产生与吸收 转移KMnO4吸收溶液
转移KMnO4吸收溶液 亚硫酸钠标准溶液滴定。
亚硫酸钠标准溶液滴定。
【实验装置】C中盛100 g原粮,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化)。请回答下列问题:
(4)仪器C的名称是______________ ;检查整套装置气密性的方法是___________________________________________________________________________ 。
(5)A中盛装KMnO4,溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液.其作用是______________________________ 。D中PH3被氧化成磷酸,所发生反应的离子方程式为____________________________________________ 。
(6)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标准Na2SO3溶液11.00 mL,则该原粮中磷化物(以PH3计)的含量为_________________________ mg·kg-1。
①部分物质的沸点:
| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:

第一步:在反应容器中加入0.1 mol无水乳酸、45.0 mL(密度:0.789g/cm3)无水乙醇、一定量的苯和沸石……;装上油水分离器和冷凝管,缓慢加热回流2 h至反应完全。
第二步:将反应容器中液体倒入盛有适量5%Na2CO3溶液的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中充分静置,过滤、蒸馏,得产品7.08 g。
(1)第一步操作中,还缺少的试剂是
(2)第二步中证明“水洗”已经完成的实验方案是
(3)本实验制备乳酸乙酯的产率为
Ⅱ.磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强,易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05m·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:

【操作流程】安装吸收装置
 PH3的产生与吸收
PH3的产生与吸收 转移KMnO4吸收溶液
转移KMnO4吸收溶液 亚硫酸钠标准溶液滴定。
亚硫酸钠标准溶液滴定。【实验装置】C中盛100 g原粮,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化)。请回答下列问题:
(4)仪器C的名称是
(5)A中盛装KMnO4,溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液.其作用是
(6)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标准Na2SO3溶液11.00 mL,则该原粮中磷化物(以PH3计)的含量为
您最近一年使用:0次



