名校
1 . 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确 的是( )
| W | X | |||
| Y | Z |
| A.氢化物沸点:W > Z |
| B.氧化物对应水化物的酸性:Y > W |
| C.化合物熔点:Y2X3 < YZ3 |
| D.简单离子的半径:Y > X |
您最近一年使用:0次
名校
2 . W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。Z的单质为黄绿色气体,此气体同冷烧碱溶液作用,可得到含YZW的溶液,具有漂白性。下列说法正确的是
| A.原子半径大小为W<X<Y<Z |
| B.X的氢化物水溶液酸性强于Z的 |
| C.Y的氢化物为离子化合物 |
| D.X与Z具有相同的最高化合价 |
您最近一年使用:0次
名校
3 . 四种短周期元素在周期表中的相对位置如下所示,其中这四种元素原子的最外层电子数之和为20。下列说法中正确的是
| X | Y | |
| Z | W |
| A.最高价氧化物的水化物的酸性强弱:Z>Y>X |
| B.WO2是一种有毒气体,但不属于酸性氧化物 |
| C.常见气态氢化物稳定性:W>Z>Y>X |
| D.XW2中各原子最外层均达到8电子稳定结构 |
您最近一年使用:0次
名校
解题方法
4 . 下表为元素周期表的一部分。
(1) 表中元素______ 的非金属性最强;元素______ 的金属性最强;元素______ 的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是___________ ;
(3) 表中元素⑤在周期表中的位置为____________________ ;
(4) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:__________ >__________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑾ | ⑿ | ⒀ | ||||
(1) 表中元素
(2) 表中元素⑿的原子结构示意图是
(3) 表中元素⑤在周期表中的位置为
(4) 表中元素⑨和⑩最高价氧化物对应水化物的酸性:
您最近一年使用:0次
名校
5 . 下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白(填写序号不得分):
(1)在这些元素中,化学性质最不活泼的是:__________ 。(填元素符号 )
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式 是__________ ,碱性最强的化合物的化学式 是__________________ 。
(3)比较①与⑤的最高价氧化物对应的水化物,________________ 的酸性强(填化学式 )
(4)工业上制取②的氢化物的化学方程式 _______________________________________ ;
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式 为_____________ 。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________________________________________________ (用化学方程式 表示)
(6)比较③与⑥的氢化物,_______________ 更稳定,__________ 沸点更高(填化学式 )
(7)写出④的单质与水反应的化学方程式 _________________________________________ 。
(8)写出⑦元素的离子 结构示意图______________________ ,该离子半径_________ S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置__________________________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的
(3)比较①与⑤的最高价氧化物对应的水化物,
(4)工业上制取②的氢化物的
②的氢化物与②的最高价氧化物的水化物反应所得的产物
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因
(6)比较③与⑥的氢化物,
(7)写出④的单质与水反应的
(8)写出⑦元素的
您最近一年使用:0次
真题
名校
6 . 2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理 的是
| A.第35号元素的单质在常温常压下是液体 |
| B.位于第四周期第ⅤA族的元素为非金属元素 |
| C.第84号元素的最高化合价是+7 |
| D.第七周期0族元素的原子序数为118 |
您最近一年使用:0次
2019-04-12更新
|
8266次组卷
|
38卷引用:安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题
安徽省阜阳市第三中学2018-2019学年高一下学期第二次调研考试化学试题浙江省瑞安市上海新纪元高级中学2019-2020学年高一(7-10)班下学期期初考试化学试题河北省正定中学2019-2020学年高一3月月考化学试题河北省承德市第一中学2019-2020学年高一下学期3月疫情期间直播课堂检测化学试题苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册第四章 物质结构 元素周期律 高考挑战区人教版(2019)高一必修第一册 第四章素养检测鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律第2节 元素周期律和元素周期表 方法帮 高考帮高一必修第一册(苏教2019)专题5 第一单元 元素周期律和元素周期表3河北省石家庄市第二十三中学2020-2021学年高一上学期12月阶段考试化学试题(已下线)练习9 元素周期表-2020-2021学年【补习教材·寒假作业】高一化学(人教版)河北省石家庄市第二十三中学2020-2021学年高一上学期第三次月考化学试题2019年4月浙江省普通高校招生选考科目考试化学试题(已下线)专题06 物质结构 元素周期律——2019年高考真题和模拟题化学分项汇编甘肃省天水市第一中学2020届高三上学期第五次(期末)考试化学试题(已下线)【南昌新东方】2019 新建一中 高三期中 015(已下线)专题5.2 元素周期律和元素周期表(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.2 元素周期律和元素周期表(练)——2020年高考化学一轮复习讲练测(已下线)第18讲 元素周期律和元素周期表(精讲)——2021年高考化学一轮复习讲练测(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第14讲 元素周期律和元素周期表(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题(已下线)专题07.物质结构 元素周期律-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)第五单元 物质结构与元素周期律(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)第14讲 元素周期律和元素周期表(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省华中师范大学第一附属中学2022-2023学年高二上学期期中考试化学试题第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)专题07 元素周期表与元素周期律云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题
18-19高一下·山西·阶段练习
名校
7 . A、B两元素为ⅡA族和ⅢA族的元素,若A元素的原子序数为x,则B元素的原子序数可能为
①x+1 ②x+8 ③x+11 ④x-18 ⑤x+25 ⑥x+32
①x+1 ②x+8 ③x+11 ④x-18 ⑤x+25 ⑥x+32
| A.①②③④ | B.①③⑥ | C.①③⑤ | D.②④⑥ |
您最近一年使用:0次
名校
8 . W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W元素的一种核素可用于鉴定文物年代,X元素的一种单质可作为饮用水消毒剂,Y元素的简单离子是同周期元素的简单离子中半径最小的,Z元素和W元素同主族,R元素被称为“成盐元素”。下列说法错误的是
| A.W元素和X元素形成的化合物WX2属于非极性分子 |
| B.工业上常用电解熔融Y元素和R元素形成的化合物的方法来制取单质Y |
| C.制造日常生活中所使用的计算机芯片需要消耗大量单质Z |
| D.X元素和R元素形成的某种化合物可用于自来水的消毒 |
您最近一年使用:0次
2019-03-24更新
|
1522次组卷
|
5卷引用:河北省石家庄实验中学2019-2020学年高一3月月考化学试题
河北省石家庄实验中学2019-2020学年高一3月月考化学试题【全国百强校】湖南省长沙市雅礼中学2019届高三上学期月考(五)化学试题湖北省襄阳市第一中学2019-2020学年高二下学期四月月考化学试题江西省宜春市第九中学2019-2020学年高二下学期第二次月考化学(网班)试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)
名校
解题方法
9 . 现有a~i 9种短周期元素,它们在同期表中的位置如下,请据此回答下列问题:(请用具体的元素符号及化学用语作答)
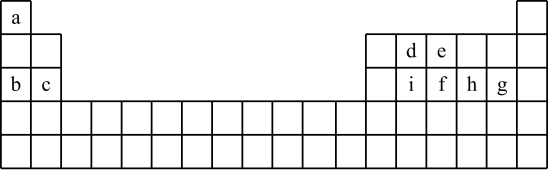
(1)a~i元素中,金属性最强的是________ ,最高价氧化物对应水化物中,酸性最强的物质是___________ 。g所在族的元素形成的氢化物中沸点最低的是____________________ 。
(2)比较b、e、g简单离子半径的大小___________________ (用离子符号作答)。
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式__________________ 、___________________ 。
(4)用一个化学反应方程式表示d的非金属性强于i_______________________________ 。
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是______ (填序号)。
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号_________ ;镓(Ga)与As同周期,最外层有3个电子,Ga与As可以形成一种新型化合物半导体材料,其性能更优越。这种新型化合物化学式为____________________ 。
(6)c与a形成的化合物的电子式为___________ ,用电子式表示a与h形成a2h的过程__________________________________________ 。
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式_________________________________ 。

(1)a~i元素中,金属性最强的是
(2)比较b、e、g简单离子半径的大小
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式
(4)用一个化学反应方程式表示d的非金属性强于i
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号
(6)c与a形成的化合物的电子式为
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式
您最近一年使用:0次
名校
10 . (1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D
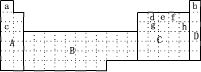
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________ (填名称),可以验证该结论的实验是_______ 。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______ ,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________ (用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
A.A B.B C.C D.D

(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:
(4)上表中c、h元素形成的简单离子半径之比
您最近一年使用:0次
2018-04-13更新
|
505次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2017-2018学年高一4月月考化学试题1



