名校
解题方法
1 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近一年使用:0次
名校
2 . 如表为元素周期表的一部分,用化学用语回答下列问题:
(1)⑧的原子结构示意图为________ 。
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是________ (填化学式)。
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________ (填化学式)。
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为________ 。②④两种元素形成的原子数目比为1:2的共价化合物的结构式为________ 。
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为________ 。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为
您最近一年使用:0次
解题方法
3 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
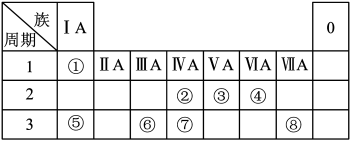
(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)②的最高价氧化物的分子式为___________ ;⑦的最高价氧化物对应水化物的分子式为___________ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:___________ 、___________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
(5)半径大小比较:③___________ ④;金属性强弱比较:⑤___________ ⑥(填“>”、“<”或“=”)。
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为___________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的分子式为
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
| A.最高正化合价为+6 | B.气态氢化物比 稳定 稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
(5)半径大小比较:③
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
4 . 铁是生产、生活及生命中的重要元素。回答下列问题:
(1)铁在元素周期表中的位置为______ 。
(2)碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。
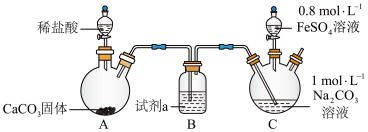
向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为______ 。
②向碳酸钠溶液中通入CO2的目的有______ 、______ 。
③试剂a是______ ,装置C中制取FeCO3的离子方程式为______ 。
(3)化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
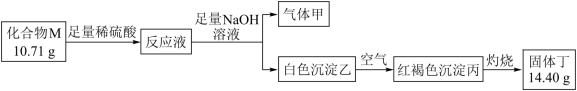
气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式______ 。
(1)铁在元素周期表中的位置为
(2)碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。

向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为
②向碳酸钠溶液中通入CO2的目的有
③试剂a是
(3)化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式
您最近一年使用:0次
2023-12-14更新
|
478次组卷
|
4卷引用:辽宁省沈阳市第一二0中学2023-2024学年高一上学期第三次质量监测化学试题
5 . 过渡元素钒、锰、铁、镍等在生活、科研中应用广泛。回答下列问题:
(1)钒广泛应用于航天、化工及能源等行业,与钒同周期且基态原子未成对电子数相同的元素可能位于周期表
(2)
 与水杨醛缩邻氨基苯酚
与水杨醛缩邻氨基苯酚 可形成黄色配合物,应用于科研光度法测定离子浓度。锰在元素周期表中的位置是
可形成黄色配合物,应用于科研光度法测定离子浓度。锰在元素周期表中的位置是 与其同分异构体
与其同分异构体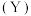 的结构如图1所示,沸点较高的是
的结构如图1所示,沸点较高的是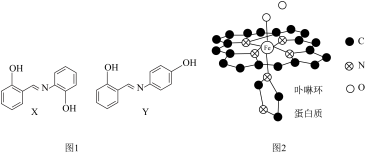
(3)铁是构成血红蛋白的必要成分,血红蛋白携氧后的配合物结构如图2所示(部分氢未画出)。中心
 的配位数为
的配位数为 与血红蛋白中
与血红蛋白中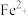 的配位能力
的配位能力 ,原因是
,原因是(4)砷化镍激光在医学上用于治疗皮肤及黏膜创面的感染及溃疡等,人工合成的砷化镍常存在各种缺陷,已知某缺陷砷化镍的组成为
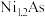 ,其中
,其中 元数只有+2和+3两种价态,则
元数只有+2和+3两种价态,则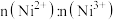 为
为
您最近一年使用:0次
6 . 钴是一种重要的过渡金属元素,常见化合价有+2、+3价。实验室利用 固体进行如下实验。下列说法正确的是
固体进行如下实验。下列说法正确的是
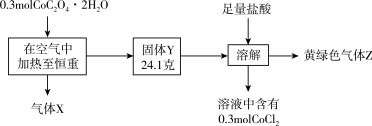
 固体进行如下实验。下列说法正确的是
固体进行如下实验。下列说法正确的是
| A.Co在元素周期表中位于第四周期Ⅷ族 |
B.固体Y为 |
C.酸性条件下氧化性: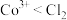 |
D.结合上述流程信息,若有0.1 mol 与足量盐酸充分反应,理论上可以得到0.1 mol 与足量盐酸充分反应,理论上可以得到0.1 mol  |
您最近一年使用:0次
解题方法
7 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
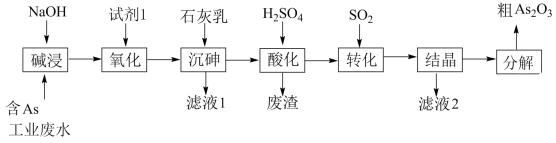
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是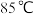 ,温度高于
,温度高于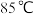 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
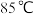 ,温度高于
,温度高于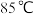 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近一年使用:0次
8 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中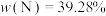 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
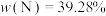 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
名校
解题方法
9 . 已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是
| Y | ||
| X | ||
| Z |
| A.Y的原子序数可能为a-17 | B.Y与Z的原子序数之和可能为2a |
| C.Z的原子序数可能为a+31 | D.X、Y、Z可能均为短周期元素 |
您最近一年使用:0次
2023-06-18更新
|
963次组卷
|
8卷引用:【全国校级联考】湖北省部分重点中学2017-2018学年高一下学期期中考试化学试题
解题方法
10 . 下表列出了A~M 13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是_______ (填元素符号,下同),非金属性最强的是_______ 。
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式_______ 。
(3)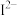 、
、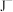 、
、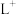 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是_______ ,最小的是_______ 。
(4)A与D形成的化合物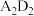 是
是_______ 化合物,其电子式为_______ 。
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式
(3)
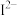 、
、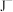 、
、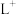 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是(4)A与D形成的化合物
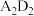 是
是
您最近一年使用:0次



