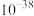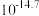解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。
2.25℃时,相关物质的 如下:
如下:
回答下列问题:
(1)Ni属于元素周期表的________ 区。
(2)混合气在“氧化”中,产生 ,其中S的化合价为
,其中S的化合价为________ 。
(3)“滤渣”的成分之一是软锰矿的主要成分,由 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为________ ;其可用于实验室制取氯气,该反应的离子方程式为________ 。
(4)若使 沉淀完全(浓度
沉淀完全(浓度 ),需调节pH不低于
),需调节pH不低于________ 。
(5)上述表格中a________ b(填“大于”、“小于”或“无法确定”)。
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是________ 。
(7)滤液2中含有的金属阳离子是________ 。
 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。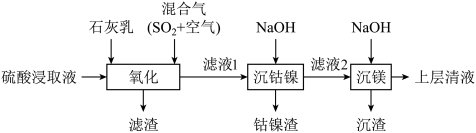
 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。2.25℃时,相关物质的
 如下:
如下:物质 |
|
|
|
|
|
|
| a | b |
(1)Ni属于元素周期表的
(2)混合气在“氧化”中,产生
 ,其中S的化合价为
,其中S的化合价为(3)“滤渣”的成分之一是软锰矿的主要成分,由
 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为(4)若使
 沉淀完全(浓度
沉淀完全(浓度 ),需调节pH不低于
),需调节pH不低于(5)上述表格中a
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是
(7)滤液2中含有的金属阳离子是
您最近一年使用:0次
解题方法
2 . 新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。两种常见储氢合金的晶胞结构如图所示。设阿伏加德罗常数为 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是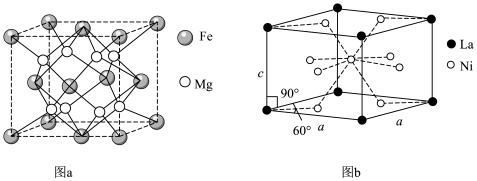
| A.图中涉及的四种元素均为d区元素 |
B.图b晶体的化学式为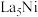 |
C.图a晶体晶胞边长为dpm,该合金的密度为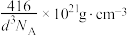 |
D.图a晶体储氢时,储存的氢相当于 分子在晶胞的体心和棱心位置,则含24g Mg的该储氢合金储存的 分子在晶胞的体心和棱心位置,则含24g Mg的该储氢合金储存的 在标准状况下的体积约为11.2L 在标准状况下的体积约为11.2L |
您最近一年使用:0次
2024-05-16更新
|
144次组卷
|
2卷引用:辽宁省凌源市2024届高三下学期第三次模拟考试化学试卷
3 . 一种超导材料(仅由Cs、Ag、F三种元素组成)的长方体晶胞结构如图所示(已知 ),下列说法错误的是
),下列说法错误的是
 ),下列说法错误的是
),下列说法错误的是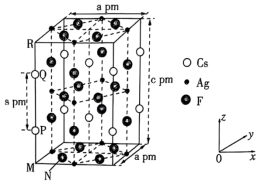
| A.基态47Ag位于元素周期表的ds区 |
B.若N点原子分数坐标为(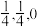 ),则P点原子分数坐标为( ),则P点原子分数坐标为(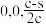 ) ) |
C.M、N之间的距离为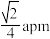 |
D.该化合物的密度为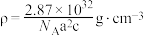 |
您最近一年使用:0次
2024-05-13更新
|
108次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
名校
4 . 钨(W)常用于制造白炽灯、碘钨灯等。工业上以黑钨矿(主要成分是 、
、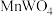 ,含少量
,含少量 、
、 )为原料冶炼钨的流程如图所示。
)为原料冶炼钨的流程如图所示。
请回答下列问题:
(1)基态 核外电子占据能量最高的能级符号是
核外电子占据能量最高的能级符号是__________ ;Mn位于元素周期表__________ 区。
(2)“粉碎”的目的是__________ ;从“浸取”得到的浸渣中分离出 的操作方法是
的操作方法是__________ 、过滤、洗涤、干燥。
(3)根据“转化”,判断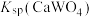
__________ 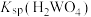 (填“>”或“<”)。
(填“>”或“<”)。
(4)“灼烧”中盛装固体的仪器是__________ (填名称);发生反应的化学方程式为______________________________ 。
(5)碳化钨是一种耐磨、耐高温、高硬度材料。碳化钨晶胞如图所示。已知:晶胞底边长为apm,高为bpm, 为阿伏加德罗常数的值。碳化钨晶体密度为
为阿伏加德罗常数的值。碳化钨晶体密度为__________  (列出计算式即可)。
(列出计算式即可)。
 、
、 ,含少量
,含少量 、
、 )为原料冶炼钨的流程如图所示。
)为原料冶炼钨的流程如图所示。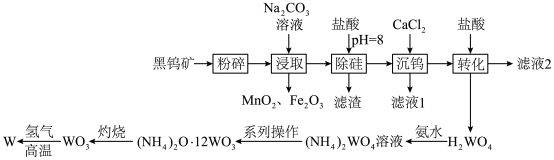
请回答下列问题:
(1)基态
 核外电子占据能量最高的能级符号是
核外电子占据能量最高的能级符号是(2)“粉碎”的目的是
 的操作方法是
的操作方法是(3)根据“转化”,判断
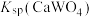
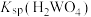 (填“>”或“<”)。
(填“>”或“<”)。(4)“灼烧”中盛装固体的仪器是
(5)碳化钨是一种耐磨、耐高温、高硬度材料。碳化钨晶胞如图所示。已知:晶胞底边长为apm,高为bpm,
 为阿伏加德罗常数的值。碳化钨晶体密度为
为阿伏加德罗常数的值。碳化钨晶体密度为 (列出计算式即可)。
(列出计算式即可)。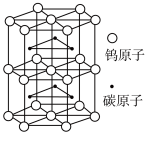
您最近一年使用:0次
2024-05-11更新
|
64次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷
解题方法
5 . 尿素还原法合成溴化锂,设备简单、产品质量好、无有毒气体排放、生产成本低。下图是制备无水溴化锂的工艺路线:
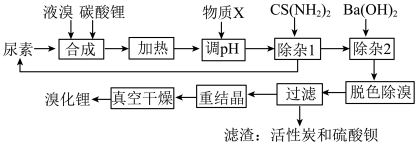
回答下列问题:
(1)Br位于周期表第________ 周期________ 族。
(2)常用焰色试验鉴别碳酸锂,火焰呈现________ 色。
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因________ 。
(4)合成溴化锂的主要化学方程式________ 。
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为________ 。
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是________ 。
(7)重结晶的操作为________ 。

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
碳酸锂溶解度(g) | 1.51 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)Br位于周期表第
(2)常用焰色试验鉴别碳酸锂,火焰呈现
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因
(4)合成溴化锂的主要化学方程式
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是
(7)重结晶的操作为
您最近一年使用:0次
2024-04-02更新
|
330次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
解题方法
6 . 一种超导材料(仅由 、
、 、F三种元素组成)的长方体晶胞结构如图所示(已知
、F三种元素组成)的长方体晶胞结构如图所示(已知 ),下列说法错误的是
),下列说法错误的是
 、
、 、F三种元素组成)的长方体晶胞结构如图所示(已知
、F三种元素组成)的长方体晶胞结构如图所示(已知 ),下列说法错误的是
),下列说法错误的是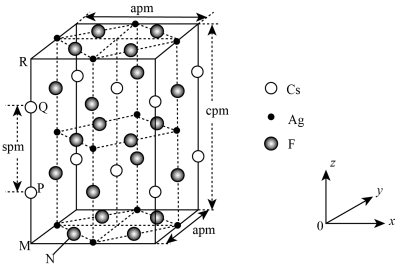
A.基态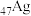 位于元素周期表的 位于元素周期表的 区 区 |
B.若N点原子分数坐标为 ,则P点原子分数坐标为 ,则P点原子分数坐标为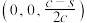 |
C.M、N之间的距离为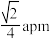 |
D.该晶体最简化学式为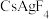 |
您最近一年使用:0次
2024-04-01更新
|
376次组卷
|
4卷引用:2024届湖南省岳阳市高三下学期第二次教学质量监测(二模)化学试题
2024届湖南省岳阳市高三下学期第二次教学质量监测(二模)化学试题(已下线)提升练01 晶体结构及相关计算-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题10?晶体结构及相关计算(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)广西钦州市第四中学2023-2024学年高二下学期3月考试化学试卷
7 . 固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是
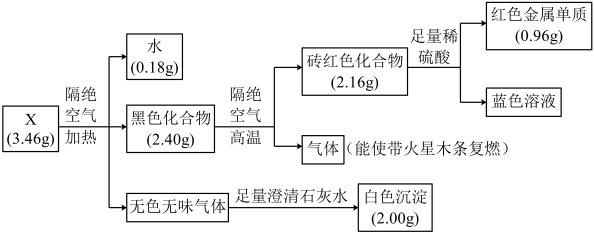
| A.固体化合物X中的金属元素位于周期表第四周期第ⅠB族 |
| B.固体化合物X为Cu2(OH)2CO3 |
| C.黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 |
| D.蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体 |
您最近一年使用:0次
名校
解题方法
8 . 甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊的最高价氧化物对应的水化物为强酸。下列说法不正确 的是
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A.原子半径:丁>戊>乙 |
| B.乙的简单氢化物的沸点一定高于戊的简单氢化物的沸点 |
| C.甲的简单氢化物遇氯化氢一定有白烟产生 |
| D.丙的最高价氧化物对应的水化物一定能与强碱反应 |
您最近一年使用:0次
名校
解题方法
9 . 氧族元素Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
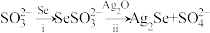
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表___________ 区。
②SeSO 的空间结构是
的空间结构是___________ 。
③过程ii中SeSO 一定断裂的化学键是
一定断裂的化学键是___________ 。
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由___________ 。
②NH 中H—N—H键角
中H—N—H键角___________ (填“>”或“<”)NH3中H—N—H键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为___________ g·cm-3。(1nm=10-7cm)
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。
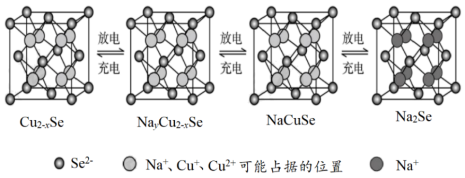
每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为___________ 。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO
 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下: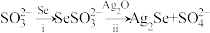
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表
②SeSO
 的空间结构是
的空间结构是③过程ii中SeSO
 一定断裂的化学键是
一定断裂的化学键是(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由
②NH
 中H—N—H键角
中H—N—H键角③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。

每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为
您最近一年使用:0次
2024-02-23更新
|
428次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三下学期开学考化学试题
名校
解题方法
10 . 回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,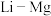 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
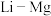 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次