1 . X、Y、Z、R是短周期主族元素,X原子最外层电子数为电子总数的2/3,Y原子最外层电子数是内层电子数的3倍, Z元素的单质常温下能与水反应产生氢气,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
| A.原子半径的大小顺序:X>Y>Z>R |
| B.最高价氧化物的水化物的酸性:R>X |
| C.氢化物的稳定性:X>Y |
| D.Y与Z形成的两种化合物中的化学键和晶体类型均相同 |
您最近一年使用:0次
名校
解题方法
2 . 短周期元素X、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是
| X | Y | ||
| Z | W | Q |
| A.X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1∶2 |
| B.含X和Z元素的常见化合物为离子化合物 |
| C.氧化物对应的水化物酸性:W<Q |
| D.原子半径大小关系:Q>W>Z>Y |
您最近一年使用:0次
2017-04-22更新
|
453次组卷
|
2卷引用:河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题
名校
3 . 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下说法正确的是
元素符号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A.L2+与R2-的核外电子数相等 |
| B.M与L形成的最高价氧化物对应水化物的碱性:L>M |
| C.氢化物的稳定性为H2T<H2R |
| D.单质与等浓度的稀盐酸反应的速率为Q>L |
您最近一年使用:0次
2017-04-21更新
|
824次组卷
|
5卷引用:河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题
河北省定州中学2017届高三(高补班)下学期第二次月考(4月)化学试题【全国百强校】黑龙江省鹤岗市第一中学2019届高三上学期第一次月考化学试题(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练2016-2017学年浙江省温州市“十五校联合体”高二下学期期中联考化学试卷
4 . 铅及并化合物在工业生产中具有非常广泛的用途,根据以下流程回答相关问题。
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第___ 周期__ 族。
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是_______ 。途径I中不用14 mol·L-1的浓硝酸制备硝酸铅的原因是______________________ 。
(3)写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:_________ 。
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb • nH2O中n=______ 。
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为________________________________ 。
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=_______________________ 。
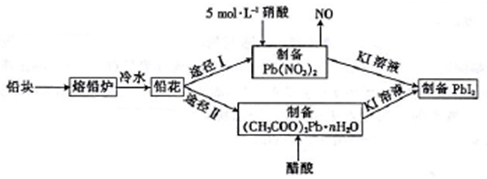
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是
(3)写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
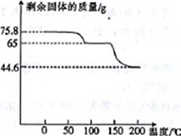
①(CH3COO)2Pb • nH2O中n=
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=
您最近一年使用:0次
2017-04-20更新
|
460次组卷
|
3卷引用:2017届湖南省郴州市高三第四次质量检测理科综合化学试卷
名校
5 . 部分短周期元素的性质或原子结构如下表所示。
下列叙述不正确的是
| 元素代号 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液显碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+ 7价 |
| A.原子半径:W>X>Y |
| B.化合物WY2不溶于水 |
| C.由X、Y和氢三种元素形成的所有化合物中只含共价键 |
| D.最高价氧化物对应水化物的酸性:W<Z |
您最近一年使用:0次
2017-04-20更新
|
798次组卷
|
7卷引用:2017届湖南省郴州市高三第四次质量检测理科综合化学试卷
名校
解题方法
6 . 过渡元素由于其特殊的核外电子排布而其有特殊的性质,成为化学研究的重点和前沿。
(l)过渡元素处于周期表的____ 区和f 区。
(2)过渡元素能形成简单化合物,还能形成多种配位化合物
① 通常,d轨道全空或全满的过渡金属离子与水分子形成的配合物无颜色,否则有颜色。如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+____ (填“有”或“无”)颜色。
② Ni2+可形成多种配合物,如Ni(CN)42-。写出CN-的电子式____ ,若其中两个CN-被NO2-替换,得到的配合物只有两种结构,则Ni(CN)42-的空间构型是_____ , NO2-的空间构型是_____ ,其中N原子的杂化方式是_____ 。
③ 从结构角度分析并比较CoF2与CoCl2晶体的熔点高低___________ 。
(3)金、铜等金属及合金可用作生产石墨烯的催化剂,下图是一种铜金合金的晶胞示意图:
① 在该铜金合金的晶体中,与Cu原子距离相等且最近的Au原子数为_______ 。
② 原子坐标参数是用来表示晶胞内部各原子相对位置的指标,若A的原子坐标参数为(0,0,0);B的原子坐标参数为(0,1,0) , C的原子坐标参数为(l,0,0)。则D的原子子坐标参数为_________ 。
③ 若Au、Cu原子半径分别为r1和r2,则该晶胞中的原子空间利用率为__________ 。
(l)过渡元素处于周期表的
(2)过渡元素能形成简单化合物,还能形成多种配位化合物
① 通常,d轨道全空或全满的过渡金属离子与水分子形成的配合物无颜色,否则有颜色。如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+
② Ni2+可形成多种配合物,如Ni(CN)42-。写出CN-的电子式
③ 从结构角度分析并比较CoF2与CoCl2晶体的熔点高低
(3)金、铜等金属及合金可用作生产石墨烯的催化剂,下图是一种铜金合金的晶胞示意图:
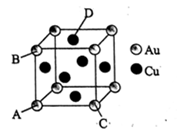
① 在该铜金合金的晶体中,与Cu原子距离相等且最近的Au原子数为
② 原子坐标参数是用来表示晶胞内部各原子相对位置的指标,若A的原子坐标参数为(0,0,0);B的原子坐标参数为(0,1,0) , C的原子坐标参数为(l,0,0)。则D的原子子坐标参数为
③ 若Au、Cu原子半径分别为r1和r2,则该晶胞中的原子空间利用率为
您最近一年使用:0次
2017-04-15更新
|
1007次组卷
|
3卷引用:2017届云南省高三第二次毕业生复习统一检测理综化学试卷
解题方法
7 . 短周期元素X、Y、Z、M在周期表中所处的位置如右图所示,四种元素原子的质子数之和为36。下列说法不正确的是
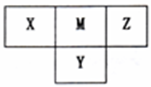
A.X与Z形成的三原子分子的电子式为 |
| B.简单氢化物稳定性Z>M>Y |
| C.X、Y、M分别与Z可形成多种二元共价化合物 |
| D.最高价氧化物的水化物的酸性M>Y>X |
您最近一年使用:0次
8 . Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色,Q元素的原子最外层电子数是其内层电子数的2倍,W、Z原子最外层电子数相同,Z的核电荷数是W的2倍,元素Y的合金是日常生活中使用最广泛的金属材料之一、下列说法正确的是
| A.简单离子半径的大小顺序:rX>rY>rZ>rW |
| B.元素Q和Z能形成QZ2型的共价化合物 |
| C.Z元素氢化物的沸点高于W元素氢化物的沸点 |
| D.X、Y、Z最高价氧化物的水化物之间两两不能发生反应 |
您最近一年使用:0次
9 . 镁、钡是位于同一主族的活泼的金属元素。
回答下列问题:
(1)镁在元素周期表中的位置是:______________ ;钡位于周期表第六周期,钡原子最外层电子的电子排布式是:________ 。
(2)铝也是一种活泼金属,铝的金属性比钡的_____ (填“强”或“弱”)。工业上可用如下方法制取钡:2Al+4BaO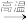 3Ba↑+BaO·Al2O3,该法制钡的主要原因是
3Ba↑+BaO·Al2O3,该法制钡的主要原因是______ (选填选项)
a.高温时Al的活泼性大于Ba b.高温时BaO·Al2O3比Al2O3稳定
c.Ba的沸点比Al的低 d.高温有利于BaO分解
两个烧杯分别盛有VmL、c mol/L的Ba(OH)2溶液,分别向其中滴入c mol/L的H2SO4 和NaHSO4溶液,两烧杯中溶液导电能力随滴入溶液体积的变化分别如下图中①、②所示。
(3)写出Ba(OH)2溶液与H2SO4恰好反应的离子方程式:___________ 。
(4)写出b点溶液中大量存在的阴离子的电子式:_________ 。
(5)a、b、c、d点溶液呈中性的是____________________ 。
回答下列问题:
(1)镁在元素周期表中的位置是:
(2)铝也是一种活泼金属,铝的金属性比钡的
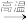 3Ba↑+BaO·Al2O3,该法制钡的主要原因是
3Ba↑+BaO·Al2O3,该法制钡的主要原因是a.高温时Al的活泼性大于Ba b.高温时BaO·Al2O3比Al2O3稳定
c.Ba的沸点比Al的低 d.高温有利于BaO分解
两个烧杯分别盛有VmL、c mol/L的Ba(OH)2溶液,分别向其中滴入c mol/L的H2SO4 和NaHSO4溶液,两烧杯中溶液导电能力随滴入溶液体积的变化分别如下图中①、②所示。
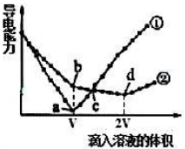
(3)写出Ba(OH)2溶液与H2SO4恰好反应的离子方程式:
(4)写出b点溶液中大量存在的阴离子的电子式:
(5)a、b、c、d点溶液呈中性的是
您最近一年使用:0次
10 . X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
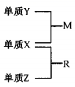
| A.X元素位于周期表中第16列 |
| B.X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物 |
| C.X、Y、Z元素形成的单质均具有强还原性 |
| D.R的沸点高于M的沸点 |
您最近一年使用:0次
2017-03-31更新
|
1387次组卷
|
4卷引用:2017届河南省郑州、平顶山、濮阳市高三第二次质量预测(二模)理综化学试卷



