名校
1 . 硒的原子序数为34,是硫的同主族元素,硒的单质及其化合物用途非常广泛。
(1)硒位于周期表第___ ,周期___ 族。Se2Cl2常用作分析试剂,其电子式为_____ 。
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是_____ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___ 。用氨水中和亚硒酸后得到亚硒酸铵,再向( NH4)2SeO3溶液中加入Na2S2O3可得到纳米硒,同时生成亚硫酸盐,(NH4)2SeO3与Na2S2O3反应生成纳米硒的离子方程式为______ 。
(1)硒位于周期表第
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为
您最近一年使用:0次
2017-10-30更新
|
892次组卷
|
2卷引用:【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一下学期第一次月考化学试题
名校
解题方法
2 . 根据信息回答以下与金属元素相关的问题。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为__________ 。锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_____________ 。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是__________ 。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为___________ , Z的电子式为_____________________ 。
II. KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为_________________ 。此过程不用瓷坩埚的原因是_________________________ 。
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为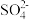 ),写出检验Mn2+的离子方程式
),写出检验Mn2+的离子方程式_________________ 。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为
II. KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为
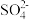 ),写出检验Mn2+的离子方程式
),写出检验Mn2+的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
上述科学家的研究按照时间先后排序合理的是__________ (填数字序号)。
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
(1)门捷列夫将已有元素按照相对原子质量排序,同一__________ (填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是__________ ,第5列方框中“Te=128?”的问号表达的含义是__________ 。
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是__________ (填字母序号)。
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为__________ ,元素Z的离子结构示意图为__________ 。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为__________ 。
(3)元素W位于周期表的第__________ 族,其非金属性比元素R弱,用原子结构的知识解释原因____________________ 。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式____________________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________________ 。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
| Ni=Co=59 | |||||
| H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
| Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
| B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
| C=12 | Si=28 | ?=70 | Sn=118 | ||
| N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
| O=16 | S=32 | Se=79.4 | Te=128? | ||
| F=19 | Cl=35.5 | Br=80 | I=127 | ||
| Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
| Ca=40 | Pb=207 |
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为
(3)元素W位于周期表的第
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
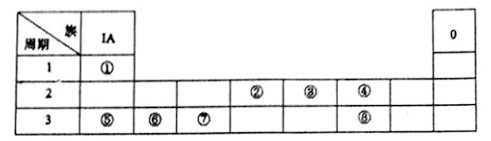
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是_______ (用化学式表示,下同);碱性最强的是_______ 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序是_______ (用离子符号表示)
(3)有两种离子化合物,均由①、④、⑤、⑧四种元素组成.这两种物质可在水溶液中发生反应。写山该反应的离子方程式:_______________ 。
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)__________________ ;_____________ 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
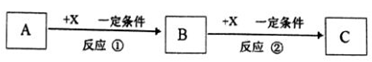
若A、B、C含同一金属元素,X为强电解质.且反应都在溶液中进行,则B的化学式为_____ ,X的化学式可能为______ 或______ (写不同类别物质)。

(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是
(2)④、⑤、⑥的简单离子半径由大到小的顺序是
(3)有两种离子化合物,均由①、④、⑤、⑧四种元素组成.这两种物质可在水溶液中发生反应。写山该反应的离子方程式:
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为强电解质.且反应都在溶液中进行,则B的化学式为
您最近一年使用:0次
5 . 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
| W | X | |||
| Y | Z |
| A.氢化物沸点:W < Z | B.氧化物对应水化物的酸性:Y > W |
| C.化合物熔点:Y2X3 < YZ3 | D.简单离子的半径:Y < X |
您最近一年使用:0次
2017-08-08更新
|
10749次组卷
|
52卷引用:广西柳州市城中区第二中学2016-2017学年高一下学期期末考试化学试题
广西柳州市城中区第二中学2016-2017学年高一下学期期末考试化学试题2017-2018学年人教版高中化学必修2单元测试题 第1章 物质结构 元素周期律(已下线)狂刷05 元素周期表和元素周期律的应用—《小题狂刷》2017-2018学年高一化学人教必修2陕西省西安市铁一中2017-2018学年高一下学期期中考试化学试题【全国百强校】四川省雅安中学2018-2019学年高一上学期开学考试化学试题吉林省长春市德惠市实验中学2018-2019学年高一下学期期初检测化学试题【全国百强校】江西省南昌市第二中学2018-2019学年高一下学期第二次月考化学试题步步为赢 高一化学暑假作业:作业十九 综合评估黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期线上考试化学试题安徽省安庆市第一中学2019-2020学年高一下学期月考化学试题(已下线)5.1.1 元素周期律练习(1)——《高中新教材同步备课》(苏教版 必修第一册)苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册 第四章素养检测安徽省霍邱县第二中学2019-2020学年高一下学期段考化学试题安徽省阜阳市第十一中学2019-2020学年高一下学期期中考试化学试题(已下线)第4章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)专题5 第一单元综合拔高练-高中化学苏教2019版必修第一册(已下线)【浙江新东方】双师208高一下河南省南阳市第一中学校2021-2022学年高一下学期第三次月考化学试题第四章 物质结构 元素周期律 本章复习提升(已下线)4.2元素周期律-同步学习必备知识四川省广元市八二一中学2021-2022学年高一下学期期中考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)四川省双流中学2017-2018学年高二上学期开学考试化学试题四川省新津中学2018届高三上学期入学考试化学试题黑龙江省哈尔滨市第十八中学2018届高三第一次月考化学试题河南省林州市第一中学2018届高三10月调研化学试题(已下线)《考前20天终极攻略》-5月19日 物质结构 元素周期律(已下线)解密07 物质结构和元素周期律(教师版)——备战2018年高考化学之高频考点解密【全国百强校】四川省雅安市雅安中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)【全国百强校】江西省南昌市第十中学2019届高三上学期期末考试理科综合化学试题(已下线)考点07 元素周期律和元素周期表——备战2019年浙江新高考化学考点百所名校联考-物质结构 元素周期律四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训湖南长沙长郡中学2020届高三2月份网络教学质量监测卷理综化学试题四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题黑龙江省大庆市第四中学2019-2020学年高二下学期第一次月考化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二上学期开学考试化学试题(已下线)福建省泉州市泉港区第一中学2018-2019学年高二年级下学期期中考化学试题云南省保山第九中学2021届高三上学期开学考试化学试题(已下线)小题13 元素周期表、律(根据元素周期表片段推断) ——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)四川省汉源县第二中学2019-2020学年高二下学期第二次月考化学试题宁夏银川市第六中学2021-2022学年高三上学期第一次月考(9月)化学试题云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)新疆维吾尔自治区喀什市喀什第二中学2022-2023学年高三上学期网上11月月考化学试题(已下线)题型76 通过元素周期表考查元素周期律四川省仁寿第一中学校南校区2022—2023学年高二下学期3月月考化学试题
6 . 短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其 内层电子数的2倍,Y是地壳中含量最高的元素,W2+与Y2-具有相同的电子层结构,W与 X同主族。下列说法正确的是
| A.Y的气态简单氢化物的热稳定性比W的强 |
| B.Y分别与Z、W形成的化合物中化学键类型相同 |
| C.X的最高价氧化物对应的水化物的酸性比W的弱 |
| D.原子半径的大小顺序:K(W) > r(Z) > r(Y) > r(X) |
您最近一年使用:0次
7 . X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如下图。下列说法正确的是
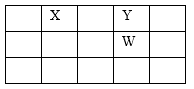

| A.五种元素中,原子半径最大的是W |
| B.Y与Z形成的化合物均为碱性氧化物 |
| C.Y、Q、W形成的气态氢化物中,沸点最高的是H2Y |
| D.Z与Q形成的化合物水溶液一定显酸性 |
您最近一年使用:0次
名校
8 . 有aW、bX、cY、dZ四种短周期元素,已知d﹣c=c﹣b=b﹣a=5,且W、X、Y的最外层电子数总和大于Z的最外层电子数.下列说法不正确的是( )
| A.W元素的单质常温下是气体 |
| B.X是蛋白质的组成元素之一 |
C.Y元素的单质能与冷水发生剧烈反应 |
| D.Z元素的气态氢化物的水溶液呈酸性 |
您最近一年使用:0次
2017-07-18更新
|
803次组卷
|
3卷引用:湖南省永州市2016-2017学年高一下学期期末考试化学试题
名校
9 . 已知S和Cl两种元素均位于第三周期,则:
| A.原子半径:S < Cl | B.元素的非金属性S > Cl |
| C.氢化物的稳定性:H2S > HCl | D.最高价氧化物对应水化物的酸性:H2SO4 < HClO4 |
您最近一年使用:0次
2017-07-18更新
|
395次组卷
|
4卷引用:海南省文昌中学2016-2017学年高一下学期期末考试(文)化学试题
名校
10 . 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
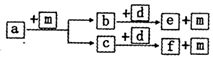

| A.原子半径:W<X<Y<Z |
| B.阴离子的还原性:Y>W |
| C.a—定由W、X两种元素组成 |
| D.图中转化过程d物质在作为反应物时均即为氧化剂又是还原剂 |
您最近一年使用:0次
2017-07-15更新
|
1867次组卷
|
6卷引用:河南省洛阳市2016-2017学年高一下学期期末考试化学试题



