名校
1 . 几种短周期元素的原子半径及主要化合价见下表:
下列叙述正确的是 ( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、 -2 | +2 | -2 | +1 |
| A.K、L、M三元素的金属性逐渐增强 |
| B.在化合物NCl中,各原子均满足最外层8电子的稳定结构 |
| C.Q元素的最高价氧化物为电解质,其水溶液能够导电 |
| D.K在T单质中燃烧所形成的化合物中含有共价键和离子键 |
您最近一年使用:0次
2017-05-13更新
|
394次组卷
|
2卷引用:山东省济南市第一中学2016-2017学年高一下学期期中考试化学试题
解题方法
2 . 下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:
Ⅰ.填写下列空白:
(1)非金属性最强的元素是___________ (填元素符号),
(2)写出①与③形成原子个数比为1:1化合物的电子式:____________ ,该化合物酸性条件下与高锰酸钾反应的离子方程式:__________________________
(3)最高价氧化物对应的水化物中碱性最强的是_______ (填化学式),写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:____________ 。
(4)由①②③⑩四种元素中的三种组成的一种强酸,该强酸的稀溶液与铜反应的离子方程式____________________________
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂,X是一种氢化物,常温下为液体。则:
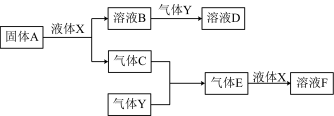
(1)A与液体X反应的化学方程式:____________________________ ;
(2)气体Y是一种大气污染物,无色、有刺激性气味的气体,直接排放会形成酸雨。写出气体Y与氯水反应的离子方程式:___________________________ ;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2 L(标况下),则反应过程中转移的电子数为__________ (用“NA”表示)
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
(1)非金属性最强的元素是
(2)写出①与③形成原子个数比为1:1化合物的电子式:
(3)最高价氧化物对应的水化物中碱性最强的是
(4)由①②③⑩四种元素中的三种组成的一种强酸,该强酸的稀溶液与铜反应的离子方程式
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂,X是一种氢化物,常温下为液体。则:

(1)A与液体X反应的化学方程式:
(2)气体Y是一种大气污染物,无色、有刺激性气味的气体,直接排放会形成酸雨。写出气体Y与氯水反应的离子方程式:
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2 L(标况下),则反应过程中转移的电子数为
您最近一年使用:0次
名校
3 . 从下列事实所得出的相应结论正确的是
实验事实 | 结论 | |
| A | A元素的原子半径比B元素的原子半径大 | 元素A位于B的下一周期 |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 常温下,铜能与浓硝酸反应而铝遇浓硝酸钝化 | 还原性:Cu>Al |
| D | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-05-11更新
|
201次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2016-2017学年高一下学期期中考试化学试题
名校
解题方法
4 . 有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:
对应表中内容,下列叙述中正确的是
| ① | He -268.8 | Ne -249.5 | (a) -185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
| A.系列①物质均为非金属单质,都含有共价键 |
| B.系列②物质的沸点逐渐升高是因为共价键越来越牢固 |
| C.系列③物质的还原性依次减弱 |
| D.系列④中各化合物的热稳定性从左到右逐渐减弱 |
您最近一年使用:0次
2017-05-10更新
|
435次组卷
|
2卷引用:辽宁省鞍山市第一中学2016-2017学年高一下学期期中考试化学试题
名校
解题方法
5 . 元素①~⑧在元素周期表中的位置如下,回答有关问题:
(1)某元素是①~⑧外的元素,其最外层电子数是次外层电子数的 ,在地壳中含量仅次于氧元素,则该元素在周期表的位置
,在地壳中含量仅次于氧元素,则该元素在周期表的位置_______________ ;
(2)元素①~⑧化学性质最稳定的元素是________ (填数字), 写出该元素含有22个中子的核素的化学符号________
(3)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为_______________ (用化学式表示,下同),②③⑥元素氢化物的稳定性最强的是________ (填化学式)。
(4)比较④_________ ⑧的金属性(填“>”或“<”),能说明这一结论的依据有________
A.单质的熔点大小 B.最高价氧化物水化物的碱性强弱
C.单质的密度大小 D.单质与水反应的剧烈程度
(5)能体现②⑥元素非金属性强弱的化学方程式_______________________________ 。
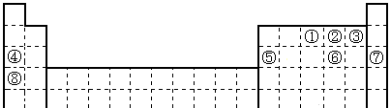
(1)某元素是①~⑧外的元素,其最外层电子数是次外层电子数的
 ,在地壳中含量仅次于氧元素,则该元素在周期表的位置
,在地壳中含量仅次于氧元素,则该元素在周期表的位置(2)元素①~⑧化学性质最稳定的元素是
(3)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为
(4)比较④
A.单质的熔点大小 B.最高价氧化物水化物的碱性强弱
C.单质的密度大小 D.单质与水反应的剧烈程度
(5)能体现②⑥元素非金属性强弱的化学方程式
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)元素名称:A___ 、B___ 、C___ 、D___
(2)D元素的最高价氧化物的水化物是(化学式)__________ ,A、B两元素形成化合物属 _______ (选填“离子”或“共价”)化合物。
(3)写出A、B的化合物与E反应的化学方程式:____________________ 。
(1)元素名称:A
(2)D元素的最高价氧化物的水化物是(化学式)
(3)写出A、B的化合物与E反应的化学方程式:
您最近一年使用:0次
名校
7 . 短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍。下列说法正确的是
| Y | Z | ||
| X | W |
| A.X的最高价氧化物是碱性氧化物 |
| B.Z、W均可与Mg形成离子化合物. |
| C.原子半径的大小顺序:r(Z)>r(Y)>r(X) |
| D.Y、Z、W的氧化物排放到空气中均会导致酸雨 |
您最近一年使用:0次
2017-05-03更新
|
385次组卷
|
3卷引用:江苏省宿迁市名校2016-2017学年高一下学期期中考试化学试题
名校
解题方法
8 . 下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素是______ 。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______ (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________ 。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___ 。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____ 。(填化学式)
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是
(2)②③④三种元素的原子半径从大到小的顺序是
(3)用电子式表示③与⑦形成化合物的过程
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的
(5)在⑦与⑩的单质中,化学性质较活泼的是
您最近一年使用:0次
2017-04-27更新
|
340次组卷
|
3卷引用:广东省仲元中学2016-2017学年高一下学期期中考试(理)化学试题
9 . 下表为元素周期表的一部分,请用化学用语回答有关问题:
(1)①和⑧的元素符号是______ 和______ ;
(2)元素⑥形成的氢化物的电子式是______ ;
(3)表中能形成两性氢氧化物的元素是______ (填写元素符号),请写出该元素的氢氧化物与⑨最高价氧化物对应的水化物发生反应的化学方程式_______________________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和⑧的元素符号是
(2)元素⑥形成的氢化物的电子式是
(3)表中能形成两性氢氧化物的元素是
您最近一年使用:0次
10 . 短周期主族元素 A、B、C、D、E、F 的原子序数依次增大,A 原子核外最外 层电子数是其电子层数的 2 倍,A、B 的核电荷数之比为 3:4。C 与 D 均为金属元素,5.8 g D 的氢氧化物恰好能与 100 mL 2 mol·L-1 盐酸完全反应,D 原子核中质子数和中子数相等。E 与F 相邻,F-的最外层为 8 电子结构。根据上述条件,用化.学.用.语.回答:
(1)D 在周期表中的位置____ ;
(2)B、C 易形成淡黄色化合物,其电子式为____ ,该物质含有的化学键 类型为_____ ;
(3)用电子式表示 DF2 的形成过程____ ;
(4)元素 E、F 中非金属性较强的是____ ,请用一个置换反应证明____ (写化学反应方程式);
(5)原子半径:C____ E;熔点:DB____ CF(填“>”“<”或“=”);
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为____ ;含 A元素的化合物在是自然界种类最多的原因是____ 。
(1)D 在周期表中的位置
(2)B、C 易形成淡黄色化合物,其电子式为
(3)用电子式表示 DF2 的形成过程
(4)元素 E、F 中非金属性较强的是
(5)原子半径:C
(6)A、B、E 可形成一个三原子分子,且每个原子均达到 8 电子稳定结构,则该分子的 结构式为
您最近一年使用:0次



