名校
1 . 下列说法正确的是
| A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6 |
| B.所有的非金属元素都分布在p区 |
| C.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子的化学性质相似 |
| D.元素周期表中ⅢB到ⅡB的10个纵行的元素都是金属,所以统称过渡金属元素 |
您最近一年使用:0次
2017-11-01更新
|
1501次组卷
|
5卷引用:第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)
(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期末考试化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题
2 . 下列说法不正确 的是
| A.某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族 |
| B.在元素周期表中,s区,d区和ds区的元素都是金属元素 |
C.当碳原子的核外电子排布由 转变为 转变为 时,释放能量,由激发态转化成基态 时,释放能量,由激发态转化成基态 |
| D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8 |
您最近一年使用:0次
2017-05-05更新
|
2901次组卷
|
10卷引用:第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)
(已下线)第一章 原子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题新疆维吾尔自治区伊犁哈萨克自治州奎屯市第一高级中学2019-2020学年高二期末考试试题湖北省石首市第一中学2019-2020学年高二下学期摸底考试化学试题广东省东莞市东华高级中学2021-2022学年高二下学期月考化学试题山东省德州一中2021届高三10月月考化学试题(已下线)第30讲 原子结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
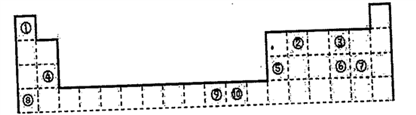
3 . 下表为长式周期表的一部分,其中的编号代表对应的元素。
(1)写出元素⑤的原子轨道表示式______________ 。
(2)写出元素⑨的基态原子的价电子排布式_________ 。
(3)表中属于ds区的元素是_________ (填编号)
(4)元素⑩形成的单质是由____ 键形成的晶体,该晶体采取的堆积方式是_______ ,晶体中⑩元素原子的配位数是_________ 。
(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是_______ (用离子符号表示)
(6)写出元素①和元素⑧形成化合物的电子式_________________ 。
(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mol,I⑩=1959kJ/mol,第二电离能I⑨⑩的原因是____________________________ 。
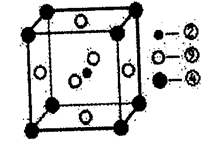
(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______ (用对应的元素符号表示)。
(1)写出元素⑤的原子轨道表示式
(2)写出元素⑨的基态原子的价电子排布式
(3)表中属于ds区的元素是
(4)元素⑩形成的单质是由
(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是
(6)写出元素①和元素⑧形成化合物的电子式
(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mol,I⑩=1959kJ/mol,第二电离能I⑨⑩的原因是
(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
您最近一年使用:0次
2017-04-26更新
|
363次组卷
|
2卷引用:人教版高中化学选修3第三章《晶体结构与性质》测试题1
4 . 铋元素可表示为 83Bi,在元素周期表中相对原子质量表示为209.0,下列说法正确的是
| A.Bi元素的质量数是209 |
| B.Bi元素最高价氧化物的化学式为Bi2O3 |
| C.Bi原子最高价氧化物的水化物酸性比硝酸的要强 |
| D.Bi元素位于元素周期表第六周期第ⅤA族 |
您最近一年使用:0次
2017-04-07更新
|
597次组卷
|
2卷引用:人教版高中化学选修3第一章《原子结构与性质》测试题
5 . X、Y、Z是一种短周期元素,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
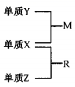
| A.X元素位于周期表中第16列 |
| B.X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物 |
| C.X、Y、Z元素形成的单质均具有强还原性 |
| D.R的沸点高于M的沸点 |
您最近一年使用:0次
2017-03-31更新
|
1387次组卷
|
4卷引用:人教版高中化学选修3第二章《分子结构与性质》测试题2
6 . 下列有关叙述中正确的是
| A.液态氟化氢分子间存在氢键,所以其分子比氯化氢更稳定 |
| B.由碳氮原子形成的化合物比金刚石坚硬,其主要原因是碳氮键比碳碳键的键长更短 |
| C.S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物 |
| D.若ⅡA族某元素的原子序数为m,则同周期ⅢA族元素的原子序数为m+10 |
您最近一年使用:0次
名校
7 . 元素周期表的第7周期称为不定全周期,若将来发现的元素把第7周期全排满,则下列推论错误的可能性最大的是
| A.该周期有32种元素 | B.该周期的元素,原子序数最大为118 |
| C.该周期的ⅦA族元素是金属元素 | D.该周期的ⅢA族的元素的氢氧化物具有两性 |
您最近一年使用:0次
2017-03-13更新
|
173次组卷
|
2卷引用:上海市高二上学期第二章《初识元素周期律》综合测试题
名校
8 . 下列说法中正确的是
| A.s区、d区、ds区都是金属元素 | B.p区都是主族元素 |
| C.所有族中IIIB中元素种类最多 | D.最外层电子数为2的元素都分布在s区 |
您最近一年使用:0次
2016-12-09更新
|
607次组卷
|
8卷引用:人教版高中化学选修3第一章《原子结构与性质》测试题
9 . 2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是
| A.Ds原子的电子层数为7 | B.Ds是超铀元素 |
| C.Ds原子的质量数为110 | D.Ds为金属元素 |
您最近一年使用:0次
2016-12-09更新
|
338次组卷
|
8卷引用:选修三物质结构与性质复习单元测试
名校
解题方法
10 . 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

(1)上述元素的单质可能是电的良导体的是_______ (填字母代号)。
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:______________________________________ 。
②表中的Y可能为以上13种元素中的_________ (填元素符号)元素,用元素符号表示X和j按原子个数1:1形成化合物的电子式___________________________ 。
(3)根据构造原理,用电子排布式表示e的核外电子排布式_______________ 。
(4)以上13种元素中,________ (填元素符号)元素原子失去核外第一个电子需要的能量最多。
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为_______ (用化学符号作答)。f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式___________________ 。

(1)上述元素的单质可能是电的良导体的是
(2)下表是一些气态原子的第一、二、三、四级电离能(kJ·mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中的Y可能为以上13种元素中的
(3)根据构造原理,用电子排布式表示e的核外电子排布式
(4)以上13种元素中,
(5)a、e、f三种元素的最高价氧化物的水化物显碱性,其碱性最强的为
您最近一年使用:0次
2016-12-09更新
|
252次组卷
|
4卷引用:第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)
(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)2015-2016学年西藏日喀则一中高二10月月考化学试卷河南省漯河市南街高中2018-2019学年高二下学期期中考试化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测



