解题方法
1 . 我国科学家发现某化合物(如图所示)可用于制造大功率固体激光器,填补国家空白。已知X、Y、Z、W为前20号元素且位于不同周期,原子序数依次递增,Y为地壳中含量最多的元素。下列有关说法正确的是


A.原子半径: |
| B.该化合物易溶于水且水溶液显碱性 |
| C.Z的最高价氧化物对应的水化物为强酸 |
D.单质的氧化性: ,单质的还原性: ,单质的还原性: |
您最近一年使用:0次
19-20高一下·北京海淀·期末
名校
2 . X、Y、Z、R、W为常见的主族元素,根据下表信息回答问题:
(1)写出元素X的原子结构示意图_____ ;元素W在周期表中位置_____ 。
(2)Y、Z最高价氧化物对应水化物的碱性强弱比较_____ >_____ (填化学式)。
(3)用电子式表示X和R形成化合物的过程:_____ 。
(4)下列对于W及其化合物的推断中,正确的是_____ (填序号)。
①W的最低负化合价与R的最低负化合价相同
②W的氢化物的稳定性弱于R的氢化物的稳定性
③W的单质可与X和R形成的化合物的水溶液发生置换反应
④W的最高价氧化物对应水化物的酸性比R的强
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:

①A中发生的反应的离子方程式是_____ 。
②棉花中浸有的NaOH溶液的作用是_____ (用离子方程式表示)。
③为验证Br2与I2的氧化性强弱:通入一定量R的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到_____ 。该实验必须控制加入的R单质的量,否则得不出Br2的氧化性比I2强。理由是______ 。
④从原子结构的角度解释卤族元素单质氧化性逐渐减弱的原因:______ 。
| 元素 | 元素性质或原子结构信息 |
| X | 短周期元素原子半径最大(稀有气体元素不参与比较) |
| Y | +3价阳离子的核外电子排布与氖原子相同 |
| Z | 原子核外M电子层与K电子层的电子数相等 |
| R | 与Z同周期,主要化合价为−1、+7 |
| W | 原子结构示意图: |
(1)写出元素X的原子结构示意图
(2)Y、Z最高价氧化物对应水化物的碱性强弱比较
(3)用电子式表示X和R形成化合物的过程:
(4)下列对于W及其化合物的推断中,正确的是
①W的最低负化合价与R的最低负化合价相同
②W的氢化物的稳定性弱于R的氢化物的稳定性
③W的单质可与X和R形成的化合物的水溶液发生置换反应
④W的最高价氧化物对应水化物的酸性比R的强
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:

①A中发生的反应的离子方程式是
②棉花中浸有的NaOH溶液的作用是
③为验证Br2与I2的氧化性强弱:通入一定量R的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到
④从原子结构的角度解释卤族元素单质氧化性逐渐减弱的原因:
您最近一年使用:0次
3 . 下图为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
(1)由①和④组成的原子个数比为1∶1的化合物电子式为___________ 。
(2)④和⑦的简单离子还原性较强的是___________ 。
(3)常温下①和④组成的简单化合物呈液态而①和⑦组成的化合物呈气态的原因是___________ 。
(4)⑧组成的很多化合物均有强氧化性,其中 在酸性条件下和
在酸性条件下和 溶液反应的方程式如下,请配平该反应方程式:
溶液反应的方程式如下,请配平该反应方程式:_____ 
(5)将灼热②的单质伸入③的最高价氧化物的水化物的浓溶液中,生成的分别含②和含③的两种物质的物质的量之比为___________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)④和⑦的简单离子还原性较强的是
(3)常温下①和④组成的简单化合物呈液态而①和⑦组成的化合物呈气态的原因是
(4)⑧组成的很多化合物均有强氧化性,其中
 在酸性条件下和
在酸性条件下和 溶液反应的方程式如下,请配平该反应方程式:
溶液反应的方程式如下,请配平该反应方程式:
(5)将灼热②的单质伸入③的最高价氧化物的水化物的浓溶液中,生成的分别含②和含③的两种物质的物质的量之比为
您最近一年使用:0次
名校
4 . 下列结论错误的是( )
①微粒半径:K+>Al3+>S2->C1- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I- ④氧化性:C12>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
①微粒半径:K+>Al3+>S2->C1- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I- ④氧化性:C12>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有① | B.①③ | C.②④⑤⑥⑦ | D.①③⑤ |
您最近一年使用:0次
2019-06-17更新
|
673次组卷
|
11卷引用:2020届高三化学知识点强化训练-元素周期律
2020届高三化学知识点强化训练-元素周期律(已下线)2010-2011学年河南省郑州一中高一下学期期末考前模拟化学试题(已下线)2012-2013学年陕西省长安一中高一下学期期中考试化学试卷(已下线)2012-2013学年四川省成都外国语学校高一下学期期中考试化学试卷【全国百强校】山西大学附属中学2018-2019学年高一下学期3月模块诊断化学试题【全国百强校】山东省济南市外国语学校三箭分校2018-2019学年高一下学期期中考试化学试题新疆奎屯市第一高级中学2018-2019学年高一下学期第一次月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高一下学期第三次月考化学试题江西省上饶市上饶中学2019-2020学年高一上学期第二次月考化学(特零班)试题山东省新泰市第一中学2019-2020学年高一下学期阶段测试一化学试题四川省绵阳市南山中学2020-2021学年高一下学期6月月考化学试题
5 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作____ 极(填“阴”或“阳”)。
(2)硒在元素周期表中的位置如图所示:

Se原子结构示意图可表示为________ 。
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族________ 。
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
① 请写出CuSe与浓H2SO4反应的化学方程式________ 。
② 焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为_______ 。
③ 写出步骤ⅱ中的化学方程式_______ 。
(4)下列说法合理的是________ 。
a. SeO2既有氧化性又有还原性,其还原性比SO2强
b. 浓硒酸可能具有强氧化性、脱水性
c. 热稳定性:H2Se < HCl < H2S
d. 酸性:H2SeO4 < HBrO4 < HClO4
(1)粗铜精炼时,通常用精铜作
(2)硒在元素周期表中的位置如图所示:

Se原子结构示意图可表示为
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
① 请写出CuSe与浓H2SO4反应的化学方程式
② 焙烧过程产生的烟气中含有少量SeO2,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为
③ 写出步骤ⅱ中的化学方程式
(4)下列说法合理的是
a. SeO2既有氧化性又有还原性,其还原性比SO2强
b. 浓硒酸可能具有强氧化性、脱水性
c. 热稳定性:H2Se < HCl < H2S
d. 酸性:H2SeO4 < HBrO4 < HClO4
您最近一年使用:0次
名校
6 . 下列各组性质比较中,正确的是
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O
④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物沸点:HF>HCl
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O
④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物沸点:HF>HCl
| A.①②③ | B.①②⑤ | C.②③④ | D.①②④⑤ |
您最近一年使用:0次
2016-12-09更新
|
246次组卷
|
3卷引用:2017届浙江省温州中学高三3月高考模拟化学试卷
名校
7 . 下图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。请回答下列问题:
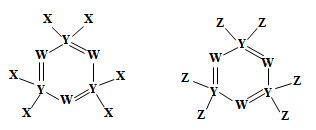
(1)元素Y在周期表中的位置为___________ ,元素Z的最高价氧化物的水化物的化学式为_____ 。
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为_____ 。
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为_____ 。
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
(5)许多含元素Z的化合物均可作为杀菌消毒剂,将ZO2通入到NaOH和H2O2混合溶液中,可制备NaZO2。
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式_____ 。
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,___________ ,___________ ,低于60℃干燥,得到NaZO2晶体 (补全实验步骤)。

(1)元素Y在周期表中的位置为
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
| A.比较其简单氢化物的沸点 | B.比较其单质与氢气反应的难易程度 |
| C.比较其简单阴离子的还原性 | D.比较其氧化物的水化物的酸性 |
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,
您最近一年使用:0次
名校
解题方法
8 . X、Y、Z、M四种短周期主族元素,原子序数依次增大。X元素的焰色试验呈黄色,Z是地壳中含量最多的金属元素,M原子最外层比次外层少一个电子。下列说法错误的是
| A.简单离子半径:M>Z>Y |
| B.最高价氧化物对应水化物的碱性:X>Y>Z |
| C.X、Z、M的最高价氧化物对应的水化物能相互反应 |
| D.M的单质及其正一价的含氧酸均具有强氧化性 |
您最近一年使用:0次
2023-05-05更新
|
681次组卷
|
5卷引用:青海省玉树州2023届高三下学期第三次联考理综化学试题
青海省玉树州2023届高三下学期第三次联考理综化学试题(已下线)专题07 元素周期表与元素周期律四川省绵阳中学2023-2024学年高三上期测试(三)理科综合试题(已下线)【知识图鉴】单元讲练测必修第一册第四单元02基础练海南省琼海市嘉积中学2022-2023学年高一下学期7月期末考试化学试题
名校
解题方法
9 . 下列性质的比较,强弱关系正确且能用元素周期律解释的是
A.酸性: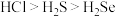 | B.碱性: |
C.还原性: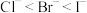 | D.沸点: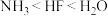 |
您最近一年使用:0次
2022-11-17更新
|
255次组卷
|
3卷引用:山东省泰安市2022-2023学年高三上学期11月期中化学试题
山东省泰安市2022-2023学年高三上学期11月期中化学试题(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)宁夏吴忠市吴忠中学2023-2024学年高二下学期第一次月考化学试卷
名校
解题方法
10 . X、Y、Z、W是不同周期的四种主族元素,原子序数依次递增。其中X与W同主族,与Y能形成两种液态化合物P、Q,P分解时吸热、Q分解时放热。Y、W的最外层电子之和等于Z的最外层电子。下列说法中正确的是
| A.P具有强还原性,Q具有强氧化性 |
B.元素的非金属性强弱顺序为: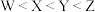 |
| C.W单质在空气中燃烧只生成碱性氧化物 |
| D.电解Z与W形成的化合物的溶液,可制得Z单质 |
您最近一年使用:0次



