22-23高一上·全国·课时练习
名校
1 . 图为元素周期表的一部分,请参照①~⑧在表中的位置,回答下列问题:

(1)②在周期表中的位置是___________ 。
(2)①~⑧中,化学性质最稳定的是___________ (填元素符号),非金属性最强的是___________ (填元素符号),最高价氧化物对应水化物酸性最强的是___________ (填化学式)。
(3)①~⑦中,原子半径最大的是___________ (填元素符号)。
(4)元素③的非金属性比⑥___________ (填“强”或“弱”),请从原子结构的角度解释:___________ ,列举一个化学事实加以说明___________ 。
(5)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。
工业制备镓的流程如下图所示:
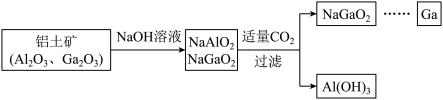
氧化镓与NaOH反应的化学方程式为___________ 。酸性:Al(OH)3___________ Ga(OH)3(填“>”或“<”),冶炼金属镓的方法是___________ (填序号)。
A.热还原法 B.热分解法 C.电解法

(1)②在周期表中的位置是
(2)①~⑧中,化学性质最稳定的是
(3)①~⑦中,原子半径最大的是
(4)元素③的非金属性比⑥
(5)镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。
工业制备镓的流程如下图所示:

氧化镓与NaOH反应的化学方程式为
A.热还原法 B.热分解法 C.电解法
您最近一年使用:0次
解题方法
2 .  、
、 、
、 、
、 、
、 、
、 分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中,
分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中, 的原子半径最小,
的原子半径最小, 与
与 的最外层电子数相等;
的最外层电子数相等; 的内层电子数是最外层电子数的一半;
的内层电子数是最外层电子数的一半; 的最高化合价和最低化合物的代数和为6;
的最高化合价和最低化合物的代数和为6; 和
和 可形成原子个数之比为
可形成原子个数之比为 和
和 的两种化合物;
的两种化合物; 、
、 、
、 三者的最高价氧化物对应的水化物两两之间能发生化学反应。请回答下列
三者的最高价氧化物对应的水化物两两之间能发生化学反应。请回答下列
问题:
(1) 元素在周期表中的位置是
元素在周期表中的位置是______ 。
(2) 、
、 、
、 三种元素的原子半径由小到大的顺序为
三种元素的原子半径由小到大的顺序为______ (填元素符号)。
(3) 、
、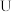 两元素最高价氧化物对应的水化物反应的化学方程式为
两元素最高价氧化物对应的水化物反应的化学方程式为________________ 。
(4)某同学用 、
、 两元素的单质反应生成固体物质
两元素的单质反应生成固体物质 ,
, 属于离子化合物,且能与化合物
属于离子化合物,且能与化合物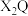 反应生成
反应生成 的单质。
的单质。
① 的电子式为
的电子式为______ ; 与
与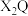 反应的化学方程式为
反应的化学方程式为__________________ 。
②该同学认为取 、
、 两元素的单质反应后的固体物质与
两元素的单质反应后的固体物质与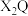 反应,若能产生
反应,若能产生 的单质,即可证明得到的固体物质一定是纯净的
的单质,即可证明得到的固体物质一定是纯净的 。请判断该方法是否合理并说明理由:
。请判断该方法是否合理并说明理由:______________________________ 。
 、
、 、
、 、
、 、
、 、
、 分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中,
分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中, 的原子半径最小,
的原子半径最小, 与
与 的最外层电子数相等;
的最外层电子数相等; 的内层电子数是最外层电子数的一半;
的内层电子数是最外层电子数的一半; 的最高化合价和最低化合物的代数和为6;
的最高化合价和最低化合物的代数和为6; 和
和 可形成原子个数之比为
可形成原子个数之比为 和
和 的两种化合物;
的两种化合物; 、
、 、
、 三者的最高价氧化物对应的水化物两两之间能发生化学反应。请回答下列
三者的最高价氧化物对应的水化物两两之间能发生化学反应。请回答下列问题:
(1)
 元素在周期表中的位置是
元素在周期表中的位置是(2)
 、
、 、
、 三种元素的原子半径由小到大的顺序为
三种元素的原子半径由小到大的顺序为(3)
 、
、 两元素最高价氧化物对应的水化物反应的化学方程式为
两元素最高价氧化物对应的水化物反应的化学方程式为(4)某同学用
 、
、 两元素的单质反应生成固体物质
两元素的单质反应生成固体物质 ,
, 属于离子化合物,且能与化合物
属于离子化合物,且能与化合物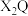 反应生成
反应生成 的单质。
的单质。①
 的电子式为
的电子式为 与
与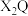 反应的化学方程式为
反应的化学方程式为②该同学认为取
 、
、 两元素的单质反应后的固体物质与
两元素的单质反应后的固体物质与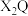 反应,若能产生
反应,若能产生 的单质,即可证明得到的固体物质一定是纯净的
的单质,即可证明得到的固体物质一定是纯净的 。请判断该方法是否合理并说明理由:
。请判断该方法是否合理并说明理由:
您最近一年使用:0次
2020-03-02更新
|
342次组卷
|
3卷引用:专题1微观结构与物质的多样性 模拟高考
解题方法
3 . 四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
(1)Z在元素周期表中位于___________ 族。
(2)上述元素的最高价氧化物对应的四种水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是___________ (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是___________ (填序号)。
A.自然界中的含量 B.相应氯化物水溶液的pH
C.单质与水反应的难易程度 D.单质与酸反应时失去的电子数
②W、X、Y的离子半径由大到小的顺序为_____________________ 。(填对应的离子符号)
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是_________________________ ,混合后溶液中离子浓度由大到小的顺序是__________________________ 。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。
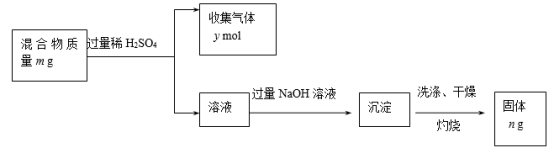
能确定混合物中Y的质量分数的数据有___________ (填序号)。
A.m、n B.m、y C.n、y
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元 素形成的简单离 子中,离子半径 最小 | 最高正价与最 低负价之和为 零 |
(1)Z在元素周期表中位于
(2)上述元素的最高价氧化物对应的四种水化物中,有一种物质在一定条件下均能与其它三种物质发生化学反应,该元素是
(3)①下列可作为比较X和Y金属性强弱的依据是
A.自然界中的含量 B.相应氯化物水溶液的pH
C.单质与水反应的难易程度 D.单质与酸反应时失去的电子数
②W、X、Y的离子半径由大到小的顺序为
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,反应的化学方程式是
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中Y的质量分数的数据有
A.m、n B.m、y C.n、y
您最近一年使用:0次
2017-02-17更新
|
280次组卷
|
2卷引用:2017届福建省厦门大学附中高三上学期第二次月考化学试卷
14-15高三上·北京·期中
解题方法
4 . 现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________ 。
(2)C2B2所含的化学键类型有___________ ;请写出C2B2与A2B反应的离子方程式________________ 。
(3)元素B、C形成的简单离子中半径较大的是_________ (写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________ ,通入A单质的X溶液的pH将__________ (填“增大”、“不变”或“减小”)。

(1)元素D在周期表中的位置是
(2)C2B2所含的化学键类型有
(3)元素B、C形成的简单离子中半径较大的是
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为

您最近一年使用:0次
真题
解题方法
5 . 合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________ 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_______________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_______________ 。其中氮元素原子最外层电子排布的轨道表达式是_________________________ 。通过比较_____________ 可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________ 。CS2熔点高于CO2,其原因是__________ 。
Cu(NH3)2Ac+CO+NH3
 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为
(5)已知CS2与CO2分子结构相似,CS2的电子式是
您最近一年使用:0次
2016-12-09更新
|
2471次组卷
|
4卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)2020届高三化学二轮物质结构题型专攻——原子结构与性质【基础专练】(已下线)上海市中原中学2015届高三第二次月考化学试题湖南省株洲市第十三中学2023-2024学年高二上学期1月期末考试化学试题
13-14高三·全国·课时练习
名校
解题方法
6 . 短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______ 。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______ 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______ 。
(4)A、C、D、E的原子半径由大到小的顺序是_______ (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______ 于F(填“强”或“弱”),并用化学方程式证明上述结论_______ 。
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:
(2)B、D形成的化合物 BD2中存在的化学键为
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为
(4)A、C、D、E的原子半径由大到小的顺序是
(5)元素B和F的非金属性强弱,B的非金属性
您最近一年使用:0次
2016-12-09更新
|
1823次组卷
|
8卷引用:2014年化学高考总复习课时演练 5-3化学键练习卷



