解题方法
1 . 下表为元素周期表的一部分。请回答下列问题:
(1)写出X元素的元素符号:______ 。
(2)C、N两种元素中,原子半径较小的是______ (填元素符号)。
(3)元素Y在元素周期表中的位置为______ 。
(4)写出Z的气态氢化物的电子式:______ 。
碳 | 氮 | Y | |
X | 硫 | Z |
(2)C、N两种元素中,原子半径较小的是
(3)元素Y在元素周期表中的位置为
(4)写出Z的气态氢化物的电子式:
您最近一年使用:0次
名校
解题方法
2 .  是9种中学化学中常见的元素。
是9种中学化学中常见的元素。
(1)原子结构与元素性质
①基态氢原子中,核外电子的电子云轮廓图形状为________ 。
②3种元素 中,离子半径最小的是
中,离子半径最小的是______ (填离子符号)。
③基态 的价层电子轨道表示式为
的价层电子轨道表示式为________ 。
(2)微粒间相互作用与物质性质
①胆矾( )的结构示意图如下所示。
)的结构示意图如下所示。 与
与 与
与 的作用力分别为
的作用力分别为______ 和______ 。
② 的VSEPR模型为
的VSEPR模型为______ , 的分子空间构型为
的分子空间构型为________ , 是
是________ (填“极性”或“非极性”)分子。
③写出 电子式:
电子式:________ , 形成过程的电子式:
形成过程的电子式:______ 。
④比较 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:_______ 。
⑤相同条件下, 在水中的溶解度大于
在水中的溶解度大于 的,理由是
的,理由是_________ 。
 是9种中学化学中常见的元素。
是9种中学化学中常见的元素。(1)原子结构与元素性质
①基态氢原子中,核外电子的电子云轮廓图形状为
②3种元素
 中,离子半径最小的是
中,离子半径最小的是③基态
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)微粒间相互作用与物质性质
①胆矾(
 )的结构示意图如下所示。
)的结构示意图如下所示。
 与
与 与
与 的作用力分别为
的作用力分别为②
 的VSEPR模型为
的VSEPR模型为 的分子空间构型为
的分子空间构型为 是
是③写出
 电子式:
电子式: 形成过程的电子式:
形成过程的电子式:④比较
 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:⑤相同条件下,
 在水中的溶解度大于
在水中的溶解度大于 的,理由是
的,理由是
您最近一年使用:0次
名校
3 . A、B、C、D、E五种原子序数均小于18的元素,且原子序数依次增大,其中B与C的电子层数相同,D与E的电子层数相同,A与D的最外层电子数相同,C与E的最外层电子数相同,E元素的原子最外层电子数是电子层数的2倍,D与其他具有相同电子层数的原子相比半径最大。又知由B元素组成的单质是空气中的主要成分。
(1)B的元素名称是_______ ,该元素的原子结构示意图为_______ ,核外有___ 个未成对电子,用电子式表示B的简单氢化物的形成过程_________ 。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是________ (用离子符号表示)。
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)_____ 。
(4)以下说法正确的是________ 。
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
(1)B的元素名称是
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)
(4)以下说法正确的是
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
您最近一年使用:0次
2024-01-21更新
|
133次组卷
|
2卷引用:黑龙江省牡丹江市第三高级中学2023-2024学年高三上学期第三次月考化学试卷
名校
解题方法
4 . 如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:

(1)由②③④形成的简单离子半径由小到大顺序是_________ (填化学用语)。
(2)元素④的最高价氧化物对应的水化物和元素⑤的最高价氧化物对应的水化物反应的离子方程式为_______ ,⑦的单质和⑨的单质反应的化学方程式为________ ,冶炼单质⑤的方法是_______ (用化学方程式表示)。
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式____ ,该分子中含有的共价键类型为_____ (填“极性共价键”或“非极性共价键”) 。
(4)下列有关性质的比较正确且能用元素周期律解释的是___ (填标号)
A.电负性:②>③ B.最高价氧化物对应的水化物的碱性:④>⑤
(5)③的简单氢化物的沸点高于⑦的简单氢化物的沸点的原因是_______ 。

(1)由②③④形成的简单离子半径由小到大顺序是
(2)元素④的最高价氧化物对应的水化物和元素⑤的最高价氧化物对应的水化物反应的离子方程式为
(3)元素⑦⑧可形成原子个数比为1:1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式
(4)下列有关性质的比较正确且能用元素周期律解释的是
A.电负性:②>③ B.最高价氧化物对应的水化物的碱性:④>⑤
(5)③的简单氢化物的沸点高于⑦的简单氢化物的沸点的原因是
您最近一年使用:0次
5 . 硫、氮的化合物及其相互转化在促进社会进步、资源利用和环境保护中具有重要价值。
(1)下列与氮氧化物无关的环境问题是______。
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液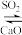 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是___________ 。(用化学方程式表示)
(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是___________ 。
②上述反应中的各物质属于共价化合物是______ ;氧化剂是_______ 。
③配平上述反应方程式,并标出电子转移的方向和数目______ 。
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:________ 。
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c( )最大的是______。
)最大的是______。
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式___________ 。
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是________ 。
(1)下列与氮氧化物无关的环境问题是______。
| A.酸雨 | B.白色污染 | C.光化学烟雾 | D.温室效应 |
(2)工业上先用NaOH溶液吸收SO2,再用CaO使NaOH再生:NaOH溶液
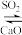 Na2SO3,使NaOH再生的原理是
Na2SO3,使NaOH再生的原理是(3)土壤中的硝酸盐会被细菌分解。有一种细菌是利用土壤中的硫化物来分解硝酸盐,其主要化学反应原理是:K2S + KNO3 +H2O =N2 +K2SO4 + KOH。
①K、S、N、O元素的原子半径从大到小的顺序是
②上述反应中的各物质属于共价化合物是
③配平上述反应方程式,并标出电子转移的方向和数目
④上述反应改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:
(4)氨水、NH4Cl、NH4HCO3、NH4HSO4是常见的氮肥。常温下等物质的量浓度的上述4种溶液中c(
 )最大的是______。
)最大的是______。| A.氨水 | B.NH4Cl | C.NH4HCO3 | D.NH4HSO4 |
(5)某科研小组将微电池技术用于去除天然气中的H2S,装置如图所示,总反应是:2Fe+2H2S+O2=2FeS+2H2O。

①写出负极的电极反应式
②一段时间后,单位时间内H2S的去除率降低,其可能的原因是
您最近一年使用:0次
名校
6 . 电气石是一种具有保健作用的天然石材,其中含有的主要元素为 等元素。
等元素。
(1)上述元素中,原子半径最小的是_______ (用元素符号表示),与硫同周期的元素中简单离子半径最小的是_______ (用离子符号表示);
(2)用轨道表示式表示氧元素原子核外电子的运动状态_______ ;氧元素原子核外有_______ 种不同能量的电子;
(3) 分子中
分子中 为
为_______ 杂化,键角等于_______ ,可以判断出 分子为
分子为_______ 分子(选填“极性”或“非极性”); 晶体的熔点比
晶体的熔点比 晶体
晶体_______ (选填“高”、“低”),原因为_______ 。
 等元素。
等元素。(1)上述元素中,原子半径最小的是
(2)用轨道表示式表示氧元素原子核外电子的运动状态
(3)
 分子中
分子中 为
为 分子为
分子为 晶体的熔点比
晶体的熔点比 晶体
晶体
您最近一年使用:0次
2023高三·全国·专题练习
7 . 有位于前四周期的A、B、C、D、E、F、G七种元素(无稀有气体),它们的核电荷数依次增大。其中C、F、G是金属元素:A和F属同族,它们原子的最外层电子排布式为 。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
(1)G是___________ (用元素符号回答,下同),其最高化合价为___________ 。
(2)元素E的电子所占据的最高能级的原子轨道呈___________ 形。D、E可分别与A形成的最简分子,前者的稳定性弱于后者,从化学键的角度解释的原因是___________ ;
(3)B、C、D、F的简单离子半径由大到小的顺序为:___________ 。
 。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:(1)G是
(2)元素E的电子所占据的最高能级的原子轨道呈
(3)B、C、D、F的简单离子半径由大到小的顺序为:
您最近一年使用:0次
名校
8 . A、B、D、E、M、X、Y、Z是前30号元素,原子序数依次增加。A原子是周期表中半径最小的原子;B的基态原子次外层有2个电子,最外层有3个未成对电子;D原子的2p轨道上有1个电子的自旋方向与其它电子相反;E的价层电子排布式为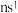 ;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
(1)D、E、M分别形成的简单离子的半径由大到小顺序为(填离子符号)___________ 。
(2)元素B基态原子的核外电子排布式为___________ ,电子的空间运动状态有___________ 种,它与同周期相邻的两种元素中的第一电离由大到小的顺序是___________ (写元素符号)。
(3)Z与D形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为___________ ;
②D的配位数是___________ ;
③D周围最近的D有___________ 个;
④距离Z最近D的为___________ 个;
⑤此晶体的密度为___________  ;(已知晶胞参数为anm)
;(已知晶胞参数为anm)
⑥此化合物先加稀硫酸溶解,再滴加足量的浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,深蓝色溶液中阳离子的化学式为___________ , 该离子含有
该离子含有___________ mol 键,其中配位体为
键,其中配位体为___________ 分子(填“极性”或“非极性”),空间构型为___________ ;
(4)基态M原子电子占据最高能级的电子云轮廓图为___________ 形,将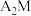 通入
通入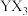 溶液中反应的离子方程式为
溶液中反应的离子方程式为___________ ;
(5)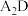 分子中
分子中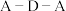 键角比
键角比 中
中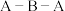 键角
键角___________ ;(填“大”或“小”)
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,C原子的杂化类型为___________ , 的石墨烯中由C原子连接成的六元环的物质的量约为
的石墨烯中由C原子连接成的六元环的物质的量约为___________  ,含有
,含有___________ 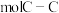 键。
键。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接___________ 个六元环,六元环中最多有___________ 个C原子在同一平面。
(7) 的晶体结构与金刚石类似。
的晶体结构与金刚石类似。 的晶体类型为
的晶体类型为___________ ,晶体中 原子与
原子与 键的数目之比为
键的数目之比为___________ 。
 ;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。
;M和D形成的化合物是引起酸雨的主要大气污染物;常温下,X的单质是一种黄绿色的气体;Y的+3价离子的3d轨道为半充满状态,Z与Y元素位于同一周期,且最外层有一个未成对电子。(1)D、E、M分别形成的简单离子的半径由大到小顺序为(填离子符号)
(2)元素B基态原子的核外电子排布式为
(3)Z与D形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②D的配位数是
③D周围最近的D有
④距离Z最近D的为
⑤此晶体的密度为
 ;(已知晶胞参数为anm)
;(已知晶胞参数为anm)⑥此化合物先加稀硫酸溶解,再滴加足量的浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,深蓝色溶液中阳离子的化学式为
 该离子含有
该离子含有 键,其中配位体为
键,其中配位体为(4)基态M原子电子占据最高能级的电子云轮廓图为
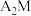 通入
通入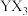 溶液中反应的离子方程式为
溶液中反应的离子方程式为(5)
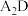 分子中
分子中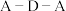 键角比
键角比 中
中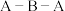 键角
键角(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,C原子的杂化类型为
 的石墨烯中由C原子连接成的六元环的物质的量约为
的石墨烯中由C原子连接成的六元环的物质的量约为 ,含有
,含有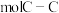 键。
键。②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
(7)
 的晶体结构与金刚石类似。
的晶体结构与金刚石类似。 的晶体类型为
的晶体类型为 原子与
原子与 键的数目之比为
键的数目之比为
您最近一年使用:0次
9 . X,Y、Z、W、R为原子序数依次增大的前20号主族元素,且分属于四个周期。Y的最外层电子数是电子层数的3倍,Z、W为同周期相邻元素,Y、W可形成如图所示的离子,R原子核外无未成对电子。回答下列问题:
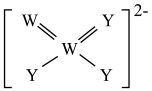
(1)第七周期与Z同族元素的原子序数为___________ 。
(2)Z、W、R简单离子半径由大到小的顺序为___________ (用化学式表示)。
(3)用电子式表示X与R组成的物质的形成过程:___________ 。
(4)Y、W的简单氢化物沸点较高的是___________ (填化学式),判断依据是___________ 。
(5)写出图中离子与稀硫酸反应的离子方程式:___________ 。

(1)第七周期与Z同族元素的原子序数为
(2)Z、W、R简单离子半径由大到小的顺序为
(3)用电子式表示X与R组成的物质的形成过程:
(4)Y、W的简单氢化物沸点较高的是
(5)写出图中离子与稀硫酸反应的离子方程式:
您最近一年使用:0次
名校
10 . 下表为元素周期表的一部分,请根据所学知识回答下列问题:

(1)写出J在周期表中的位置___________ 。
(2)B、D、E的简单离子半径由大到小的顺序是___________ (填离子符号)。
(3)上述元素的原子中,写出未成对电子数最多的元素基态原子的核外电子排布式:___________ 。
(4)上述7种元素中金属性最强的元素与B可形成原子个数比为1:1的化合物甲,则甲的电子式为___________ 。
(5)判断B和D的非金属性强弱,并从结构角度说明原因:___________ 。

(1)写出J在周期表中的位置
(2)B、D、E的简单离子半径由大到小的顺序是
(3)上述元素的原子中,写出未成对电子数最多的元素基态原子的核外电子排布式:
(4)上述7种元素中金属性最强的元素与B可形成原子个数比为1:1的化合物甲,则甲的电子式为
(5)判断B和D的非金属性强弱,并从结构角度说明原因:
您最近一年使用:0次



